Nature Genetics:揭示阿尔茨海默病的遗传与散发机制:唐氏综合征患者的独特视角
7小时前 生物探索 生物探索 发表于上海
本研究通过空间转录组学和单核转录组学等技术,对比唐氏综合征相关阿尔茨海默病与散发型阿尔茨海默病,探讨其分子联系、异同及性别差异等,为AD早期诊断、治疗提供思路,强调未来研究方向。
引言
阿尔茨海默病(Alzheimer's Disease, AD)是当今最具挑战性的神经退行性疾病之一,严重影响全球数千万人的生活质量。随着世界各地人口逐渐老龄化,AD的发病率也在不断上升,带来了巨大的社会和经济负担。在此背景下,研究阿尔茨海默病的发病机制显得尤为重要。近年来,研究人员逐渐意识到,唐氏综合征(Down Syndrome, DS)患者具有极高的阿尔茨海默病发病风险,这种特殊关联为我们理解AD的病理学提供了独特的视角。唐氏综合征患者由于21号染色体的三体性,往往在较年轻时就开始出现与AD相似的病理变化,这为研究AD的早期发病机制和潜在的干预手段提供了宝贵的机会。11月22日Nature Genetics的研究报道“Spatial and single-nucleus transcriptomic analysis of genetic and sporadic forms of Alzheimer’s disease”,通过空间转录组学(Spatial Transcriptomics, ST)和单核转录组学(Single-nucleus RNA-seq, snRNA-seq)等技术,深入探讨了DS与AD之间的分子联系,揭示了两者在基因表达和病理特征方面的异同,希望为AD的早期诊断和治疗提供新的思路。

阿尔茨海默病的病理机制主要涉及β-淀粉样蛋白(Amyloid-β, Aβ)沉积和神经纤维缠结(Neurofibrillary Tangles, NFT)的形成,这些病理变化会导致神经元功能的衰退和死亡。对于唐氏综合征(DS)患者,阿尔茨海默病的发病风险显著增加,约80%的65岁以上DS患者会发展为阿尔茨海默病样痴呆。这一显著的风险增加与21号染色体的三体性密切相关,因为编码淀粉样前体蛋白(Amyloid Precursor Protein, APP)的基因位于21号染色体上,APP的过表达会加速Aβ的形成和沉积。
尽管散发型阿尔茨海默病(sporadic AD, sAD)与唐氏综合征相关阿尔茨海默病(DSAD)在分子和病理特征上存在诸多相似之处,但两者之间的异同点目前研究较少。因此,该研究通过ST和snRNA-seq方法对DSAD和sAD的分子特征进行系统比较,以期更深入了解这两种病理机制的异同。
空间转录组学与单核转录组学的结合
为了揭示阿尔茨海默病的病理过程,研究团队采用了空间转录组学(Spatial Transcriptomics, ST)和单核转录组学(Single-nucleus RNA-seq, snRNA-seq)这两种技术。ST技术可以显示大脑组织内特定空间位置的基因表达情况,而snRNA-seq则能够提供单细胞分辨率的基因表达信息,从而实现对特定细胞类型基因表达的深入分析。
研究团队采集了来自不同群体的前额叶皮层(Frontal Cortex, FCX)样本,包括正常对照组(n=10)、早期AD患者(n=9)、晚期AD患者(n=10)和DSAD患者(n=10)。此外,研究人员还利用了5xFAD转基因小鼠(模拟人类AD中Aβ沉积的模型)以及野生型小鼠,分别在4、6、8和12个月龄进行采样分析,从而进行跨物种比较。
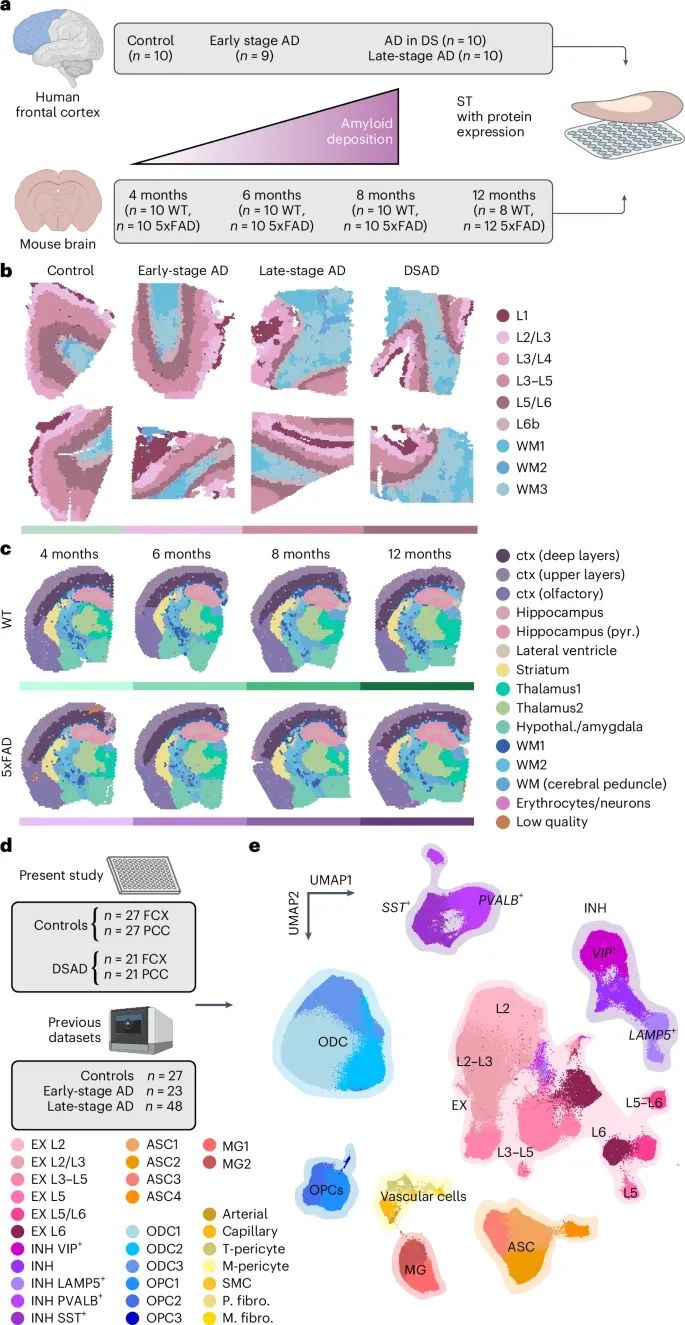
对阿尔茨海默病(AD)的遗传型和散发型进行的空间转录组学(ST)和单核转录组学(snRNA-seq)分析(Credit: Nature Genetics)
实验设计和样本情况:在人类额叶皮层(Frontal Cortex)和小鼠大脑中进行了ST实验,使用10x Genomics Visium技术。人类样本包括10名认知正常对照、9名早期AD患者、10名晚期AD患者和10名唐氏综合征相关阿尔茨海默病(DSAD)患者,共115,251个ST点,每个点平均检测到1,316个基因。小鼠样本包括4、6、8、12个月龄的5xFAD模型和野生型(WT)小鼠,共212,249个ST点,每个点平均检测到2,438个基因。
空间转录组学结果:图b中展示了各疾病条件下的人类ST样本,采用BayesSpace聚类分析对大脑皮层进行注释。图c中展示了不同时间点的5xFAD小鼠样本,每个点根据大脑区域注释,以显示疾病进程中的空间基因表达变化。
单核转录组学结果:在人类前额叶皮层(FCX)和后扣带皮层(PCC)进行了snRNA-seq实验,样本包括27名认知正常对照和21名DSAD捐赠者。此外,还纳入了前期三项AD皮层的snRNA-seq数据(27名对照、23名早期AD和48名晚期AD),总共585,042个单核数据。图e展示了单核转录组数据的UMAP降维图,其中每个点代表一个细胞,根据Leiden聚类分析分配的细胞类型进行颜色标注,包括兴奋性神经元(EX)、抑制性神经元(INH)、小胶质细胞(MG)、星形胶质细胞(ASC)、少突胶质细胞(ODC)等主要脑细胞类型。
跨物种转录组特征比较
通过对人类和小鼠大脑样本的分析,研究人员发现了显著的跨物种特征。在DSAD患者中,21号染色体上的基因表现出显著的过表达,这与APP基因的三体性密切相关。然而,特定大脑皮层区域(如L3/L4层)的APP表达水平并未显著高于正常对照组,提示局部调控机制的存在。
对空间差异表达基因(Differentially Expressed Genes, DEG)的分析表明,许多显著上调的基因主要来源于神经胶质细胞(glial cells)和血管相关细胞,提示这些细胞在AD病理进展中的关键作用,尤其是在炎症反应和血脑屏障功能障碍方面。在人类样本中,共有585,042个单核通过质量控制,识别出了所有主要的大脑细胞类型,包括稀有的血管细胞群。
为了进一步支持这些发现,研究团队进行了基因共表达分析,发现多个与免疫反应相关的基因模块在DSAD样本中显著上调。这些基因包括IL1B和TNF等炎症标志物,它们在小胶质细胞和星形胶质细胞中高度表达,表明炎症反应在DSAD患者的病理进展中起着重要作用。
值得注意的是,小鼠模型研究也得到了类似的发现。在5xFAD小鼠中,小胶质细胞和星形胶质细胞随着年龄增长表现出显著的活化状态,尤其是在12个月龄时,多个与炎症和免疫反应相关的基因模块显著上调。这一现象与人类DSAD患者中观察到的炎症反应高度一致,提示小胶质细胞和星形胶质细胞的异常活化在AD的病理进展中起到重要作用。

阿尔茨海默病(AD)不同亚型的基因表达特征变化(Credit: Nature Genetics)
基因表达差异分析:图a中使用热图展示了DSAD(唐氏综合征相关阿尔茨海默病)相对于对照组的差异基因表达(DEGs),并按染色体和空间区域对基因进行分类。统计显著的基因(FDR < 0.05),且在至少一个区域的平均log2(FC)绝对值≥0.25的基因被展示。图b通过堆叠条形图展示了各空间区域中DSAD与对照组之间的差异表达基因(DEGs)数量,并按染色体进行分类。
与晚期AD共享的空间DEGs:图c显示了在snRNA-seq数据集中,DSAD与晚期AD共享的空间差异表达基因的基因表达值的热图。
空间DEGs的分析:图d中通过snRNA-seq集群标记基因对空间DEGs进行了分析。顶部和底部的柱状图显示了每个空间集群中上调或下调的DEGs数量,中间的比例柱状图显示了空间DEGs中也为snRNA-seq集群标记基因的比例,灰色部分表示不在snRNA-seq标记基因中的空间DEGs。
早期AD与DSAD之间的差异效应大小比较:图e比较了早期AD相对于对照组和DSAD相对于对照组的基因表达差异效应大小,蓝色表示方向一致的基因,黄色表示方向不一致的基因,灰色表示效应大小小于0.05的基因。
晚期AD与DSAD之间的差异效应大小比较:图f比较了晚期AD相对于对照组和DSAD相对于对照组的基因表达差异效应大小,布局与图e相同。
通路富集分析结果:图g和图h展示了在晚期AD和DSAD中上调或下调的基因的选定通路富集结果,这些基因在晚期AD和DSAD中相对于对照组具有相似的变化趋势。图i和图j展示了仅在晚期AD中上调或下调的基因的选定通路富集结果。图k和图l展示了仅在DSAD中上调或下调的基因的选定通路富集结果。
阿尔茨海默病不同阶段的基因表达变化
通过对早期和晚期AD患者样本的差异表达分析,研究人员发现,早期AD主要表现为皮层L3/L4层基因的下调,而这些基因与认知功能相关的突触连接密切相关。这一结果表明,AD在早期可能通过影响皮层突触连接引起认知障碍。在ST分析中,特定的基因模块在不同病理阶段表现出显著的调控差异,例如L3/L4层的基因下调与认知功能衰退密切相关。
进一步的分析显示,与突触可塑性相关的基因(如SYT1和SYP)在早期AD患者中显著下调,表明突触功能障碍是早期AD的重要特征之一。这与认知功能的下降密切相关,进一步证明突触连接的损伤在疾病早期具有核心作用。
同时,研究还观察到,在晚期AD患者中,与突触功能相关的基因进一步下调,表明突触丧失的加剧是疾病进展的一个重要特征。此外,与突触结构维持相关的基因(如PSD95)也在晚期患者中显著减少,进一步支持了神经元功能的显著退化。这些数据表明,从早期到晚期,AD的病理变化表现为突触连接的逐步丧失,最终导致严重的认知功能障碍。
系统水平的基因共表达网络分析
为了深入了解AD中的基因表达网络,研究团队进行了高维加权基因共表达网络分析(high-dimensional Weighted Gene Co-expression Network Analysis, hdWGCNA)。在每一皮层层次中共识别出七个基因模块,并基于表达模式的相似性将其归类为15个“元模块”。这些模块的层次聚类揭示了不同皮层层次在AD各个阶段的系统变化。例如,L3/L4层的基因模块与神经递质传递和Aβ生成密切相关,提示该区域可能在AD早期病理变化中扮演重要角色。
特别值得注意的是,L3/L4层中与神经递质传递相关的基因模块在早期AD中显著下调,包括GRIA1和GRIN2B等谷氨酸能受体基因。其下调可能导致神经元间通信效率下降,从而引发认知能力的衰退。这为靶向神经递质系统的早期干预策略提供了可能性。
此外,在后续分析中,研究人员还发现了一些新的基因模块,这些模块主要涉及到神经炎症和氧化应激的调控。这些基因模块在AD的早期和晚期均表现出动态变化,尤其在晚期阶段,氧化应激相关基因(如GPX1和SOD2)显著上调,表明神经元可能受到氧化损伤。这些数据进一步支持了AD的多因素病理机制,包括炎症、突触功能障碍和氧化应激。
唐氏综合征与阿尔茨海默病的关联:基因与炎症反应
在比较DSAD与sAD时,研究团队发现,尽管两者在某些基因表达特征上存在差异,但它们也共享了许多重要的病理特征。例如,在DS患者中,与AD风险相关的基因在L1层、L3/L4层和白质(White Matter, WM)中显著富集,这些基因与炎症反应、神经元死亡和Aβ纤维的形成密切相关。
在5xFAD小鼠模型中,随着年龄增长,AD风险基因的表达逐渐增加,尤其在皮层深层和白质中显著上调,这支持了唐氏综合征与AD之间的相似性。进一步分析显示,IL-6、C3和C1QA等炎症相关基因在小胶质细胞中显著上调,与小胶质细胞的持续激活密切相关。小胶质细胞的过度激活会导致神经元损伤,加速AD的病理进程。这些数据支持了炎症反应在AD发病机制中的关键作用,尤其是在DSAD患者中更为显著。
进一步的证据来自于跨物种的比较研究。人类DSAD患者和小鼠模型中均观察到了小胶质细胞的异常活化状态,这一现象表明炎症反应可能在AD的进展中具有高度保守的作用。此外,研究还发现,特定的炎症相关基因(如TLR4和NLRP3)在DSAD患者中显著上调,这些基因与炎症信号通路的激活密切相关,进一步提示了免疫系统在AD进展中的核心作用。
阿尔茨海默病的性别差异
AD的发病机制中存在显著的性别差异。在该研究中,研究团队发现DSAD在不同性别中表现出不同的转录组特征。在女性患者中,与炎症、氧化应激和葡萄糖代谢相关的基因显著上调,而在男性患者中,更多与染色质组织和细胞骨架相关的基因上调。
例如,女性患者的微胶质细胞(microglia)在皮层L6b层和白质中表现出更强的激活状态,而在男性患者中,Aβ相关过程则集中在皮层L3–L5层。这些性别特异性的差异可能与AD在不同性别中的发病机制有关。此外,基因共表达网络分析显示,在女性患者中,L1层中的一个基因模块(M11)显著上调,包含与免疫反应和神经元死亡相关的基因,如C1QB和C3。
成像质谱细胞术(Imaging Mass Cytometry, IMC)分析进一步证实,与炎症反应相关的蛋白(如C3和GFAP)在女性患者中的表达水平显著高于男性,这表明女性患者在AD过程中表现出更强的炎症反应。这种性别特异性的差异可能对AD的个性化治疗策略具有重要意义。
此外,进一步的分析揭示,女性患者中的氧化应激标志物(如HMOX1和NOS2)显著上调,这表明女性可能在疾病过程中经历更强的氧化压力。这一发现提示,在制定治疗策略时,需要考虑到性别差异以实现更精确的治疗。
基于质谱成像的蛋白表达分析
为了验证转录组学的结果,研究团队还使用成像质谱细胞术(IMC)分析大脑样本中的蛋白表达。结果显示,AD患者神经元中的Aβ和磷酸化tau蛋白显著增加,而神经元特异性蛋白(如Map2)则减少,表明神经退行性改变的存在。此外,DSAD患者神经元中磷酸化tau蛋白的负担更高,提示tau病理在该人群中更为严重。
IMC进一步揭示,DSAD和晚期AD患者大脑样本中,小胶质细胞和星形胶质细胞中的Cystatin C(CST3)显著过表达。CST3的过度表达与Aβ共定位,表明其在病理进程中可能起着重要作用,尤其在神经炎症恶化和神经元损伤方面。特别是,在晚期AD患者中,CST3与磷酸化tau的共表达增加,提示CST3可能与tau病理的加剧有关,为未来开发针对CST3的靶向治疗提供了新方向。
该研究通过结合ST和snRNA-seq技术,深入探讨了遗传型与散发型AD的分子特征及其差异。尽管DSAD和sAD在基因表达特征上存在某些差异,但它们也共享许多关键的病理特征,特别是在炎症反应和Aβ积累方面。此外,性别差异在AD发病机制中的重要性也得到了强调。
这些发现加深了我们对AD分子机制的理解,为未来开发更具针对性的治疗策略提供了新方向。未来研究可以利用更多的组学技术,结合大规模临床样本,更全面地揭示AD的病理机制,探索如何通过干预这些机制来延缓或逆转疾病的进展。
特别地,未来研究可以进一步关注炎症反应在AD中的作用,特别是在DS患者中。DS患者表现出的独特基因和蛋白表达模式提示炎症是其发病过程中重要的环节。此外,考虑到性别差异在AD进展中的影响,制定个性化的性别特异性干预措施可能是有效的治疗方向。
未来还可以重点研究氧化应激在AD中的作用,尤其是其在不同性别中的表现差异。这些信息将有助于开发更加精确和个性化的干预措施,从而提高治疗效果。此外,靶向小胶质细胞和星形胶质细胞的抗炎治疗策略在未来也应得到更多关注,因为这些细胞在AD的进展中扮演了重要角色。
参考文献
Miyoshi, E., Morabito, S., Henningfield, C.M. et al. Spatial and single-nucleus transcriptomic analysis of genetic and sporadic forms of Alzheimer’s disease. Nat Genet (2024). https://doi.org/10.1038/s41588-024-01961-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













DS.AD的关系
2
前往app查看评论内容
2 0
#阿尔茨海默病# #唐氏综合征#
3