卵巢透明细胞癌PD-L1(22C3)阳性率高,CPS优于TPS指导免疫治疗,复发病灶可候选
2024-11-02 苏州绘真医学 苏州绘真医学 发表于上海
抗PD-1/PD-L1抑制剂是一种有前景的OCCC治疗选择。对于PD-L1表达的评估,CPS比TPS更推荐。
卵巢透明细胞癌(OCCC)对铂类药物耐药,在抗PD-1/PD-L1抑制剂的临床试验中显示出良好的反应。通过评估PD-L1表达,研究者试图确定PD-1/PD-L1抑制剂在OCCC中的潜在治疗获益。
本回顾性研究包括2019年至2022年在北京协和医院就诊的152例OCCC患者。本研究还纳入了原发和复发病灶配对的肿瘤(来自15例患者的17对)或原发和转移病灶配对的肿瘤(来自9例患者的11对)。采用22C3 pharmDx法和全切片进行PD-L1免疫组织化学染色。具有上市前临床试验经验的病理学家根据各种诊断标准(TPS 1%,CPS 1或CPS 10)评估PD-L1表达。PD-L1阳性病例34例(22.4%,TPS≥1%)、59例(38.8%,CPS≥1分)。PD-L1高表达(CPS≥10)病例33例(21.7%)。铂类耐药患者中有一半(11/22)为PD-L1阳性(CPS≥1)。此外,PD-L1阳性表达(CPS≥1)与代表较差预后的临床病理特征相关,如进展期、淋巴结转移和远处转移(分别为p=0.032,p<0.001和p=0.003)。PD-L1在匹配的复发灶中的表达与原发灶相同或更高。
总之,抗PD-1/PD-L1抑制剂是一种有前景的OCCC治疗选择。对于PD-L1表达的评估,CPS比TPS更推荐。当没有原发肿瘤组织时,对复发病灶的评估仍然是合适的和有预测性的。远处转移灶可作为PD-L1检测的替代标本,而淋巴转移灶不建议使用。
研究背景
尽管卵巢癌(OC)在女性最常见的癌症中排名第八,但却是最致命的妇科恶性肿瘤。卵巢透明细胞癌(OCCC)是卵巢癌的一种组织学亚型,因其对铂类药物化疗耐药而广为人知。OCCC患者的预后较同时期其他OCs亚型(如高级别浆液性癌)患者差。新疗法的发现和验证迫在眉睫。
针对PD-1/PD-L1系统的免疫检查点阻断(ICB)最近成为实体瘤的革命性治疗方法。使用抗PD-1/PD-L1治疗OC患者的最大规模临床试验是KEYNOTE-100。研究发现,OCCC患者的治疗反应率高于其他OC亚型患者。因此,抗PD-1/PD-L1抑制剂在OCCC的临床治疗中具有广阔的前景。
抗PD-1/PD-L1药物提高了免疫细胞,尤其是T淋巴细胞特异性杀伤肿瘤细胞的能力,同时对健康细胞几乎没有伤害。然而,并不是所有患者都能从这种治疗中获益。鉴于抗PD-1/PD-L1药物的治疗费用较高,专门治疗那些最有可能受益的个体是合理的。
PD-L1表达是目前经过验证的最有效的肿瘤免疫治疗预测生物标志物。然而,尽管PD-L1鉴定至关重要,但通过免疫组化评估PD-L1仍存在某些挑战。
首先,不同的PD-L1抗体在分析性能方面并不相同。迄今,美国食品药品监督管理局(FDA)已批准了4种用于PD-L1免疫组化的伴随诊断检测法。Dako 22C3已被批准用于PD-L1检测,用于帕博利珠单抗治疗多种实体肿瘤,包括非小细胞肺癌、食管鳞状细胞癌和宫颈癌。其他三种检测方法(Ventana SP142、Dako 28-8和Ventana SP263)已被批准用于不同的免疫治疗药物和癌症类型。在四种方法中,22C3方法对检测肿瘤细胞表达最敏感。其匹配药物帕博利珠单抗是第一个获批且应用最广泛的免疫治疗药物。迄今为止,已有多项研究报道了PD-L1在OCCC中的表达。然而,其中一些并没有使用FDA批准的检测方法。
此外,PD-L1的时空异质性仍然是PD-L1解读的一个重要问题。PD-L1表达在肿瘤内部以及原发肿瘤与转移或复发肿瘤之间存在显著差异。包含每个样本至少5个核心的组织微阵列(TMA)与全切片的评估一致。然而,在以往对OCCC PD-L1表达的研究中,大多数研究采用的TMA为2-3个核心/例,这不足以代表整个组织切片。Chen等人使用全切片和22C3抗体进行PD-L1评分,但该研究仅纳入了24例OCCC患者。
在本研究中,研究者使用22C3 pharmDx检测法和全切片进行PD-L1的免疫组织化学染色。研究还纳入了配对的原发癌及其转移或复发样本。
研究方法
术后切除状态分为3类:R0(肉眼无肿瘤残留)、R1(残留病灶≤1 cm)、R2(残留病灶> 1 cm)。铂类耐药疾病的定义为在维持治疗期间疾病进展或持续,或者在铂类化疗完成后6个月内完全缓解和复发。计算肿瘤比例评分(TPS)和综合阳性评分(CPS)以判断PD-L1的表达。TPS定义为在任何强度下显示部分或完全膜染色的存活肿瘤细胞的百分比。CPS为PD-L1染色细胞(肿瘤细胞、淋巴细胞、巨噬细胞)数量除以存活肿瘤细胞总数,再乘以100。然而,值得注意的是,转移淋巴结并不适合使用CPS系统评估PD-L1,因为肿瘤浸润的淋巴样细胞与背景淋巴样细胞难以区分和测量。采用不同的阈值确定PD-L1的表达。PD-L1表达阳性的定义为TPS≥1%或CPS≥1。CPS≥10判定为PD-L1高表达,可能与免疫治疗反应较好相关。
研究结果
临床病理信息和PD-L1表达:
患者年龄从25岁到77岁(中位51岁)。超过一半的患者被诊断为I期疾病(FIGO,2014)。152例患者中有40例(26.3%)在腹水或腹膜冲洗处发现恶性细胞。38.8%的病例在手术中发生肿瘤破裂。大多数患者达到最佳体积缩小(93.4%)并接受辅助化疗(95.4%)。多数病例伴有子宫内膜异位症(67.8%)。临床病理特征详情见表1。
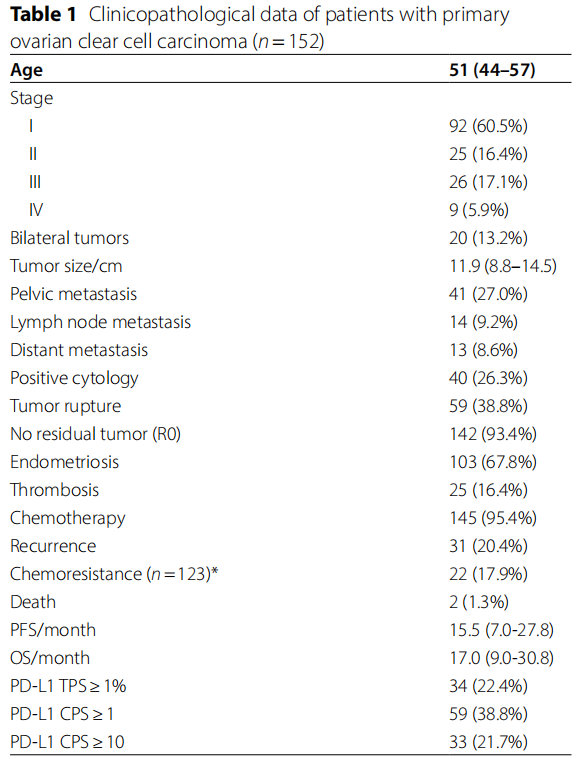
表1
使用三个不同的阈值评估了PD-L1的表达。图1显示了典型的图形。TPS 1%和CPS 1不同阈值的PD-L1阳性患者分别有34例(22.4%)和59例(38.8%)。PD-L1高表达(CPS≥10)者33例(21.7%)。在随访时间足够确定药敏结果的123例患者中,22例为铂类耐药。根据不同的划分值,27.3%或50%的铂耐药患者PD-L1阳性。对铂类耐药的5例患者(22.7%)具有高PD-L1表达(CPS≥10)。
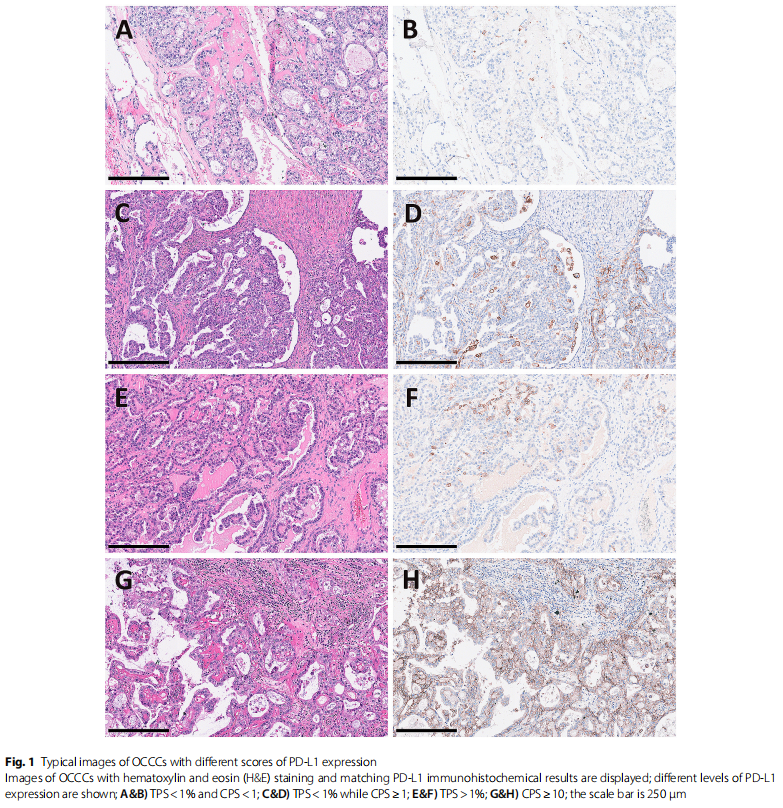
图1
评估PD-L1表达与临床病理资料的关系。无论基于TPS还是CPS,阳性PD-L1在统计学上与淋巴结转移相关(p = 0.023或p < 0.001)。此外,PD-L1阳性表达(CPS≥1)也与晚期疾病和远处转移相关(分别为p = 0.032和p = 0.003)。
预后因素分析:
采用Cox回归进行预后分析。在单变量分析中,PD-L1表达阳性(TPS≥1%)患者的复发风险比为2.31(95%CI 1.09 ~ 4.92,p = 0.029)。绘制Kaplan-Meier曲线显示PD-L1表达与PFS的关系(图2)。此外,不良预后还与晚期、双侧肿瘤、盆腔植入、淋巴结转移、远处转移、细胞学阳性和肿瘤残留相关(Cox回归,单因素分析)。
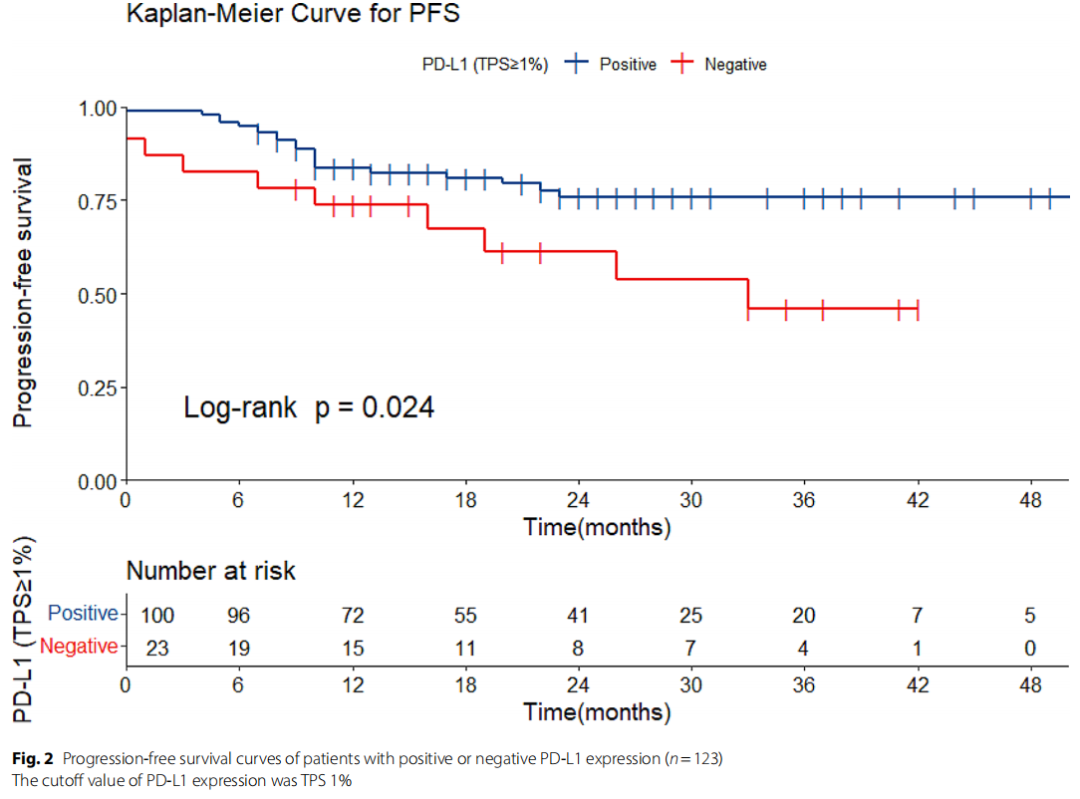
图2
在多变量分析中,双侧肿瘤和阳性细胞学仍然与不良预后相关(图3),风险比分别为4.17(95%CI 1.67-10.37,p = 0.002)和2.56(95%CI 1.17-5.60,p = 0.019)。
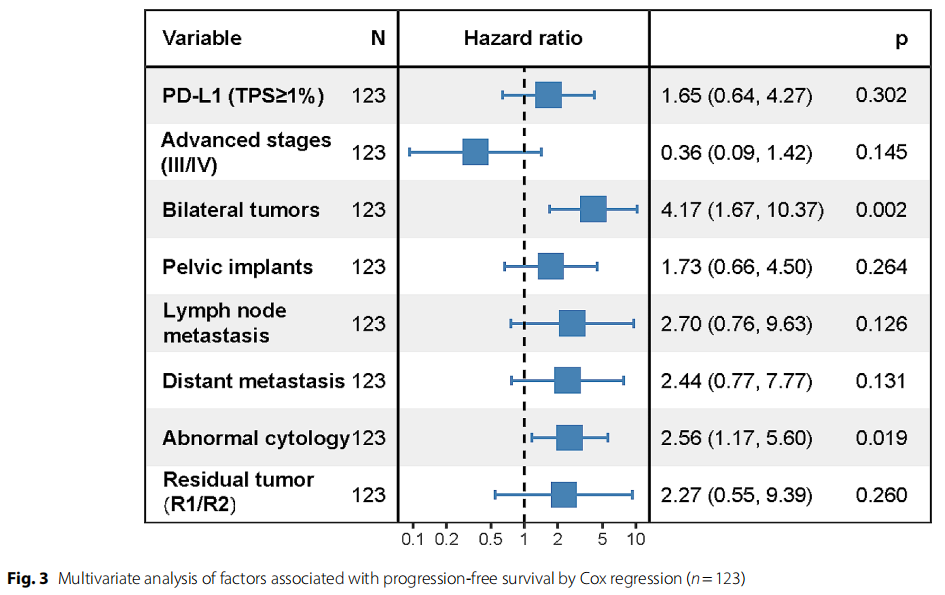
图3
PD-L1在原发灶和复发灶中的表达差异:
表2列出了17对原发和复发病灶的PD-L1表达状态。在纳入的15例患者中,4例接受了免疫治疗,随后实现部分或完全缓解。然而,由于4例患者接受的疗程和抗PD-L1治疗的抗体不同,因此很难确定PD-L1表达与治疗反应之间的相关性。患者R12在复发病灶提交前接受了免疫治疗,其余3例患者在复发部位手术后接受了治疗。
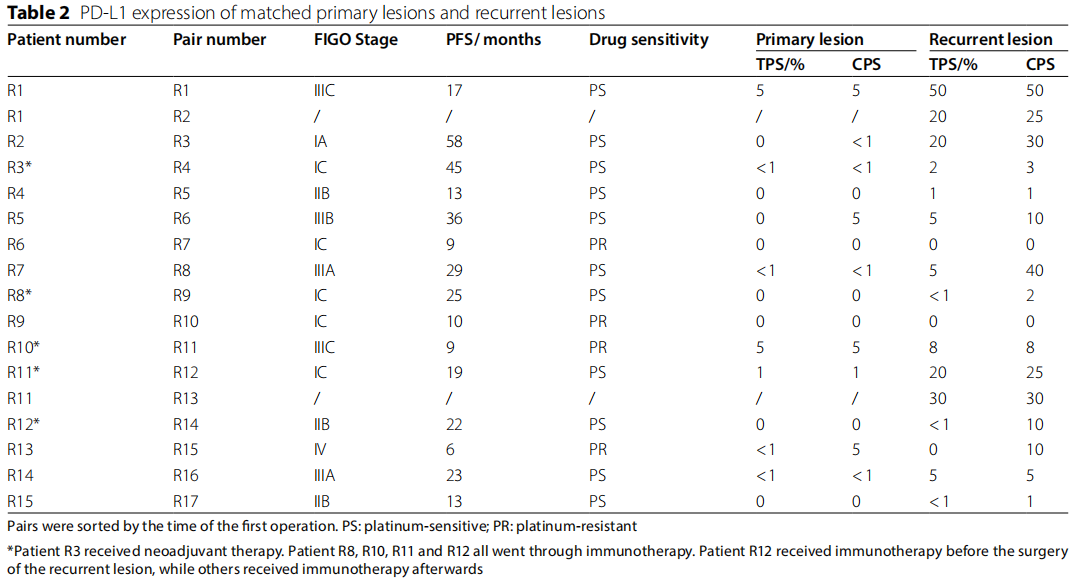
表2
与原发肿瘤相比,大部分复发肿瘤的TPS或CPS值较大(15/17,88.2%)。在另外两对(R7和R10对)中,原发和复发肿瘤均缺乏PD-L1表达。此外,所有原发病灶CPS均<10,而超过一半(9/17)的复发病灶CPS达到10。
研究者发现,在一组特定的患者中,PD-L1在复发病灶中表达,而在原发病灶中不表达(根据TPS,6/15;根据CPS,8/15)。这些患者对铂类药物治疗均敏感,但部分患者出现铂类耐药且PD-L1表达状态在原发病变和复发病变之间保持不变。此外,当以TPS 1%为阈值时,复发病灶中PD-L1表达增高的患者(n = 6)较PD-L1表达始终阴性的患者(n = 6)有更长的PFS(Mann-Whitney U检验,Z=-2.326,p = 0.015)。将阈值改为CPS 1时,也得到了类似的结论(n = 8 vs. n = 2,Mann-Whitney U检验,Z=-2.095,p = 0.044)。值得注意的是,PD-L1表达升高的患者中有3/6被诊断为晚期,而PD-L1表达始终阴性的患者中有1/6被诊断为晚期(TPS 1%)。阈值CPS 1的结果与上述结果相似(2/6 vs. 0/2)。
PD-L1在原发灶和转移灶中的表达差异:
评估了11对原发和转移病灶的PD-L1表达情况。对于淋巴结转移部位,仅评估其TPS值。当阈值为TPS 1%时,大多数原发灶和转移灶的PD-L1表达相似(7/11,63.6%)。原发灶和远处转移灶的PD-L1表达状态一致(M6对)。
令人惊讶的是,在患者M5中,研究者发现原发病灶和肝转移部位均表现为TPS≥1%和CPS≥10。但在腹膜后淋巴结转移部位,TPS<1%。
讨 论
本研究是迄今为止最大的通过评估原发病灶来分析OCCC中PD-L1表达的研究。研究者首次评估了来自同一患者的配对样本中PD-L1表达的差异,以比较原发肿瘤和复发或转移病灶。研究者还比较了不同化疗敏感性水平患者的PD-L1表达。
采用PD-L1 IHC 22C3 pharmDx试剂盒,是目前最敏感的PD-L1抗体,与临床医学密切相关。研究者使用全切片代替TMA来保证PD-L1评估的准确性。PD-L1评估标准与临床试验相同,判断病理医师具有参与临床试验的PD-L1评估经验。在本研究中,应用了三个不同的PD-L1表达阈值,包括TPS 1%,CPS 1和CPS 10。参考其他肿瘤中推荐的阈值并结合OCCC临床试验结果确定了这三个划分值。PD-L1在非小细胞肺癌中的表达由TPS 1%确定。在最大规模的卵巢癌PD-L1临床试验(KEYNOTE-100)中,CPS 1或CPS 10被用作阈值。此外,CPS 10组的缓解率较高。
在本研究中,根据不同的诊断标准,22.4 ~ 38.8%的OCCC患者为PD-L1阳性。本研究结果与既往大多数研究的结果(PD-L1阳性率为16.7 ~ 33.3%)相似。然而,在日本最近的一项研究中,高达86.4%的病例为PD-L1阳性。由于本研究应用了不同于其他研究(克隆27A2,MBL)的抗体,因此很难区分不同患者组之间是否存在真正的差异。此外,21.7%的OCCC具有PD-L1高表达(CPS≥10),这与抗PD-1/PD-L1治疗的高反应率相关。在铂类耐药的患者中,PD-L1阳性比例也相当高(以CPS 1为阈值时为50.0%)。鉴于肿瘤中PD-L1表达可预测免疫治疗反应,因此有理由认为抗PD-1/PD-L1治疗可能对OCCC有效。
根据既往研究,PD-L1表达对预后的影响存在争议。在本研究中,单因素分析显示PD-L1 TPS≥1%与较短的PFS显著相关。但校正后差异无统计学意义。当阈值为CPS 1时,PD-L1高表达与代表较差预后的临床病理特征相关,如晚期或淋巴结和远处转移。
将原发灶和复发转移灶配对样本纳入本研究。Li等人比较了PD-L1在原发和复发肿瘤中的表达,但肿瘤来自不同的患者,因此缺乏可比性。关于转移灶,OCCC的转移方式包括淋巴转移、血行转移和种植转移。Parvathareddy等人关注了种植,研究了原发肿瘤和腹膜转移肿瘤之间的差异。在本研究中,研究者通过纳入匹配的淋巴结或远处器官转移病灶来密切关注淋巴或血行转移。
值得注意的是,与原始肿瘤相比,研究者在复发性癌症中只观察到PD-L1表达增加,而没有减少。在一项对匹配的原发和复发胶质瘤中PD-L1表达的比较研究中,复发灶中PD-L1表达也呈上升趋势。根据Fernandez的研究,22C3表位随时间的推移而不稳定,而且与新鲜组织相比,该信号更有可能在陈旧组织中丢失,这可能也有助于本研究结果。综上所述,当没有原发肿瘤组织时,对复发病灶的评估仍然是合适的和有预测性的。对于机制的解释,PD-L1通路在复发性病变中可能比在原发性病变中更活化。由于PD-L1参与免疫逃逸,PD-L1表达增加意味着肿瘤具有更强的免疫耐受能力。
此外,与之前对脑胶质瘤的研究相似,研究者还发现对于那些原发灶为PD-L1阴性的患者,PD-L1在复发部位的表达增加与更好的预后相关(p < 0.015或p = 0.044)。更令人意外的是,更多PD-L1结果升高的患者被诊断为晚期,这应该导致较差的预后。在本队列中,复发肿瘤中PD-L1表达高于原发肿瘤的患者均对铂类药物敏感,这可能部分解释了他们较好的预后。但受本研究样本量小的限制,PD-L1升高与铂类药物治疗反应的关系值得进一步研究。
此外,复发病灶中PD-L1表达升高是否与较好的免疫治疗反应有关仍不清楚。本队列中只有4例患者接受了免疫治疗,并接受了不同的免疫检查点抑制剂治疗。研究者注意到这些患者复发部位的CPS均大于1,而患者R8和R12的TPS均小于1%。4例患者均观察到完全或部分缓解。因此,CPS可能是评估OCCC中PD-L1表达的更好选择。
由于PD-L1表达的显著空间异质性,初次手术后选择病变的数量和位置进行评估具有挑战性。研究者比较了原发肿瘤及其并发转移灶的PD-L1表达。由于淋巴结转移病灶可能与初始病灶有显著差异,因此不适合进行PD-L1筛查。相反,远处转移肿瘤显示出与原发肿瘤一致的PD-L1表达,可以为PD-L1评估提供另一种样本。
本研究应在其局限性内进行解读。铂类耐药患者或配对病变的小样本量强调了进行进一步研究的必要性。为了确定抗PD-1/PD-L1治疗的治疗效果,需要更多的研究。
总之,通过免疫组织化学染色评估PD-L1的表达后,研究者认为抗PD-1/PD-L1抑制剂是一种可行的治疗OCCC的选择。复发肿瘤PD-L1表达高于或等于原发肿瘤。当无原发病灶时,复发病灶的评估可作为一种替代方法。考虑到免疫治疗的效果,CPS可能优于TPS。这些发现为OCCC中PD-L1的评估提供了宝贵的经验。
参考文献:
Gao Y, Pan B, Jia H, Zhang Y, Wang S, Wang Y, Zhang S, Li M, Wang A, Wang X, Zhao K, Zhang Z, Sun J, Guo D, Liang Z. PD-L1 expression in ovarian clear cell carcinoma using the 22C3 pharmDx assay. Diagn Pathol. 2024 Jun 15;19(1):82. doi: 10.1186/s13000-024-01510-4. PMID: 38879528; PMCID: PMC11179196.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#卵巢透明细胞癌# #OCCC#
19