【弋麻护航】一例终末期心衰患者左心辅助装置植入术的病例分享
2024-12-26 古麻今醉网 古麻今醉网 发表于陕西省
本文介绍 73 岁男性患者行左心辅助装置(LVAD)植入术的病情、麻醉处理过程及术后转归,探讨 LVAD 植入术麻醉面临的挑战及应对策略,强调个体化麻醉方案对保障手术成功和改善预后的关键作用。
病情介绍
基本信息:患者,男性,73岁,身高172cm,体重57kg。
现病史:反复胸闷气喘10余年,再发伴加重1周入院。
既往史:既往有冠心病16年,分别于2007年、2021年共植入3枚冠脉支架,并于2023年行心脏再同步化治疗除颤器(CRTD)植入术。
术前相关检查及化验
超声心动图:LVDd 84mm,LA 53mm,LVEF 17.2%,RV-FAC 18%,TAPSE 14.1mm,二尖瓣极重度反流、主动脉瓣钙化并轻度反流、肺动脉收缩压中-重增高伴三尖瓣中-重度反流、心脏扩大左室壁弥漫性变薄、心尖段菲薄伴室壁瘤形成、局部附壁血栓形成、左室收缩功能明显减低、右室收缩功能减低。(图1)
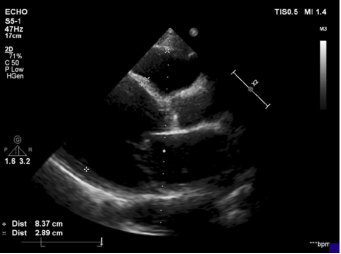
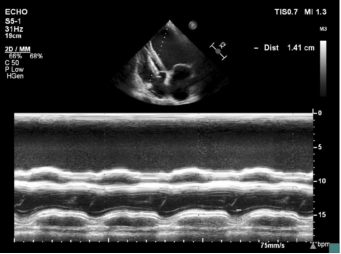
图1 术前心超
上:左室长轴切面,可见左室内径显著扩大;下:四腔心切面,M超示心尖段室壁瘤形成,轻微矛盾运动。
Holter:窦性心律,起搏心律频发房性早搏,部分成对及短阵房速,频发室性早搏,ST-T改变。
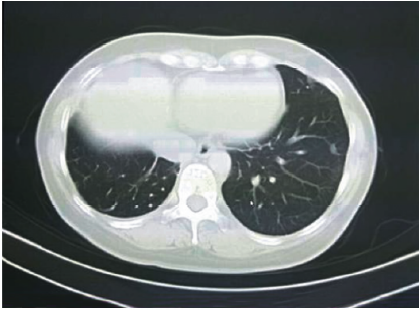
胸部CT:心脏增大,心包膜钙化。(图2)
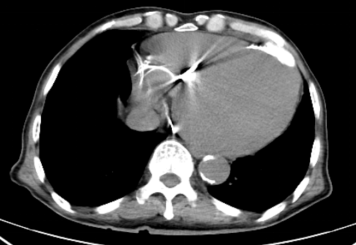
图2 术前胸部CT
可见心脏显著扩大,心胸比显著增大,心包钙化
心脏大血管CTA:左心室室壁瘤形成,主动脉瓣钙化,左心室肌广泛钙化。(图3)
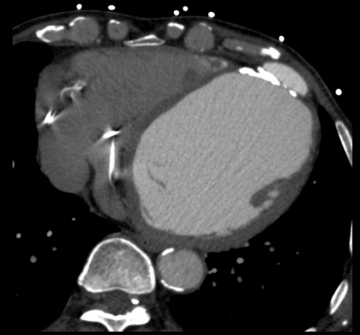
图3 术前心脏大血管CTA
可见心脏体积增大,左室心肌厚薄不均、广泛钙化,心尖段室壁瘤形成
CAG:左主干末端50%狭窄,前降支最重处60%狭窄,回旋支全程弥漫性狭窄,最重处50%狭窄,右冠全程弥漫性狭窄伴钙化形成,最重处90%狭窄。
右心导管:PAP 75/30(50)mmHg,PAWP 28/23(26)mmHg,CO 3.5L/min,PVR 6.9wood。
实验室检查:B型脑钠肽 1431 pg/ml,总胆红素28.23μmol/L,肌酐 114.4μmol/L。
术前诊断:1.缺血性心肌病 PCI术后;2.低EF心力衰竭;3.心脏瓣膜病:二尖瓣关闭不全、三尖瓣关闭不全;4.CRTD 植入术后;5.心功能IV级;6.重度肺动脉高压(SPAP 73mmHg)。
术前药物治疗:多巴胺、新活素、达格列净、呋塞米、螺内酯、氯化钾、倍他乐克、单硝酸异山梨酯、阿托伐他汀钙片、低分子肝素。
拟施手术:左心辅助装置(LVAD)植入术。
麻醉处理
麻醉监测:常规监测ECG,SpO2,超声引导下左桡动脉穿刺置管监测IBP,连接liDCO血流动力学监测仪监测CO,SVR,程控将起搏器设置为VOO模式,关闭自动除颤功能,并提前贴好体外除颤电极片。
麻醉诱导:滴定法分次缓慢给予咪达唑仑1.5mg,依托咪酯12mg,舒芬太尼100ug,顺式阿曲库按14mg。诱导过程中IBP、SVR较诱导前略有降低,给予去甲肾上腺素2μg。气管插管后置入食道超声探头,右颈内静脉穿刺分别置入双腔中心静脉导管和漂浮导管,监测CVP,PAP,PAWP。
体外循环前的麻醉管理:静脉泵注丙泊酚、瑞芬太尼维持麻醉。IBP 86/52mmHg,PAP 72/30mmHg,CVP 15mmHg,TEE提示左右心室扩大,收缩功能减低,三尖瓣中-重度反流,去甲肾上腺素0.03μg/kg/min泵注,NO 20ppm吸入。体外循环前IBP 95/54mmHg,PAP 31/17mmHg,CVP 6mmHg。
体外循环后的麻醉管理:主动脉开放后自动复跳,程控将起搏器设置为VVI模式,起搏心率90bpm。TEE指导下进行心脏及LVAD泵内排气,确认LVAD泵引流血流的方向与二尖瓣开口同轴。LVAD开始工作后,逐渐减少体外循环机器流量,完成过渡。停机后IBP 69/61mmHg,PAP 47/27mmHg,CVP 18mmHg,PAWP 7mmHg。TEE检查发现右心胀,左心较空,室间隔左偏,降低LVAD泵转速,同时予以去甲肾上腺素0.05μg/kg/min、多巴酚丁胺5μg/kg/min泵注,NO 20ppm吸入。处理后IBP 79/68mmHg,PAP 27/17mmHg,CVP 8mmHg,LVAD流量 3.13L/min,转速 2797rpm,功率2.77w,TEE检查室间隔基本居中,主动脉瓣间断开放(图4)。动脉血气分析示pH 7.453,PaO2 458mmHg,PaCO2 32.5mmHg,K+ 3.7mmol/L,Lac 1.4mmol/L,Hb 85g/L,输注红细胞悬液2U,静脉泵注KCl 1g,复查血气pH 7.430, K+ 4.01mmol/L,Hb 96g/L。手术结束后程控恢复CRTD的自动除颤功能,患者带管送入重症医学科。(术中麻醉记录见图5)
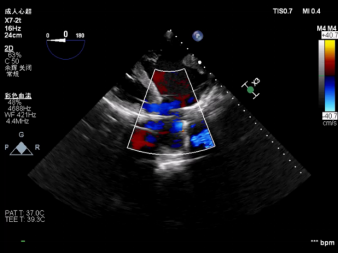
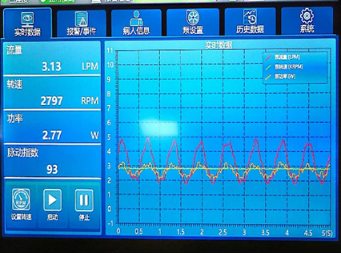
图4 体外循环结束后心超及LVAD参数
上:四腔心切面提示室间隔基本居中;下:LVAD流量、转速、功率等实时参数


图5 术中麻醉记录单
患者术后转归:患者于2024年8月27日16:50转入重症医学科,次日拔除气管导管,2024年8月30日转入心脏大血管外科普通病房,经康复治疗后于2024年9月14日出院。
讨论
全球心力衰竭患病率不断攀升,从1990年的3350万人增加到2017年的6430万人1。与药物治疗相比,LVAD已被证实能够显著改善难治性心衰患者的预后2。精确、完善的围术期管理对于LVAD 治疗的近期和长期效果至关重要。然而,接受LVAD治疗的患者往往处于终末期心衰状态,各主要器官功能的储备能力极差,为麻醉管理带来了极大的挑战。
本例患者为终末期心衰,左心显著扩大、射血分数极低。此类患者术前依赖于异常激活的交感-肾上腺素能系统维持心输出量和血压3,4,麻醉药物的交感抑制作用会打破这一平衡,引起严重低心排和低血压5。此外,该患者冠脉病变严重,心梗后室壁瘤形成,诱导时还要保证足够的麻醉深度,以减少应激降低心肌氧耗。因此,我们选择了对血流动力学影响较小的药物,缓慢滴定式诱导,并且进行了血流动力学监测,实时观察诱导过程中CO、SVR的变化,针对性的使用血管活性药物,维持诱导期间血流动力学的稳定。针对该患者存在的肺动脉高压,诱导期间应保证良好的通气,避免缺氧和高碳酸血症引起肺动脉收缩进一步增加肺动脉压力。同时,采取了小潮气量机械通气合并NO吸入的方法,使术中的的肺动脉压力较术前明显降低。
体外循环结束后是LVAD手术最关键的阶段,泵装置的启动对右心功能提出了更高要求。LVAD植入对于右心功能的影响是一把“双刃剑”,一方面左心功能的改善可以减少肺淤血,降低左心功能不全引起的肺动脉高压,减轻右心的后负荷,但同时突然增加的血流量会显著增加右心的前负荷6。此例患者术前已经存在右心功能不全(RV-FAC 18%,TAPSE 14.1mm),需特别警惕LVAD植入后的右心衰竭。因此,该患者围术期处理的核心是维持和改善右心功能。TEE和漂浮导管对于此类患者具有重要的指导意义,在体外循环刚停机的阶段出现了循环不稳定的情况,表现为低血压、CVP升高,此时通过TEE发现右房右室扩大,右室收缩减弱,室间隔左偏,提示右心功能不全,据此,我们使用多巴酚丁胺强心,吸入NO降低右心后负荷,同时调低LVAD泵转速,降低右心前负荷。经处理后左右心功能匹配,室间隔基本居中,血流动力学改善明显。
本例患者心脏明显扩大,心脏电生理紊乱,术前心电图提示频发室早、房早,一年前植入了CRTD。对于此类患者,在强电磁环境下,如术中外科电刀的使用,可能会出现ICD误放电的情况7,8。因此,该患者在术前通过程控关闭了ICD功能,同时贴好体外除颤电极片便于术中及时除颤,在手术结束脱离强电磁环境后再开启ICD功能。此外,此类患者围术期要注意纠正电解质紊乱,适当补钾补镁,维持血钾在4.0-4.2mmol/L左右,减少心律失常发生的风险。该患者在体外循环结束后将起搏器设置为VVI模式,一方面是此阶段基本不使用电刀,电磁干扰较小;另外主要是考虑此时窦房结、房室结等传导系统功能尚未完全恢复,VVI模式下可以保证心室以固定频率收缩,待患者恢复一段时间后,可将VVI改为其他更生理的起搏模式,如DDD。
综上,LVAD植入术麻醉面临多重挑战,需要根据患者的临床特点,制定个体化的麻醉方案。术前充分评估和优化患者状态,术中采用精准的血流动力学和TEE监测,并做好相应药物和设备准备,术后密切监测病情变化,及时处理并发症,是保障手术成功和改善预后的关键。
参考文献
1. Bragazzi NL, Zhong W, Shu J, Abu Much A, Lotan D, Grupper A, Younis A, Dai H: Burden of heart failure and underlying causes in 195 countries and territories from 1990 to 2017. Eur J Prev Cardiol 2021; 28: 1682-1690
2. Stevenson LW, Miller LW, Desvigne-Nickens P, Ascheim DD, Parides MK, Renlund DG, Oren RM, Krueger SK, Costanzo MR, Wann LS, Levitan RG, Mancini D, Investigators R: Left ventricular assist device as destination for patients undergoing intravenous inotropic therapy: a subset analysis from REMATCH (Randomized Evaluation of Mechanical Assistance in Treatment of Chronic Heart Failure). Circulation 2004; 110: 975-81
3. Kristensen SD, Knuuti J, Saraste A, Anker S, Botker HE, Hert SD, Ford I, Gonzalez-Juanatey JR, Gorenek B, Heyndrickx GR, Hoeft A, Huber K, Iung B, Kjeldsen KP, Longrois D, Luscher TF, Pierard L, Pocock S, Price S, Roffi M, Sirnes PA, Sousa-Uva M, Voudris V, Funck-Brentano C, Authors/Task Force M: 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur Heart J 2014; 35: 2383-431
4. Triposkiadis F, Karayannis G, Giamouzis G, Skoularigis J, Louridas G, Butler J: The sympathetic nervous system in heart failure physiology, pathophysiology, and clinical implications. J Am Coll Cardiol 2009; 54: 1747-62
5. Neukirchen M, Kienbaum P: Sympathetic nervous system: evaluation and importance for clinical general anesthesia. Anesthesiology 2008; 109: 1113-31
6. Frigerio M: Left Ventricular Assist Device: Indication, Timing, and Management. Heart Fail Clin 2021; 17: 619-634
7. Ozkartal T, Demarchi A, Caputo ML, Baldi E, Conte G, Auricchio A: Perioperative Management of Patients with Cardiac Implantable Electronic Devices and Utility of Magnet Application. J Clin Med 2022; 11
8. Thomas H, Plummer C, Wright IJ, Foley P, Turley AJ: Guidelines for the peri-operative management of people with cardiac implantable electronic devices: Guidelines from the British Heart Rhythm Society. Anaesthesia 2022; 77: 808-817
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#麻醉处理# #左心辅助装置(LVAD)植入术#
7