徐文鸿/韩旻:细胞器靶向药物递送抗肿瘤的研究进展
2024-07-30 医悦汇 医悦汇 发表于上海
由复旦大学附属眼耳鼻喉科医院王孝深教授担任执行主编,与浙江大学医学院附属第二医院徐文鸿医生、韩旻医生共同分享《细胞器靶向药物递送抗肿瘤的研究进展》,为医者和患者提供更多参考。
编者按:细胞器靶向药物递送作为一种新型肿瘤靶向治疗策略日益受到关注,其主要通过诱导相应细胞器的功能障碍或破坏特定结构来消除肿瘤,本文综述了三种主要细胞器包括线粒体、溶酶体和内质网的靶向策略。
本期「专家组稿」由复旦大学附属眼耳鼻喉科医院王孝深教授担任执行主编,与浙江大学医学院附属第二医院徐文鸿医生、韩旻医生共同分享《细胞器靶向药物递送抗肿瘤的研究进展》,为医者和患者提供更多参考。
研究背景
肿瘤细胞被认为是一组含有不稳定的基因组的细胞,能够无限增殖、干扰细胞凋亡、逃避免疫监督、诱导血管生成、侵袭和转移,并且容易突变。临床治疗目前主要有手术切除、放化疗、基因疗法以及免疫疗法等手段。
随着肿瘤细胞研究的不断深入,已知细胞内关键的生物分子(比如基因和蛋白质)的变异通常发生在亚细胞水平。由于它们对癌症的发生及发展起着重要作用,越来越多的研究将改善抗肿瘤药靶向准确性与耐药性的着力点聚焦在了亚细胞水平。为进一步提高药物的有效性,基于分子水平的发病机制设计药物已成为靶向抗肿瘤药物构建的新模式。经特定基团或材料的设计和修饰后,细胞器靶向药物递送系统能够在特定的细胞器靶点控制治疗药物的释放,使药物在肿瘤细胞中靶向富集,最大限度地提高药物疗效,减少毒副作用。利用药物递送系统将药物运送至不同的亚细胞位点在精准抗癌方面有很大的研发前景。
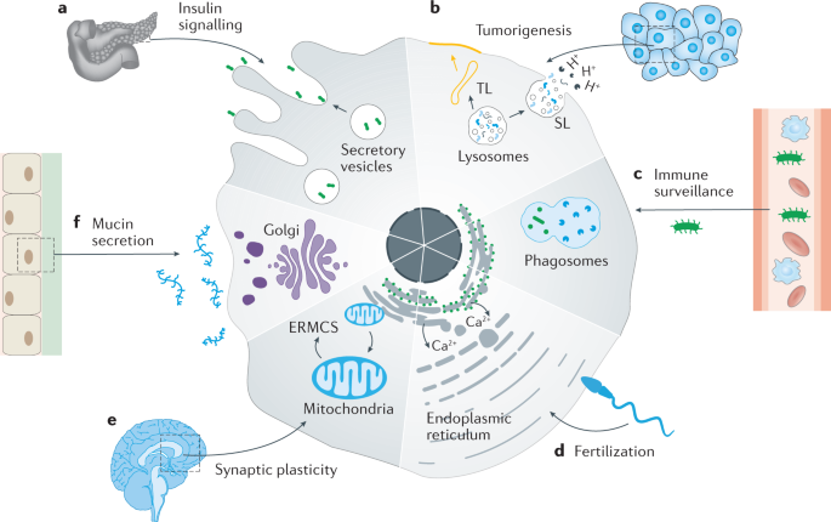
图1. 细胞器调节细胞间通讯
线粒体
线粒体是维持人体正常机能所必需的细胞器,它是保证细胞内功能发挥和能量(即ATP)产生的主要部位。在正常细胞中,ATP通过OXPHOS在线粒体中合成。但正常细胞转化为癌症细胞后,其ATP合成机制从OXPHOS转变为糖酵解。尽管一些癌症线粒体仍能表现出与正常线粒体相似的特征,但这一过程的改变导致了线粒体的负极化膜电位(MMP;Ψm)、碱性pH、高活性氧(ROS)水平、高谷胱甘肽(GSH)水平和反常的线粒体动力学等各种特性的产生。因此,其也成为了药物靶向递送的重要靶点之一。
目前报道的细胞器靶向策略主要来源于具有靶向基团功能化的生物活性分子,以控制细胞分布,其中包括了基于分子靶向药物和过渡金属配合物的直接靶向策略以及基于各种纳米制剂的间接靶向策略。
直接靶向策略由于其简便有效性,常被用于抗癌药物的递送研究中,其中所用的靶向基团常具有亲脂性并多为阳离子,这与线粒体的荷负电双层膜有关,只有亲脂性阳离子才能穿透线粒体膜并在线粒体内积聚。
而间接靶向策略主要依赖于新型纳米材料的构建,研究方向主要集中于扩展这些纳米制剂本身的内在抗肿瘤功效,或是利用它们作为载体有效地将常规治疗剂运输到细胞器中。其中后者构建的纳米载体系统可以在保持药物的最大疗效的同时共同递送多种治疗诊断药物,并且经间接靶向策略制得的制剂往往具有出色的细胞摄取性、良好的生物相容性和较长的血液循环半衰期,因而基于纳米材料的递送平台具有很大的发展前景与研究价值。目前线粒体靶向性载体构建中常用的靶头主要包括三苯基磷阳离子 (Triphenylphosphine, TPP+)、地喹氯铵(dequalinium, DQA)和小檗碱(BBR)等。
溶酶体
溶酶体是单膜细胞器,其功能是降解来自细胞外的物质。同时它也是细胞的代谢枢纽和信号平台,与细胞凋亡、坏死和自噬有关,能够控制肿瘤细胞的存活与死亡。在肿瘤细胞中,溶酶体的降解途径被解除限制,由此也更容易受到外源性或内源性刺激而触发溶酶体膜渗透。溶酶体将自身物质降解并循环利用的过程成为自噬,自噬性溶酶体已被证明对癌细胞具有双重作用,既可以通过抑制癌前细胞的转化来防止肿瘤发生,同时又可以促进肿瘤细胞发育繁殖进程。溶酶体通过操纵生长因子信号和提供营养来调节肿瘤细胞增殖。与正常细胞相比,肿瘤细胞中的溶酶体在数量、体积、pH和蛋白酶活性等方面均有所不同。溶酶体靶向研究中使用较多的靶向集团是胺类,胺类的弱碱性使其本身易在溶酶体的酸性环境中聚集,可以使其所修饰的纳米载体被细胞内吞后,在溶酶体酸度作用下,驱动到溶酶体内部。另外也有研究认为溶酶体是纳米载体的最终目的地,因此利用纳米递药系统将药物运输至溶酶体时,能够更加容易做到精准靶向。
内质网
内质网(ER)是最大、最复杂的胞内细胞器之一,是细胞内蛋白质合成、翻译后修饰、加工和折叠的重要场所,同时也负责某些类固醇和脂质的生物合成,参与各种细胞器间通信,并促进蛋白质和脂质在不同腔室之间的运输,对细胞稳态的变化具有一定的敏感性。研究表明,恶性肿瘤的发生、转移和不同抗癌化药的耐药性与内质网应激和未折叠蛋白质反应(UPR)活性密切相关。严重的内质网应激会持续损害内质网和其他亚细胞器的调节能力,通过破坏自噬乃至启动细胞凋亡来诱导肿瘤细胞死亡。因而ER作为抗癌药物研发靶点具有重要的临床意义。此外,ROS 也被发现了与内质网应激和 UPR 有密切联系,细胞质和不同的细胞器包括内质网和线粒体都会产生ROS,由于内质网中氧化还原状态的改变能够引起内质网应激,而内质网应激又能在内质网和线粒体诱导产生 ROS,则持续的氧化应激和内质网应激会启动凋亡程序。
内质网(ER)靶向小分子可以特异性结合到ER表面,在肿瘤细胞内积累并破坏ER功能。考虑到靶向基团的毒性、效率和选择性,在一系列基于小分子的靶向基团中对甲基磺酰胺及其他磺胺类衍生物在研究中得到了广泛开发使用,例如N-甲苯磺酰乙二胺和磷酸乙醇胺,它们能够与内质网上ATP敏感K通道(磺酰胺受体)结合或通过低密度脂蛋白受体介导的内吞作用实现靶向。
展望
每个细胞器在维持细胞稳态方面都发挥着特定的功能。除了线粒体、溶酶体和内质网外,其他细胞器的功能障碍都可能与癌症的发生和发展密切相关,这表明对包括高尔基体、核糖体和中心体在内的较少关注的细胞器以及已有关注较多的细胞核进行进一步的亚细胞靶向研究具有重要的意义。
目前使用细胞器靶向策略递送抗癌药的策略还存在一些不足。目前除了一些比较经典的靶向策略如线粒体靶向的TPP+和内质网靶向的磺酰脲基团外,许多相关的研究仍缺乏对机制的深入研究。另外,药物的耐药性仍需要得到进一步研究,比如进入溶酶体的药物可能会由于溶酶体管腔内弱酸性的ph环境或是药物自身的质子化而被隔离在膜外,无法到达其细胞内的靶标。此外,目前的研究更多关注如何应用细胞器靶向诱导线粒体功能紊乱、内质网应激等促使肿瘤细胞发生凋亡, 少有在抑制肿瘤形成中的应用。同时,目前也缺乏有关在细胞器靶向递送药物后,如何延长药物在靶标内蓄积时间的研究。
从小分子药物角度出发,其尺寸大小适合细胞或细胞核内化,但是有的小分子药物很难准确装饰,并且在与其他配体偶联后可能会导致药物活性的降低,有些药物如金属配合物对人体可能会产生肝肾等毒副作用。基于纳米材料的治疗平台具有体内长循环和可靶向至溶酶体等优势。纳米制剂的结构更能保持药物在细胞环境中的稳定性和活性,为细胞器靶向药物递送提供了一个方向,但生物安全问题也同样值得关注,尤其是生物降解性和长期毒性,以满足临床治疗的安全需求。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#抗肿瘤# #细胞器靶向药物#
44