Adv Sci:西安交通大学杨铁林等团队研究表明RUNX2相分离介导骨质疏松易感性变异与XCR1之间的远程调控,促进成骨细胞分化
2分钟前 iNature iNature 发表于陕西省
该研究首次将非编码SNP与相分离联系起来,为研究复杂疾病易感性的远端染色质调控机制提供了新的视角,并为骨质疏松药物的开发和相应的转化研究找到了潜在靶点。
GWASs已经确定了许多与骨质疏松症相关的基因座,但潜在的遗传调控机制和潜在的药物靶点需要探索。 2024年12月20日,西安交通大学杨铁林,郭燕共同通讯在Advanced Science 在线发表题为“RUNX2 Phase Separation Mediates Long-Range Regulation Between Osteoporosis-Susceptibility Variant and XCR1 to Promote Osteoblast Differentiation”的研究论文。该研究首次将非编码SNP与相分离联系起来,为研究复杂疾病易感性的远端染色质调控机制提供了新的视角,并为骨质疏松药物的开发和相应的转化研究找到了潜在靶点。 研究发现了一种新的调控机制,GWAS基因间SNP (rs4683184)作为增强子影响转录因子RUNX2的结合亲和力,其相分离可介导增强子与靶基因XCR1 (GPCR家族成员)之间的远程染色质相互作用,导致XCR1表达变化和成骨细胞分化。XCR1的骨靶向AAV可促进骨质疏松小鼠的骨形成,提示XCR1可能是骨质疏松的新易感基因。

骨质疏松症是老年人不可避免的退行性骨骼疾病,其特点是骨密度低,具有高遗传性。以前的全基因组关联研究(GWASs)已经成功地确定了与BMD和骨质疏松症相关的多个位点。一些GWAS基因已被用作治疗骨质疏松症的药物靶点,并已成功进入临床试验或上市,如钙敏感受体、dickkopf相关蛋白1、Sclerostin、核因子κ B受体激活因子配体等。然而,大多数被GWAS鉴定的基因座位于非编码区,这给GWAS研究结果转化为临床应用带来了很大的挑战。
G蛋白偶联受体(GPCR)是调节成骨细胞分化和骨重塑的重要和必需基因,GPCR家族相关基因可能是临床治疗骨质疏松症的关键靶点。一般来说,有基因支持的药物靶点在临床试验中成功的可能性要高出一倍。具体来说,GWASs发现了一些位于X-C基序趋化因子受体1 (XCR1)附近的非编码易感性单核苷酸多态性(SNPs),这与BMD有关。XCR1,也被称为G蛋白偶联受体5 (GPR5),是GPCR家族的重要成员。研究推测XCR1可能是骨质疏松症的一个新的潜在靶点,但GWAS SNPs与XCR1之间的功能作用在骨质疏松症的病理机制中仍有待探索。
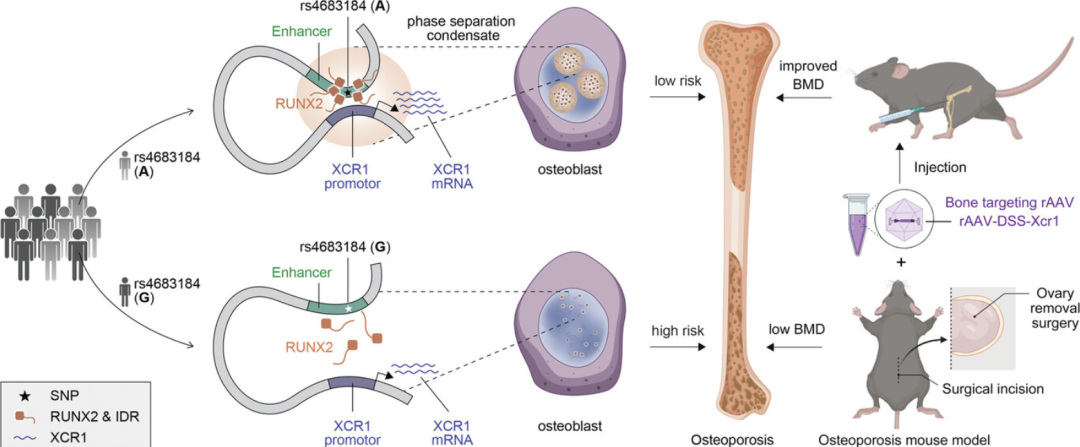
骨质疏松易感性SNP rs4683184与XCR1通过RUNX2相分离介导促成骨细胞分化的远程调控模型(图源自Advanced Science)
非编码SNPs通常位于顺式调控元件中,如增强子,在那里它们招募转录因子(TFs)通过远距离染色质相互作用激活靶基因的表达。有人提出,TFs可能负责塑造3D基因组结构,但其内部机制仍未完全了解。近年来,液-液相分离(LLPS)被认为在转录调控中起着关键作用。TFs的内在无序区(IDR)将转录装置富集为特异性增强子,并通过相分离驱动染色质环,进一步实现转录过程的区隔化,调控靶基因的表达。由于SNPs的不同等位基因会影响TFs的结合亲和力,研究推测非编码SNPs与靶基因之间的远程调控可能是通过相分离介导的。
研究阐明了GWAS基因间SNP (rs4683184)作为增强子,改变RUNX家族转录因子2 (RUNX2)的结合亲和力,导致XCR1表达差异和成骨细胞分化的功能基础。重要的是,研究发现RUNX2相分离可以介导rs4683184和XCR1之间的远程调控。XCR1能促进成骨细胞分化。携带Xcr1基因的骨靶向腺相关病毒(AAV)可促进骨质疏松小鼠骨形成,增加骨密度。总之,研究发现不仅阐明了转录因子和非编码SNP通过相分离影响疾病易感性的新的调控机制,而且为骨质疏松药物的开发提供了新的靶点。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202413561
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#骨质疏松# #XCR1#
2