FASEB J:金属蛋白酶 ADAM10 可将血管紧张素转换酶从肺内皮细胞中分离出来,形成可溶的、具有功能活性的转化酶
2024-10-16 刘少飞 MedSci原创 发表于上海
这项研究不仅揭示了ADAM10在ACE脱落和RAAS调节中的直接作用,还发现了ADAM17通过间接途径影响这一过程的机制。

肾素-血管紧张素-醛固酮系统(RAAS)是一个复杂的内分泌系统,它在维持血压稳定和调节体液平衡方面发挥着至关重要的作用。在这个系统中,血管紧张素转换酶(ACE)是一个核心的催化酶,它负责将无活性的血管紧张素I转化为具有强烈缩血管作用的血管紧张素II。因此,ACE成为了治疗高血压和其他心血管疾病的重要药物靶点。
在我们的研究中,我们发现人肺微血管内皮细胞(HPMECs)是蛋白水解过程中释放ACE的一个重要来源。这个过程,被称为胞外域脱落,是指通过膜蛋白酶的作用,将细胞表面的跨膜蛋白的胞外域切割下来,从而释放到细胞外环境中。胞外域脱落是一种普遍存在的生物学现象,它参与了许多重要的生理和病理过程。
为了深入研究ACE的脱落机制,我们采用了基因敲除和药物抑制的方法,在HEK293细胞系中鉴定出了ADAM10(A disintegrin and metalloprotease 10)作为一种主要的脱落酶,负责ACE的释放。进一步的实验在HPMECs中证实了ADAM10作为ACE的主要、组成性脱落酶的功能。这一发现为我们理解ACE的生理和病理作用提供了新的视角。
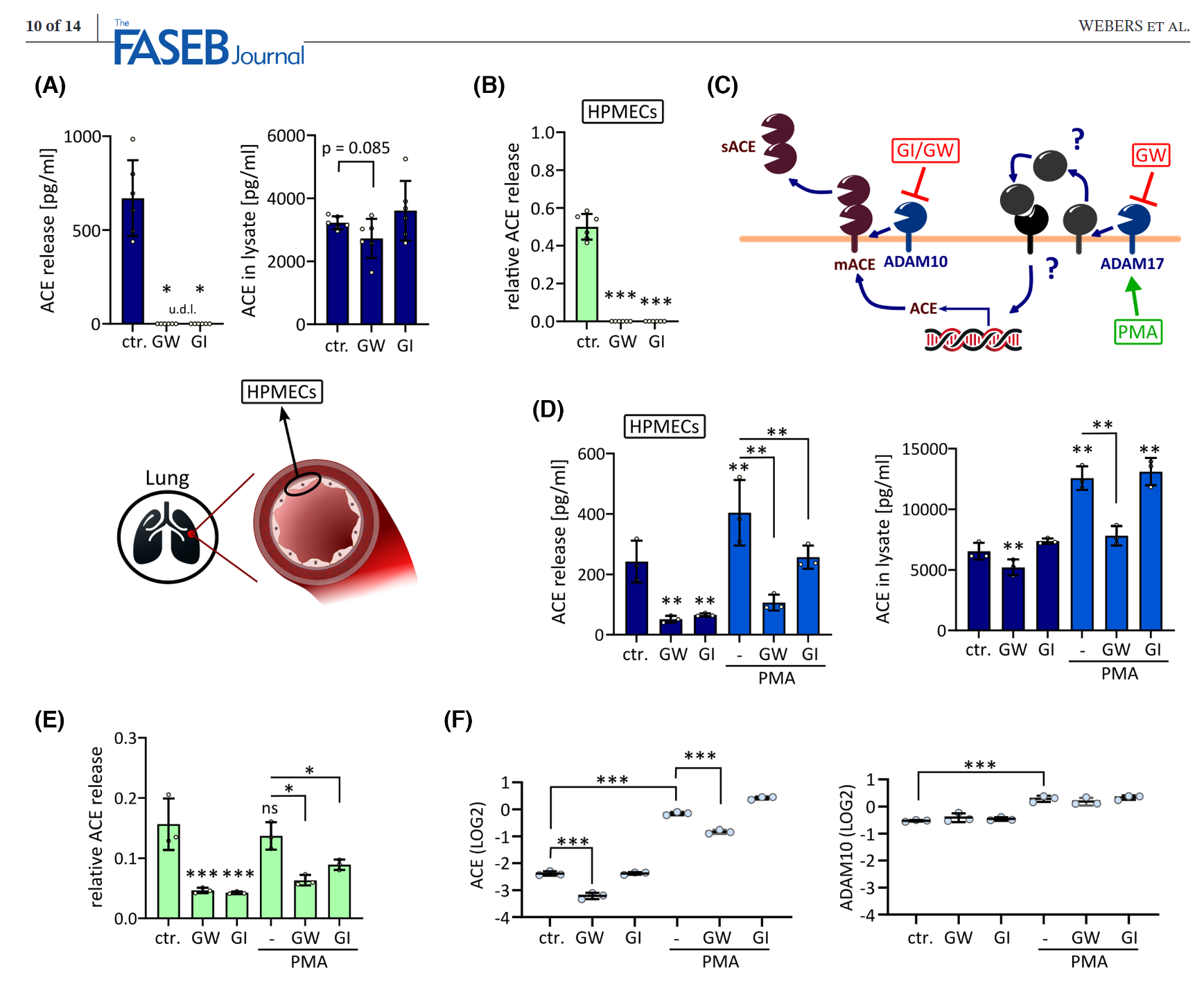
此外,我们的研究还扩展到了离体实验,使用人类和小鼠肺部的精准切割肺切片(PCLS)来验证ADAM10在ACE脱落中的生理相关性。我们的结果表明,ADAM10在肺部的ACE脱落过程中起着关键作用,这进一步支持了ADAM10在调节RAAS系统中的重要性。
值得注意的是,虽然ADAM17(另一种脱落酶)的活动并不直接参与ACE的脱落,但它通过调节ACE的mRNA和蛋白水平,间接地影响了ADAM10介导的ACE脱落。这表明在ACE脱落的过程中,存在复杂的调控网络,不同的脱落酶之间可能存在相互作用和补偿机制。
最令人兴奋的发现是,通过脱落产生的可溶性ACE具有酶活性,这意味着它能够参与到全身的RAAS功能中,从而影响血压和体液平衡。这一发现挑战了传统观念,即ACE的作用仅限于细胞表面。我们的研究揭示了可溶性ACE可能在血液循环中发挥作用,这为心血管疾病的治疗提供了新的思路。
综上所述,我们的研究不仅揭示了ADAM10在ACE脱落和RAAS调节中的直接作用,还发现了ADAM17通过间接途径影响这一过程的机制。这些发现为深入理解RAAS系统的复杂性提供了新的见解,并为开发针对ACE脱落途径的治疗策略提供了科学依据。未来的研究可以进一步探索这些脱落酶在不同病理状态下的表达和活性变化,以及它们如何影响心血管疾病的进程和治疗响应。
原始出处:
Webers M, Yu Y, Eyll J, Vanderliek-Kox J, Schun K, Michely A, Schumertl T, Garbers C, Dietrich J, Jonigk DD, Krüger I, Kühnel MP, Martin C, Ludwig A, Düsterhöft S. The metalloproteinase ADAM10 sheds angiotensin-converting enzyme (ACE) from the pulmonary endothelium as a soluble, functionally active convertase. FASEB J. 2024 Oct 15;38(19):e70105. doi: 10.1096/fj.202402069R. PMID: 39387631.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#金属蛋白酶 ADAM10# #血管紧张素转换酶 (ACE) #
65