Adv Sci:四川大学谢静/刘肖珩合作研究阐述了来自具核梭杆菌的OMV在牙周炎发生中的新作用雨交加
2024-11-05 iNature iNature 发表于上海
该研究详细阐述了来自具核梭杆菌的OMV在牙周炎发生中的新作用。
由于致病菌中的各种毒力因子在炎症的引发和扩散中发挥着作用,因此致病菌诱导的宿主免疫反应在牙周疾病的发生和发展中占主导地位。外膜囊泡(OMV)作为一种致病实体,最近引起了广泛关注,因为它是细菌和宿主组织之间的信使桥梁。
2024年10月30日,四川大学谢静、刘肖珩共同通讯在Advanced Science 在线发表题为“Outer Membrane Vesicles Derived From Fusobacterium nucleatum Trigger Periodontitis Through Host Overimmunity”的研究论文。该研究详细阐述了来自具核梭杆菌的OMV在牙周炎发生中的新作用。
在大鼠牙周炎模型中,发现来自具核梭杆菌的OMV通过增强牙周组织的炎症和牙槽骨的吸收导致牙周炎恶化,这几乎相当于具核梭杆菌本身的作用。此外,还表明OMV可以独立诱发牙周炎。OMV的致病性归因于通过组学鉴定出的多种致病成分。OMV通过内吞作用进入人牙周膜干细胞(hPDLSCs)后,激活NLRP3炎症小体,通过NF-κB(p65)信号传导抑制hPDLSCs的矿化,最终导致牙周组织损伤和牙周炎牙槽骨损伤。本研究结果为认识病原体来源的OMVs提供了新的思路,为牙周炎的预防提供了线索。

牙周炎是一种慢性炎症性疾病,感染周围组织,包括牙龈、牙周膜和牙槽骨,这些组织负责支持和稳定牙齿。其全球患病率为20%至50%,并呈持续上升趋势。牙周炎的发生和发展是由口腔共生菌群失调引起的,导致牙菌斑的形成和宿主的免疫防御,从而导致持续的长期炎症。晚期牙周炎伴随着牙龈、牙周膜和牙槽骨的进一步损失,形成深层牙周“袋”,最终导致牙齿严重松动甚至脱落。各种牙周病原体都参与了口腔共生菌群的失调,其中最重要的是牙龈卟啉单胞菌、齿垢密螺旋体、福赛斯坦纳菌、具核梭杆菌和伴放线菌聚集杆菌。这些病原体经常聚集并定植于牙周区,分泌脂多糖(LPS)、胞外多糖、牙龈蛋白酶和白细胞毒素,并促使牙周炎的发生和发展。此外,这些病原体的产物甚至病原体本身都可能与全身性疾病有关,包括神经病变、心血管疾病、2型糖尿病、类风湿性关节炎(RA)和癌症。
具核梭杆菌是一种革兰氏阴性、特殊的厌氧细菌,具有梭形杆状形状,与动脉粥样硬化(AS)、不良妊娠结局(APO)、炎症性肠病(IBD)、阿尔茨海默病(AD)和各种癌症等疾病的发生和发展直接相关。解释其在这些疾病中的作用的证据来自两个方面:定植和侵袭。具核梭杆菌可以通过日常直接接触进入血液循环并导致短暂性菌血症,包括溃疡的牙龈上皮、刷牙时的意外出血以及牙科治疗过程中不可避免的出血。具核梭杆菌还可以通过消化道定植在肠粘膜中。
此外,具核梭杆菌通过建立有效的生物膜有助于促进其他病原体的定植,包括消化链球菌属、细毛菌属和弯曲杆菌属。第二是宿主的免疫反应。F.nucleatum通过释放毒力因子如LPS、FadA和Fap2等侵入成纤维细胞、成骨细胞、成牙骨质细胞和免疫细胞,并通过上调细胞因子/趋化因子(包括IL-6、IL-8、TNF-α、CCL2和CXCl1)损伤组织,从而触发宿主的免疫防御。在口腔疾病中,F.nucleatum存在于牙周袋、牙菌斑和感染根管中,与牙髓炎、根尖周感染、种植体周围炎以及不同程度的牙周疾病(如牙龈炎、慢性牙周炎和侵袭性牙周炎)有关。F.nucleatum的检出率和丰度与牙周病病变的进展和恶化呈正相关。具核梭杆菌存在于牙周炎患者的深部牙周袋中,严重的牙槽骨丧失与具核梭杆菌的高定植有关。同时,有报道指出,抑制具核梭杆菌的生长对预防牙周炎恶化有良好的效果。然而,具核梭杆菌在牙周炎发生和发展中的作用和潜在生物机制需要进一步研究。
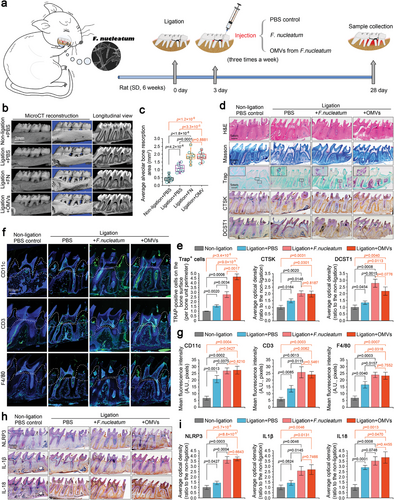
来自F.nucleatum的OMV是F.nucleatum加剧的大鼠牙周炎模型中牙槽骨丢失的重要刺激物。(图源自Advanced Science )
细菌细胞外囊泡(bEVs)这一全新领域最近引起了作者的关注,因为它与牙周炎密切相关。细菌细胞外囊泡(bEVs)是一种球形双膜纳米颗粒,内含特定亚群的生物活性蛋白、多糖、脂质和核酸。外膜囊泡(OMVs)属于一类源自革兰氏阴性细菌的bEVs。目前关于OMVs的报道非常有限,但它们可能表明OMVs在牙周疾病中的重要性,因为它们在毒力、侵袭、膜融合、生物膜形成、噬菌体感染、DNA水平转移和耐药性扩散中起着重要作用。源自高毒力肺炎克雷伯菌(hvKP)的OMV对不同类型的细胞产生不同程度的毒性作用,并可通过分泌IL-6和IL-8引起宿主细胞的炎症反应。肠出血性大肠杆菌的OMV携带的蛋白质溶血素可以靶向线粒体,诱导线粒体功能障碍并导致内皮细胞和上皮细胞凋亡。
此外,一些证据表明,由于宿主-细菌相互作用期间释放的毒力因子浓度较高,细菌OMV可能比其母菌表现出更强的毒性。例如,P.gingivalis的OMVs能诱导巨噬细胞产生大量的炎症因子(TNF-α、IL-12p70、IL-6、IL-10和IFN-β),这些因子的产生量远远高于被P.gingivalis本身感染的巨噬细胞。对于F.nucleatum,Hong等报道含毒力决定因子FadA的F.nucleatum OMVs能转位到关节内,引发局部炎症反应,加重类风湿性关节炎。Engevik等研究表明,在肠道菌群缺失的情况下,F.nucleatum通过递送OMVs能增强促炎反应,激活上游信号级联,对肠道菌群产生很大的影响。Lin等研究发现,F.nucleatum OMVs能将肠道菌群转化为炎症细胞因子,从而增强炎症细胞因子的表达。阐明了F.nucleatum来源的OMVs影响线粒体融合并促进结直肠癌细胞的细胞侵袭,提示可能是一种结直肠癌的潜在补充化疗。然而,F.nucleatum来源的OMVs是否在牙周炎的发生发展中发挥独立作用尚不清楚。
本研究旨在探讨F.nucleatum来源的OMVs在牙周炎发生发展中的作用。在此,作者从F.nucleatum中分离并鉴定了OMVs,并分析了F.nucleatum OMVs的蛋白质组学特征。在结扎诱发的大鼠牙周炎模型中,作者通过表征牙周膜炎症和牙槽骨丢失来评估F.nucleatum OMVs的致病独立性。在体外,作者阐明了其在人类牙周膜干细胞(hPDLSCs)中的致病途径,从内吞作用、转录组调控、细胞内信号传导和炎症激活到成骨分化和矿化。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202400882
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#牙周炎# #具核梭杆菌#
8