Nature:小环大威力:癌症中的脱缰野马ecDNA(染色体外DNA)
2024-12-27 生物探索 生物探索 发表于陕西省
12 月 18 日 Nature 报道研究用新实验模型模拟染色体外 DNA(ecDNA)形成和作用,揭示其致癌潜力,包括促进细胞增殖、与肿瘤进化相关等,为癌症治疗带来新方向。
引言
癌症的发生与发展一直是医学与生命科学领域的研究重点。近年来,研究人员在探索癌症的分子基础时发现了一类特殊的基因结构——染色体外DNA(extrachromosomal DNA,ecDNA)。这些基因不依附于常规的染色体,而是以环状形式存在,能够在细胞分裂过程中随机分配。与传统的染色体结构相比,ecDNA拥有更高的复制能力和基因表达效率,因此被认为是肿瘤快速生长和恶化的重要推手。然而,尽管ecDNA在多种癌症中广泛存在,其形成机制、功能以及对肿瘤发生的具体影响仍然是未解的谜题。
12月18日Nature的研究报道“Engineered extrachromosomal oncogene amplifications promote tumorigenesis”,研究人员开发了一种全新的实验模型,成功模拟了ecDNA的形成及其在肿瘤发生中的作用。这一模型通过基因工程技术在细胞和小鼠体内诱导出含有关键癌基因(如MDM2和MYC)的ecDNA,并追踪了它们的动态变化。结果显示,ecDNA不仅促进了细胞的增殖和不死化,还与癌细胞的遗传异质性和肿瘤进化密切相关。此外,该研究还首次直接证明了ecDNA在肝细胞癌等肿瘤中的致癌潜力,为进一步理解这一独特的基因放大机制提供了重要线索。
通过揭示ecDNA在癌症发生中的核心作用,该研究为肿瘤生物学带来了新的视角,也为癌症的精准治疗开辟了新的方向。未来,ecDNA相关的研究可能帮助我们开发更加精准的诊断工具和治疗策略,从而更有效地应对癌症这一全球性的健康挑战。

癌症研究的新视角:从染色体到染色体外DNA
在癌症研究的漫长历史中,研究人员一直聚焦于染色体上的基因变化,包括点突变、大片段缺失以及基因扩增等。特别是基因扩增,某些基因因异常复制而增加拷贝数的现象,被认为是肿瘤快速生长的重要驱动力。然而,随着研究的深入,传统染色体上的基因扩增理论逐渐显现出一些局限。例如,这些扩增常常表现为较低的动态性,难以解释某些肿瘤中基因表达的剧烈波动和高水平异质性。
在这样的背景下,染色体外DNA(extrachromosomal DNA,简称ecDNA)的发现为癌症研究开启了一个全新的视角。ecDNA以环状形式独立于染色体存在,其复制和分布方式高度灵活,可以显著提升基因的表达水平。更重要的是,与染色体扩增相比,ecDNA具有无着丝粒(centromere)的特点,使其在细胞分裂时随机分配。这种特性不但加剧了肿瘤内的遗传异质性,还为肿瘤快速适应治疗提供了可能。
研究显示,ecDNA携带了许多关键的癌基因,如MDM2和MYC,这些基因通过ecDNA扩增能够快速增加其拷贝数并显著提升癌细胞的生长能力。例如,在肝细胞癌模型中,研究人员发现ecDNA促进了MDM2的扩增,导致p53抑癌通路失效,从而加速了肿瘤形成。另有数据显示,ecDNA可以在较短时间内达到染色体扩增难以企及的基因表达水平,为肿瘤的恶化提供了强大动力。
可以说,ecDNA的发现为解释肿瘤进化提供了新答案,同时也让我们重新思考癌症的分子机制。
小环,大威力:什么是染色体外DNA?
在细胞的遗传密码中,DNA通常以线性染色体的形式紧密排列。然而,研究人员在研究癌症时发现了一种不按常理出牌的DNA形式,ecDNA。
ecDNA的基本结构与线性染色体截然不同。它们缺乏着丝粒(centromere),这意味着在细胞分裂过程中,ecDNA会随机分配到子代细胞。研究表明,ecDNA的开放染色质(chromatin)状态和活跃的调控元件共同促进了基因表达的提升,甚至可达到线性染色体上的10倍以上。
形成机制上,ecDNA被认为源于染色体片段的断裂和环化。这一过程可能由染色体破裂(chromothripsis)等复杂的遗传事件驱动。在某些情况下,ecDNA甚至可以重新整合到染色体上,进一步增加了癌细胞基因组的复杂性。
ecDNA的致癌性不容忽视。研究显示,在多种癌症中,携带ecDNA的癌细胞数量越多,患者的预后通常越差。该研究发现,在模拟的肝细胞癌模型中,含有ecDNA的癌细胞更具侵袭性,并且容易快速生成新的肿瘤。此外,这些癌细胞的快速扩增能力使它们能够有效规避药物的抑制作用。
“定制”的基因工程:如何在实验中模拟ecDNA?
ecDNA的神秘特性长期以来令研究人员着迷,但要在实验室中再现其形成和行为一直是一大挑战。传统方法无法精准模拟ecDNA的复杂性,这使其致癌机制难以全面揭示。然而,该研究利用创新的基因工程技术,不仅成功诱导了ecDNA的生成,还能够实时追踪其动态变化,为该领域提供了突破性的工具。
研究人员采用了基于Cre-loxP系统的工程化手段,通过在细胞和小鼠基因组中引入特定的靶点区域(loxP位点),实现了对目标DNA片段的环化和释放。当Cre重组酶在这些位点之间作用时,靶基因区域(如MDM2和MYC)会被切割并形成环状ecDNA。这种方法不仅能够精确控制ecDNA的生成,还可以通过荧光标记(如GFP和mScarlet蛋白)追踪这些小环DNA在细胞内的分布和行为。
在HCT116结直肠癌细胞系中,研究人员成功诱导了1.5 Mbp大小的MDM2基因片段形成ecDNA,并通过荧光显微镜观测到这些环状DNA在细胞中的随机分配。更重要的是,他们还通过实时定量PCR和全基因组测序(sWGS)验证了这些ecDNA的存在和扩增能力。
为了进一步研究ecDNA在体内的作用,研究团队还设计了一种Cre诱导的小鼠模型。这些小鼠携带能够生成含有癌基因的ecDNA的“潜伏”基因组,当诱导条件激活时,小鼠体内的肝细胞会生成大量的ecDNA,从而导致肿瘤快速形成。这种模型不仅再现了ecDNA驱动癌症的过程,还验证了其对肿瘤发生的关键作用。
这种“定制化”的基因工程技术为ecDNA研究打开了一扇新窗。它不仅揭示了ecDNA的生成机制,还为进一步探索其在肿瘤发生中的功能提供了强有力的工具。
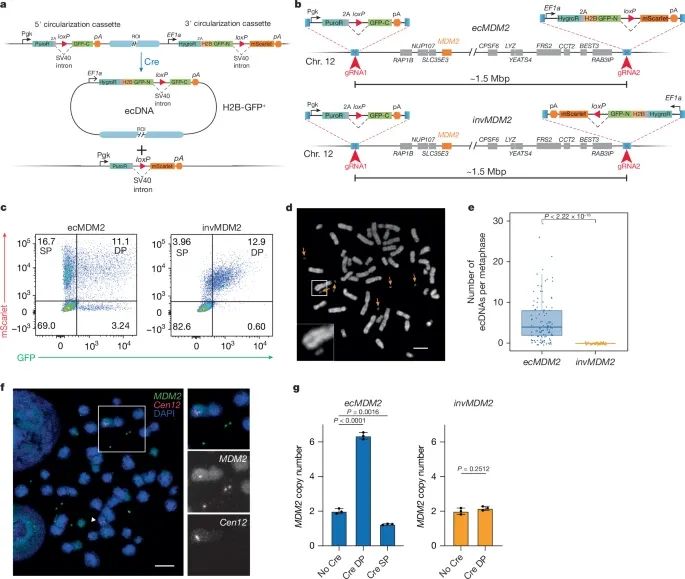
ecDNA工程策略的可行性(Credit: Nature)
ecDNA环化策略的原理设计(a)
研究人员使用Cre-loxP系统,通过在基因组中插入特殊设计的“环化盒”(circularization cassette),在特定位点切割染色体片段并使其环化,生成ecDNA。这种策略通过荧光标记(如GFP和mScarlet蛋白)实现了ecDNA的可视化和动态追踪。
ecMDM2和invMDM2模型的构建(b)
在HCT116结直肠癌细胞系中,研究人员通过基因编辑技术生成了两种对照模型。ecMDM2:在MDM2基因周围插入同向的loxP位点,允许Cre酶诱导生成环化的ecDNA。invMDM2:插入反向的loxP位点,使基因组片段在Cre酶作用下发生反向重组(而非环化)。两种模型的设计验证了环化机制的特异性。
流式细胞术验证ecDNA的生成(c)
感染表达Cre酶的腺病毒(AdCre)6天后,ecMDM2细胞中出现了显著的“双阳性”(mScarlet+GFP+)细胞群,代表成功生成了含ecDNA的细胞。此外,“单阳性”细胞群(mScarlet+GFP−)表明部分ecDNA因随机分配而丢失。
细胞分裂中观察到的ecDNA分布(d, e)
在ecMDM2模型的双阳性细胞中,通过显微镜观察到染色体旁边的小环结构,这些结构代表ecDNA。在50多个细胞中统计,双阳性ecMDM2细胞中的ecDNA数量显著高于invMDM2对照细胞(统计学显著性P < 2.22 × 10⁻¹⁶)。
DNA FISH验证MDM2基因的环化(f)
使用荧光原位杂交技术(FISH),研究人员发现ecMDM2细胞中有大量绿色的MDM2信号位于环状ecDNA上,同时12号染色体上的MDM2信号有所丢失,进一步证明ecDNA的生成。
MDM2拷贝数的变化(g)
通过定量PCR(qPCR)检测发现,双阳性ecMDM2细胞中的MDM2基因拷贝数显著增加,而invMDM2细胞的MDM2拷贝数没有明显变化。这表明ecDNA的生成直接导致了MDM2的扩增。
癌基因的“脱缰之马”:MDM2和MYC在肿瘤中的新角色
癌症的发生常常离不开癌基因的异常激活,而MDM2和MYC则是其中的“明星选手”。在该研究中,研究人员揭示了这两个基因通过ecDNA扩增后如何成为肿瘤发展的“脱缰之马”。
MDM2是p53通路的重要抑制因子,能够通过加速p53蛋白的降解来限制细胞凋亡和生长抑制。在正常细胞中,MDM2的活性受到严格调控,但当其基因通过ecDNA扩增后,这种抑制被显著增强。在实验室模型中,研究人员通过基因工程技术诱导生成含MDM2的ecDNA。结果显示,细胞中MDM2拷贝数显著增加,导致p53通路完全失活,细胞从而获得了无限增殖的能力。这一现象在小鼠模型中尤为明显:当肝细胞生成MDM2 ecDNA后,小鼠迅速出现肝细胞癌(HCC),并表现出侵袭性和快速进化的特征。
MYC则是另一个与肿瘤密切相关的癌基因,负责调控细胞周期、代谢和增殖等多项关键功能。当MYC通过ecDNA扩增后,其表达水平可以提升数倍甚至数十倍。这种“超级表达”在多个细胞模型中均被验证:研究人员观察到,含MYC ecDNA的细胞在培养过程中迅速积累大量的基因拷贝,并且表现出极高的增殖能力。此外,在实验中,这些细胞能够避开常规治疗药物的作用,进一步突显了ecDNA对肿瘤耐药性的贡献。
研究还发现,MDM2和MYC的ecDNA不仅独立发挥作用,还能够协同促进肿瘤的形成和恶化。在小鼠模型中,联合表达MDM2和MYC的ecDNA导致肝细胞癌的发生率显著提高,同时肿瘤也表现出更复杂的遗传异质性和更快的进化速度。
遗传多样性的“幕后推手”:ecDNA如何影响肿瘤进化?
癌症之所以难以治疗,主要原因之一在于其高度的遗传异质性和快速适应能力。ecDNA作为一种独特的基因扩增形式,正是癌症快速进化背后的“幕后推手”,赋予肿瘤细胞更强的生存优势。
ecDNA的特性使其成为肿瘤遗传异质性的重要来源。与染色体不同,ecDNA在细胞分裂过程中没有着丝粒的束缚,其随机分配的特性导致不同细胞中ecDNA的数量和组成各不相同。这种随机性不仅创造了肿瘤细胞间的多样性,还让某些携带关键癌基因的ecDNA在特定条件下被选择性保留或扩增,从而推动肿瘤快速适应环境变化。
该研究中,研究人员利用小鼠和细胞模型清晰地展示了ecDNA对肿瘤进化的贡献。例如,在含有MDM2或MYC基因的ecDNA模型中,研究人员发现,这些环状DNA能够在细胞内快速积累,甚至在数天内拷贝数翻倍。通过全基因组测序(sWGS),他们还观察到ecDNA的扩增会引发局部基因表达水平的剧烈变化,从而赋予细胞更强的增殖能力和耐药性。这些特性为肿瘤快速规避药物打下了基础,使传统疗法难以彻底消除癌细胞。
更为重要的是,ecDNA还通过“合作效应”加速肿瘤进化。在实验中,研究人员发现,多个ecDNA可以形成“基因表达热点”(hubs),彼此协同激活大量与增殖、侵袭相关的基因。这种“联合放大”使肿瘤细胞能够在竞争中脱颖而出,并形成更具侵袭性的癌症亚型。
总的来说,ecDNA是癌症遗传多样性和快速适应能力的重要推动力。
ecDNA研究对癌症治疗的启示
ecDNA的发现为癌症研究打开了一扇新窗,同时也带来了治疗上的重大挑战。作为癌基因扩增的一种新机制,ecDNA赋予肿瘤快速适应和进化的能力,使传统的抗癌疗法面临更大困难。然而,正是这种复杂性,也为精准医疗带来了新的希望。
首先,ecDNA的动态特性是治疗中的一大挑战。由于缺乏着丝粒,ecDNA在细胞分裂时随机分配,这种随机性不仅加剧了肿瘤的遗传异质性,还使ecDNA数量在治疗过程中可能迅速增加或减少,导致肿瘤对靶向疗法产生耐药性。此外,ecDNA在细胞中的随机分布和重组能力也可能使传统的靶向基因疗法难以精确定位目标。
尽管挑战重重,ecDNA的发现同样揭示了癌症治疗的新方向。其一,ecDNA的独特特性为开发新型疗法提供了靶点。例如,研究人员通过靶向抑制ecDNA所携带的癌基因(如MDM2和MYC),成功在实验中抑制了癌细胞的增殖。这表明,通过针对ecDNA设计的分子抑制剂或药物,可能成为未来治疗的有效手段。其二,ecDNA在癌细胞中的特异性扩增也为精准诊断和监测提供了可能。液体活检技术可检测血液中与ecDNA相关的标志物,用于早期癌症诊断和治疗效果评估。
此外,ecDNA的随机分配特性或许能够被逆向利用。通过干预其分配机制或限制其扩增能力,有可能减少肿瘤的遗传异质性,从而提高现有疗法的效果。研究还建议,结合免疫疗法来针对性清除含ecDNA的肿瘤细胞,可能是治疗耐药性肿瘤的突破口。
未来,ecDNA研究不仅将在癌症领域发挥作用,还可能为其他复杂疾病的遗传机制研究提供借鉴。随着基因编辑技术、全基因组测序和生物信息学分析的不断进步,我们有望揭开更多关于ecDNA的奥秘。
参考文献
Pradella D, Zhang M, Gao R, Yao MA, Gluchowska KM, Cendon-Florez Y, Mishra T, La Rocca G, Weigl M, Jiao Z, Nguyen HHM, Lisi M, Ozimek MM, Mastroleo C, Chen K, Grimm F, Luebeck J, Zhang S, Zolli AA, Sun EG, Dameracharla B, Zhao Z, Pritykin Y, Sigel C, Chang HY, Mischel PS, Bafna V, Antonescu CR, Ventura A. Engineered extrachromosomal oncogene amplifications promote tumorigenesis. Nature. 2024 Dec 18. doi: 10.1038/s41586-024-08318-8. Epub ahead of print. PMID: 39695225.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#癌症治疗# #ecDNA#
16