Adv Sci 香港中文大学田小雨教授团队解析内皮细胞Sirtuin 3在动脉粥样硬化中的保护机制
2024-01-31 论道心血管 论道心血管 发表于陕西省
该研究首次揭示了内皮细胞Sirt3通过其去乙酰化作用调控L-精氨酸生物合成的关键作用,为动脉粥样硬化提供了新的治疗靶点。
血管内皮细胞功能障碍是动脉粥样硬化发生过程中的起始环节,直接参与了动脉粥样硬化的启动和进展过程。内皮功能障碍会影响血管舒张和保护性因子如一氧化氮(NO)的释放,导致血管舒缩平衡紊乱,氧化还原失衡,促进炎症反应,最终引发动脉粥样硬化。Sirtuin 3 (Sirt3)是一种去乙酰化酶,在调节线粒体能量代谢和氧化应激反应中发挥着重要的调控作用。然而其在内皮代谢和血管疾病中的详细机制尚未完全阐明,仍需进一步深入研究。
2024年1月17日,香港中文大学生物医学学院田小雨教授团队在 Advanced Science上发表了题为“Role of Argininosuccinate Synthase 1 -Dependent L-Arginine Biosynthesis in the Protective Effect of Endothelial Sirtuin 3 Against Atherosclerosis”的研究论文,该研究首次揭示了内皮细胞Sirt3通过其去乙酰化作用调控L-精氨酸生物合成的关键作用,为动脉粥样硬化提供了新的治疗靶点。

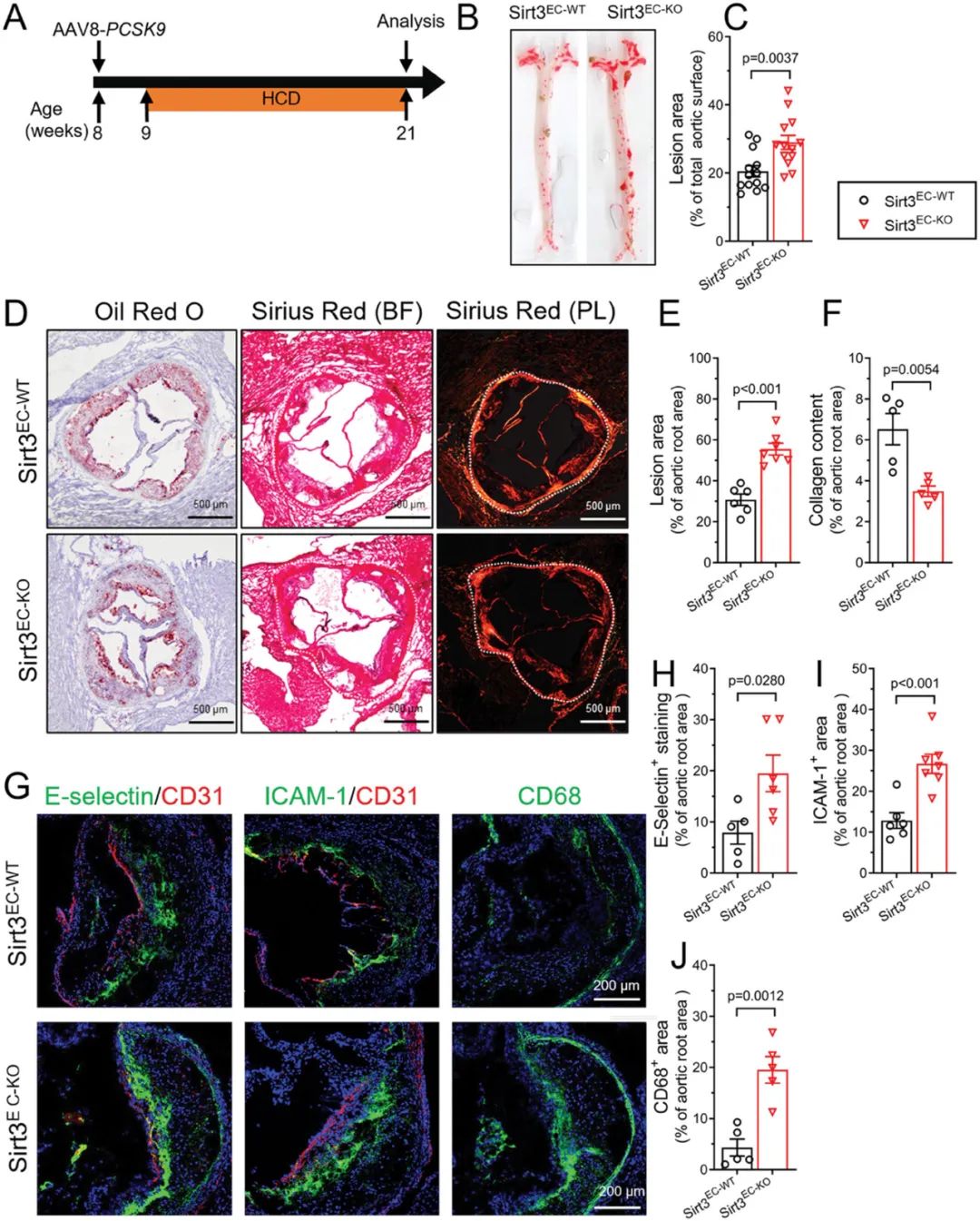
首先,研究人员构建了内皮细胞特异性敲除Sirt3基因的小鼠(Sirt3EC-KO)和野生型对照小鼠(Sirt3EC-WT),通过尾静脉注射PCSK9腺相关病毒(AAV-PCSK9)并给予为期12周高胆固醇饮食以诱导小鼠动脉粥样硬化模型。实验结果表明,Sirt3EC-KO 小鼠动脉粥样硬化斑块形成增加,同时胶原减少导致斑块不稳定性增加。此外,斑块局部的巨噬细胞浸润和炎症反应显著升高。这些研究结果表明,内皮细胞SIRT3的缺失会促进动脉粥样硬化发展。
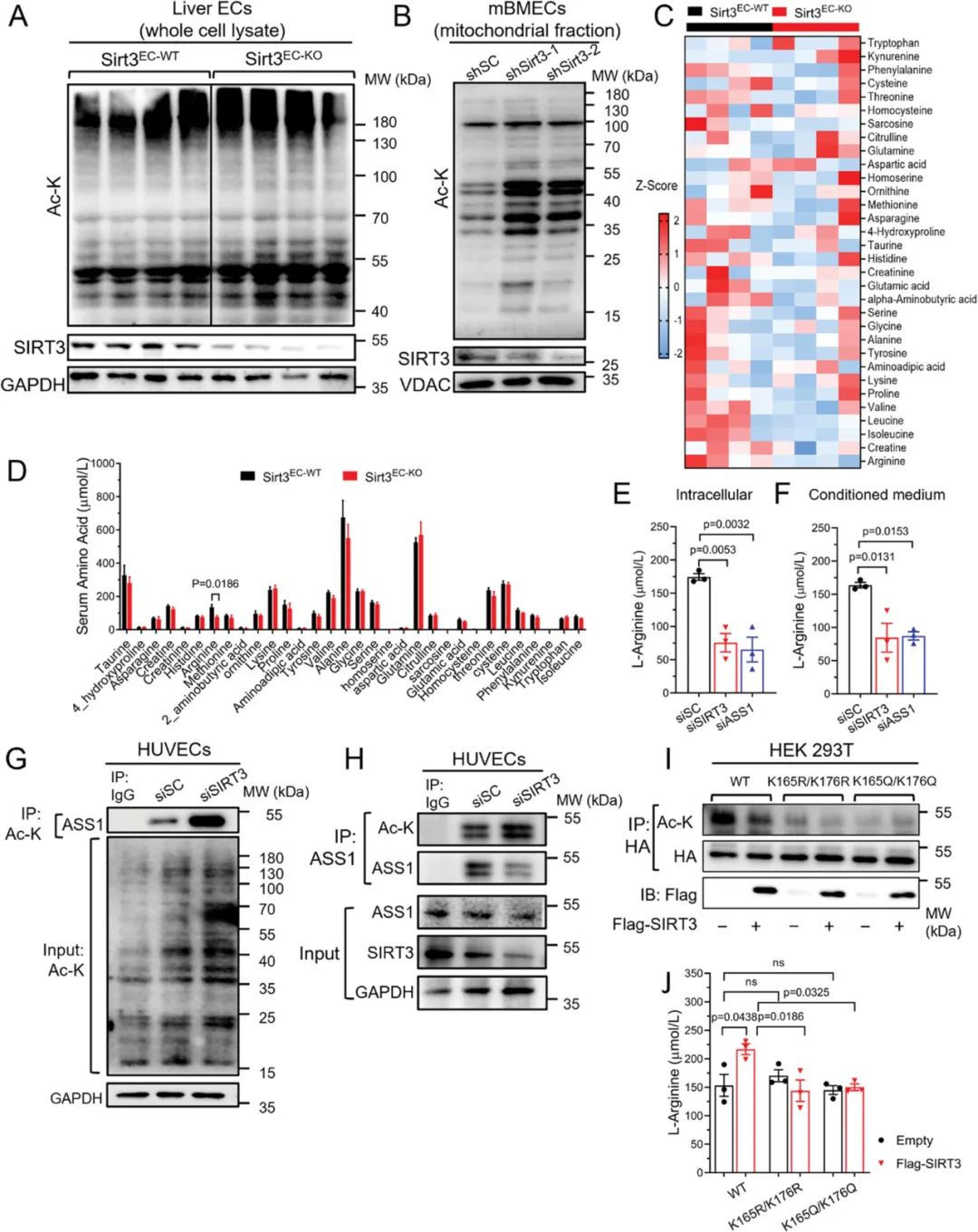
在机制层面上,内皮细胞特异性敲除SIRT3导致内皮细胞线粒体蛋白的过度乙酰化进而影响蛋白功能。代谢组学研究发现,SIRT3缺失引起小鼠血清和内皮细胞中L-精氨酸水平显著下降。该结果表明SIRT3可能参与调节精氨酸的生物合成。研究进一步揭示ASS1作为L-精氨酸合成的限速酶,是SIRT3的一个潜在靶点。Co-IP结果证明,SIRT3可以通过去乙酰化调控并激活ASS1,进而调节内皮细胞中L-精氨酸的生物合成。
L-精氨酸作为NO合成的前体,对于维持内皮细胞稳态和血管功能具有重要作用。实验结果表明 Sirt3EC-KO小鼠主动脉血管NO水平显著降低,同时内皮依赖性血管舒张反应受损,补充L-精氨酸可以显著提升NO水平,改善内皮依赖性血管舒张功能。该结果表明,SIRT3可以通过调节L-精氨酸生物合成进一步影响NO产生,从而维持内皮细胞稳态和血管功能。
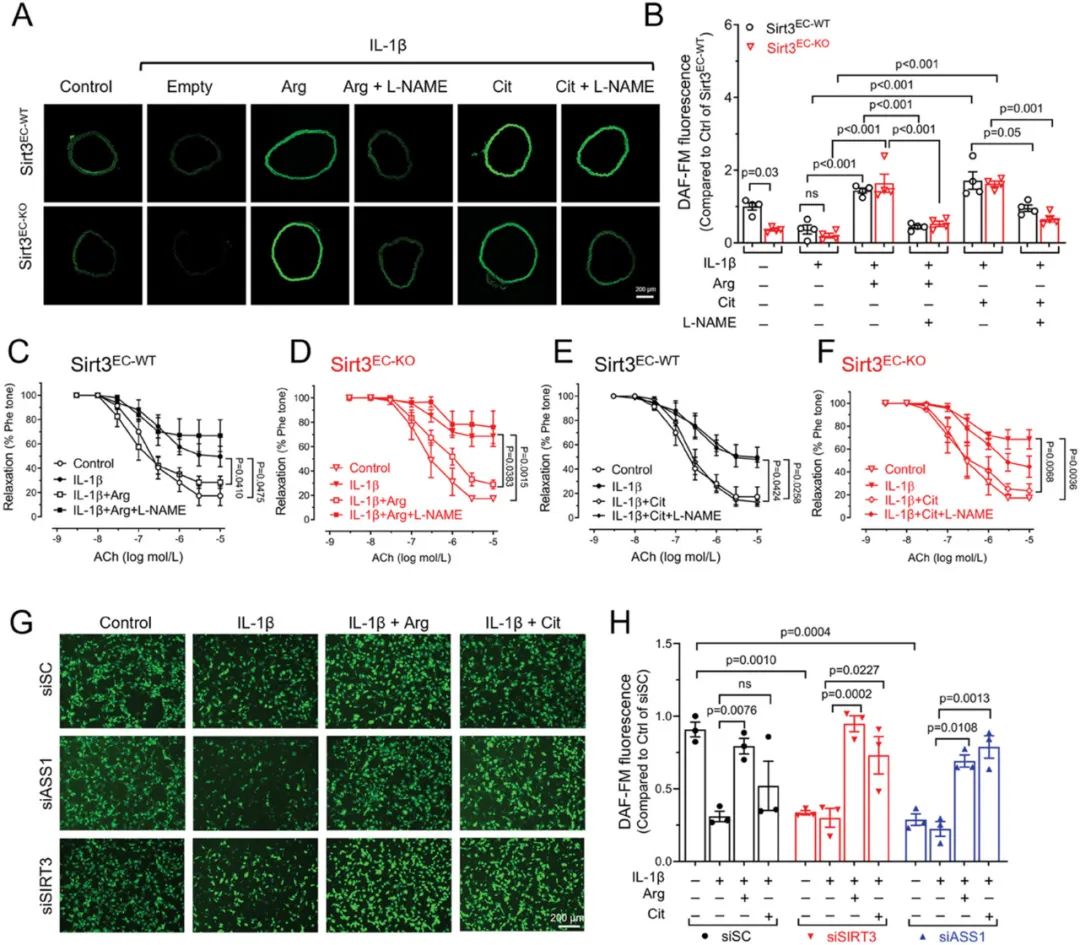
研究人员进一步探索了L-精氨酸给药能否治疗因SIRT3缺失导致的动脉粥样硬化发展。实验结果表明,饮水中给予L-精氨酸提高了Sirt3EC-WT和Sirt3EC-KO小鼠的血液循环中L-精氨酸浓度, L-精氨酸治疗显著减少了Sirt3EC-KO小鼠动脉粥样硬化斑块形成,同时促使胶原和α-SMA表达增加,有助于维持斑块稳定性。此外,斑块区域的巨噬细胞浸润和炎症反应显著减少。

综上,本研究表明内皮细胞SIRT3缺失导致ASS1的高度乙酰化并失活,从而阻碍L-精氨酸合成途径。L-精氨酸水平的降低进而导致一氧化氮(NO)的合成减少,最终加速内皮功能障碍和动脉粥样硬化进展。这项研究为深入理解SIRT3在血管健康中的作用提供了新的视角,为动脉粥样硬化等疾病的治疗开发提供了潜在的靶点。

香港中文大学生物医学学院田小雨教授为该论文通讯作者,曹晓芸博士为该论文第一作者。该研究得到了国家自然科学基金和香港研究资助局等项目的资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202307256
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#动脉粥样硬化# #SIRT3# #L-精氨酸#
33