Nature Genetics:从守护者到叛徒:如何重塑失职的TP53基因?
14小时前 生物探索 生物探索 发表于陕西省
这项研究的独特之处在于,其分析范围覆盖了94.5%的癌症相关突变,为全面解读这些突变对癌细胞生物学行为的影响提供了前所未有的高分辨率视角。
引言
癌症背后的分子机制一直是科学研究的热点。在癌症的众多驱动因素中,TP53基因被誉为“基因组的守护者”,是人类体内最重要的肿瘤抑制基因之一。然而,这位“守护者”也常常成为癌症发展的“叛徒”,数据显示,大约50%的癌症患者都携带TP53基因的突变。这些突变不仅破坏了基因的抑癌功能,还可能赋予癌细胞更强的生存和增殖能力。但遗憾的是,尽管已经记录了超过2000种TP53错义突变,绝大多数仍然是“未解之谜”。
为了深入探究这些突变的功能多样性,1月7日Nature Genetics的研究报道“Deep CRISPR mutagenesis characterizes the functional diversity of TP53 mutations”,利用CRISPR基因编辑技术,系统性地筛选了9225种TP53基因变体。这项研究的独特之处在于,其分析范围覆盖了94.5%的癌症相关突变,为全面解读这些突变对癌细胞生物学行为的影响提供了前所未有的高分辨率视角。研究发现,这些突变在细胞生长、凋亡以及对药物的反应中展现出了显著的功能差异,甚至揭示了一些潜在的药物靶点,为个性化治疗带来了新的希望。
此外,该研究不仅在功能丧失(Loss of Function, LOF)的变体中发现了令人瞩目的规律,还首次揭示了一些看似无害的突变如何通过改变RNA剪接或引发无义介导的RNA降解(NMD),间接破坏基因功能。这样的发现,不仅使我们对TP53突变的理解更加深入,也为癌症的早期诊断和靶向治疗带来了新的契机。

基因组的守护者:TP53的重要角色
TP53基因被誉为“基因组的守护者”,这个称号不仅源于它的重要性,更因为它在细胞生命活动中的独特地位。作为一个编码p53蛋白的基因,TP53通过一系列机制保护我们的基因组稳定性,为细胞筑起了抵御癌变的第一道防线。p53是一种关键的转录因子,当细胞受到DNA损伤、氧化应激或其他压力时,它会迅速启动一系列防御反应,包括细胞周期停滞、细胞衰老和程序性细胞死亡(apoptosis)。这些机制旨在修复受损DNA,或者在损伤无法逆转时“牺牲”受损细胞,防止癌症的发生。
然而,p53的功能远不止于此。研究发现,p53还参与调控细胞代谢、炎症反应和基因组复制的完整性,这使得它在肿瘤抑制之外具有更多的生理意义。例如,当细胞处于能量缺乏或营养匮乏的情况下,p53能够通过调节代谢途径,帮助细胞适应压力环境。这种全方位的守护功能使得TP53基因成为进化过程中高度保守的基因之一。
有趣的是,p53的作用并不是“独唱”,而是与多种蛋白质密切协作完成的。例如,MDM2是一种与p53关系密切的蛋白,通过对p53的降解调节其活性。在正常细胞中,p53水平被严格控制,以避免不必要的细胞死亡或生长停滞。但当细胞受到压力时,这种控制机制被迅速打破,p53被激活,从而扮演起基因组“守护者”的角色。
这种复杂而精密的调控网络使TP53成为癌症研究的核心。然而,这位守护者也极其“脆弱”。一旦TP53基因突变,其保护功能可能完全失效,甚至反过来促进肿瘤发展。由此可见,TP53不仅是基因组稳定性的守护者,也是理解癌症发生机制的关键窗口。
守护者的叛变:TP53变异与癌症的关系
尽管TP53基因在正常细胞中扮演着“基因组守护者”的角色,它也可能成为癌症发生的关键驱动因素。当TP53基因发生变异时,p53蛋白的肿瘤抑制功能可能完全丧失,甚至被“劫持”,赋予癌细胞更强的生存优势。据统计,大约50%的癌症患者都携带TP53基因突变,这使其成为癌症研究领域最具影响力的基因之一。
TP53突变的绝大多数是错义突变(missense mutations),其中90%以上集中在p53的DNA结合域(DBD)。这个区域对于p53的功能至关重要,其突变不仅会削弱p53识别和调控目标基因的能力,还可能导致细胞生长失控和肿瘤的形成。例如,研究中发现的R175H、R248Q等“热点”突变,能够显著增强癌细胞的增殖和侵袭能力。而在临床上,携带这些突变的患者往往预后较差,显示出其强大的致癌潜力。
更复杂的是,有些TP53突变不仅会导致功能丧失(Loss of Function, LOF),还会获得新的致癌特性(Gain of Function, GOF)。这些突变体可以通过重新编程细胞信号通路,促进肿瘤的侵袭和转移。例如,某些变异的p53蛋白可以与正常的p53蛋白竞争,形成失活的复合体,或与其他蛋白质结合,干扰细胞的正常功能。这些“获得功能”的突变可能让肿瘤更具侵略性,也更加难以治疗。
此外,TP53突变还常常伴随其他遗传和表观遗传改变,如染色体倍体异常和基因组不稳定性,这些二次改变进一步加速了肿瘤的发生和发展。研究中通过CRISPR技术筛选的9225种TP53变体表明,功能丧失的突变在癌症中尤为常见,部分突变还可能通过剪接异常或无义介导的RNA降解(NMD)机制进一步失去功能。
TP53突变的复杂性和多样性,不仅让它成为理解癌症机制的重要钥匙,也使其成为个性化医疗中不可忽视的靶点。
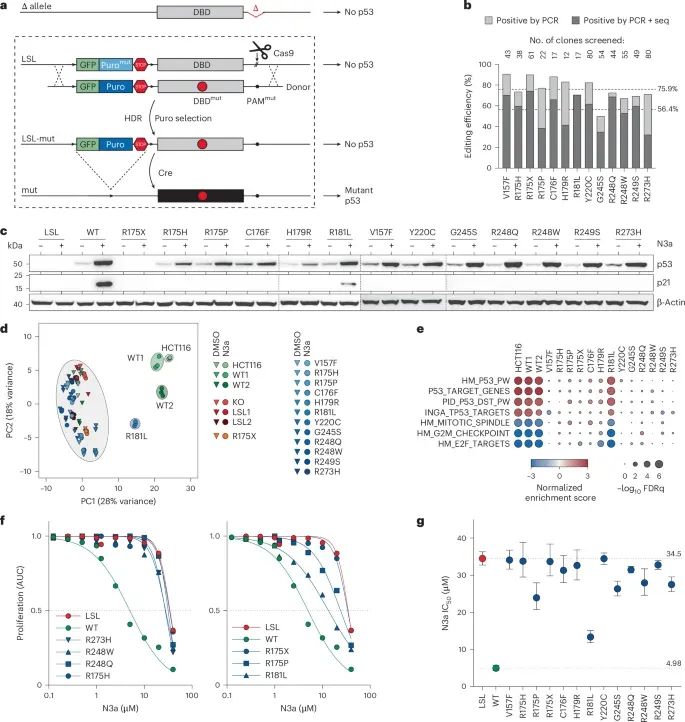
HCT116细胞系中单一TP53突变的功能解析(Credit: Nature Genetics)
a. CRISPR–Cas9介导的TP53突变示意图
研究采用同源定向修复(HDR)方法,在HCT116细胞的TP53基因座中引入突变。为了确保突变激活前不会受p53的内源性功能影响,研究人员在一个等位基因上插入LoxP-Stop-LoxP(LSL)沉默序列,并敲除另一个等位基因。通过CRE酶切除LSL序列后,激活突变基因表达,从而构建了功能清晰的细胞模型。
b. 编辑效率评估
通过PCR和测序技术,分析单细胞克隆中成功整合目标突变的比例。数据显示,在所有克隆中,CRISPR-HDR编辑的成功率为75.9%,而目标突变的精准整合率达到56.4%,表明该方法在构建突变细胞模型时具有较高的效率和准确性。
c. 突变蛋白表达验证
通过Western blot分析,检测到在激活突变基因(CRE酶切)后,不同突变细胞系均成功表达了突变p53蛋白。特别是在加入10 μM Nutlin-3a(N3a,Mdm2抑制剂)后,突变细胞的p21蛋白水平进一步上调,表明突变基因在转录调控上具有差异性。
d. RNA测序的主成分分析(PCA)
对比N3a处理前后不同细胞克隆的转录组数据,主成分分析显示,突变细胞的基因表达谱在N3a处理后发生明显变化。这进一步验证了不同TP53突变对细胞基因表达的广泛影响。
e. 基因集富集分析(GSEA)
研究通过基因集富集分析,比较了使用N3a和DMSO处理的细胞克隆之间的p53相关基因表达差异。结果表明,野生型(WT)细胞在p53通路激活后表现出显著的基因集富集,而某些突变细胞显示了显著的功能丧失或减弱。
f. 细胞增殖的实时监测
利用实时活细胞成像技术,研究了不同浓度N3a对TP53突变细胞增殖的影响。结果显示,功能丧失(LOF)突变细胞对N3a的抑制作用显著减弱,而野生型细胞则表现出显著的增殖抑制。
g. IC50分析
通过对半抑制浓度(IC50)的测定,进一步量化了N3a对不同突变细胞的增殖抑制效果。结果表明,p53功能丧失的细胞对N3a的敏感性显著降低,而野生型细胞和部分功能保留的突变细胞对N3a的响应较为显著。
深度探索:解锁TP53突变密码
TP53基因突变的复杂性让研究人员面临巨大的挑战。要全面解析数千种变体对细胞功能的影响,传统方法往往因效率和精度受限而难以实现。而CRISPR基因编辑技术的崛起,为这一难题提供了革命性的解决方案。该研究通过CRISPR/Cas9技术,结合同源定向修复(Homology-Directed Repair, HDR),成功构建了覆盖9225种TP53突变的高分辨率筛选体系,涵盖了94.5%的癌症相关错义突变。
这种方法的独特之处在于,它并非通过外源cDNA的过表达,而是直接在TP53基因的内源性位点上引入精准突变,从而保留了基因的自然调控机制,包括内源启动子、增强子、可变剪接和微小RNA结合位点等。这种接近生理条件的设计,使得实验结果更贴近癌细胞实际的生物学行为,极大提高了研究的可靠性。
研究中,HCT116细胞株被用作模型细胞,研究人员在TP53的一个等位基因中引入LoxP-Stop-LoxP(LSL)沉默序列,同时对另一等位基因进行定向敲除。这种操作确保了细胞在突变激活前对p53功能的“零干扰”。随后,通过CRISPR/Cas9的HDR修复,研究团队引入不同突变,并在CRE酶切后激活这些突变的表达,从而进行高通量筛选。
实验通过Mdm2抑制剂Nutlin-3a(N3a)激活p53通路,结合单细胞RNA测序和实时活细胞成像技术,详细评估了各突变的功能影响。结果显示,CRISPR技术不仅能够区分功能丧失(LOF)与功能部分丧失(pLOF)的变体,还精准揭示了许多变体对RNA剪接和无义介导RNA降解(NMD)的影响。这种高分辨率分析方法甚至捕捉到了轻微的功能变化,远超以往的筛选技术。
CRISPR技术的引入,使得对TP53基因突变的研究进入了“精准解码”时代。
从数据中挖掘真相:9225种变体的全面解析
该研究采用CRISPR基因编辑技术,对TP53基因的9225种变体进行了全面而系统的功能解析,几乎涵盖了所有已知的癌症相关突变。
变体分类:多样性的基因图谱
研究中,研究人员将这些变体划分为错义突变(missense mutations)、无义突变(nonsense mutations)、同义突变(synonymous mutations)、移码突变(frameshift mutations)、小片段插入/缺失突变(indels)等多种类型。具体来看,超过一半的变体属于错义突变,这是TP53突变中最常见的形式。此外,移码突变和无义突变也占据了显著比例,而这些突变大多导致功能完全丧失。
值得注意的是,这些变体主要集中于TP53基因的DNA结合域(DNA-Binding Domain, DBD),即5至8号外显子。研究发现,这些区域内的突变对基因功能的影响最为显著。特别是像R175H、R248Q和R273H这样的热点突变,不仅是癌症患者中最常见的变异形式,还表现出明显的功能丧失特征。
突变分布:从热点到边缘
尽管热点突变占所有突变的30%左右,其余70%的变体却分布在基因的其他区域。这些非热点突变中,部分变体显示出与热点突变类似的功能丧失特性,而另一些则在RNA剪接或无义介导的RNA降解(Nonsense-Mediated Decay, NMD)中表现出重要作用。例如,研究团队发现,某些表面上无害的同义突变,实际上通过破坏剪接位点的完整性间接导致功能丧失。这些“隐形破坏者”的发现,进一步揭示了TP53突变对细胞行为的深远影响。
实验验证:深入解析功能多样性
为了验证这些变体的功能,研究人员采用了多种实验方法,包括通过Mdm2抑制剂Nutlin-3a(N3a)激活p53信号通路,并利用单细胞RNA测序技术分析各变体的转录谱。这种精细的筛选方法,不仅揭示了功能丧失(Loss of Function, LOF)和部分功能丧失(Partial Loss of Function, pLOF)突变对细胞增殖、凋亡和生存的不同影响,还为发现可能的功能获得(Gain of Function, GOF)突变提供了新的视角。
这些数据揭示了TP53突变的广泛功能多样性,也指出了某些变体可能成为潜在的药物靶点。例如,研究发现,R175H等突变尽管导致功能丧失,但其蛋白结构的稳定性较高,这为未来的药物重新激活提供了可能性。此外,同义突变和某些剪接位点变体的发现,提醒研究人员在进行临床基因突变筛查时,不能仅关注传统意义上的热点突变,还需重视这些隐藏在剪接或RNA加工过程中的“隐性变体”。
多面手还是双刃剑?TP53突变功能的多样性
TP53基因的突变就像一把双刃剑,它们的功能多样性决定了癌症的复杂性。根据突变对p53蛋白功能的影响,这些突变通常分为功能丧失(Loss of Function, LOF)、部分功能丧失(Partial Loss of Function, pLOF)和功能获得(Gain of Function, GOF)三种类型。这些变体在细胞增殖、凋亡和肿瘤侵袭中的表现差异,不仅揭示了TP53突变的生物学复杂性,也为临床治疗提供了重要线索。
功能丧失(LOF):守护者的完全失职
LOF突变是TP53基因突变中最常见的类型。这些突变会完全破坏p53蛋白的肿瘤抑制功能,例如阻止其调控DNA修复和细胞周期停滞的能力。研究中,R248Q和R273H等热点突变被证明是典型的LOF突变,它们通过干扰p53与DNA的结合,使细胞失去了对基因组稳定性的保护。LOF突变的细胞在面对DNA损伤时不再激活凋亡,反而倾向于增殖失控,从而推动肿瘤的形成。
部分功能丧失(pLOF):隐匿的破坏者
相比之下,pLOF突变表现出更为复杂的特性。这些突变并未完全破坏p53的功能,而是只削弱其某些关键作用。例如,研究中发现的R175S突变,会显著降低p53的凋亡活性,但仍保留部分细胞周期调控功能。这种“选择性损失”赋予癌细胞在应对治疗时更高的适应性,让其在某些情况下对放疗或化疗表现出耐药性。
功能获得(GOF):反守为攻的叛徒
最具挑战性的是GOF突变,它们不仅丧失了p53的正常功能,还获得了促进癌症发展的新特性。例如,R175H突变被发现能够重新编程细胞信号通路,增强癌细胞的迁移、侵袭能力,甚至促进转移。这些GOF突变通过与其他转录因子合作,激活异常的基因表达网络,为肿瘤提供了更强的生长优势。
TP53突变功能的多样性,不仅是癌症复杂性的重要驱动力,也是个性化治疗的关键。了解LOF、pLOF和GOF突变的独特机制,有助于开发针对不同突变类型的精准疗法。
意想不到的破坏:RNA剪接与TP53突变
在研究TP53突变的过程中,一些表面上无害的变体被发现通过破坏RNA剪接或触发无义介导的RNA降解(Nonsense-Mediated Decay, NMD),导致TP53功能丧失。这些隐匿的破坏机制为研究TP53突变的功能多样性打开了新的视角。
RNA剪接的关键角色
RNA剪接是基因表达中的重要步骤,将初始转录的mRNA前体加工为成熟mRNA。如果这一过程被突变破坏,就可能产生异常的RNA转录本,例如缺失、插入或错配片段。该研究中,一些靠近外显子-内含子交界处的TP53突变,如G187和E224,被发现显著影响RNA剪接。这些突变引入了新的剪接位点或破坏了现有的剪接信号,导致异常的mRNA结构。
以E224位点为例,研究团队通过CRISPR引入的两种突变(E224D和E224=)均引发了RNA剪接错误,产生含有提前终止密码子的异常转录本。这些异常mRNA进一步通过NMD途径被降解,使细胞完全丧失p53蛋白的功能。
无义介导的RNA降解(NMD)
NMD是细胞用来清除异常转录本的质量控制机制。当mRNA中出现过早终止密码子时,NMD会识别并降解这些转录本,从而防止产生错误或有害的蛋白质。在该研究中,NMD被证明是导致TP53功能丧失的重要机制。例如,G199=的同义突变虽然表面上不改变蛋白序列,但通过生成异常的mRNA结构,被NMD有效清除,从而抑制了p53蛋白的表达。
这些发现强调了RNA剪接和NMD在TP53突变功能丧失中的核心作用,也为癌症诊断和治疗提供了新的方向。传统的突变检测方法通常忽视同义突变和剪接相关的变体,而这些变体可能对肿瘤发生具有深远影响。针对剪接错误或NMD通路的干预,如剪接修复寡核苷酸(SSOs)的开发,可能为恢复TP53功能提供新的希望。
重燃希望:突变的再激活与潜在药物靶点
在TP53突变导致的癌症中,重新激活突变p53蛋白的功能是一种极具吸引力的治疗策略。该研究通过对9225种TP53变体的全面解析,揭示了一些药物反应性突变及其潜在的治疗价值,为开发新型抗癌疗法带来了希望。
药物再激活:变异蛋白的“复活”
研究中,一些经典的热点突变(如R175H、Y220C)被发现具有结构稳定性,尽管这些突变导致了功能丧失,但在特定条件下仍保留部分活性。例如,R175H突变在实验中显示,其蛋白可以通过小分子化合物如APR-246部分重新激活。APR-246能够通过修复蛋白质结构或改变其结合特性,帮助p53恢复与目标DNA的相互作用,从而重新启动细胞周期调控和凋亡通路。这一发现为靶向这些“部分失职”突变提供了新的治疗思路。
剪接修复:从基因表达层面逆转突变
另一个突破在于与RNA剪接相关的突变修复。例如,L137Q突变通过破坏RNA的正常剪接导致功能丧失。然而,研究显示,使用剪接修复寡核苷酸(SSOs)能够纠正异常的RNA剪接,生成功能正常的mRNA和p53蛋白。这种基于剪接修复的策略,不仅适用于TP53,还可能应用于其他涉及RNA异常的基因突变。
未来的治疗潜力:联合疗法与精准靶点
研究还发现,一些药物反应性突变对特定小分子药物(如Nutlin-3a)表现出显著的敏感性。Nutlin-3a通过抑制Mdm2-p53相互作用,有效激活残余p53功能,显著抑制癌细胞增殖。这些结果表明,通过联合使用结构修复药物、剪接修复寡核苷酸和激活剂,可以多层次地针对TP53突变,开发个性化组合疗法。
从实验室到临床:TP53研究如何改变癌症治疗
TP53基因作为肿瘤抑制的核心枢纽,其突变不仅是癌症发生的重要驱动因素,也是遗传咨询和个性化治疗中的关键靶点。
精准遗传咨询:为风险评估提供科学依据
遗传咨询在癌症早期预防和家族遗传风险评估中扮演着重要角色。该研究通过高分辨率筛选,准确分类了不同TP53突变的功能特性,包括功能丧失(LOF)、部分功能丧失(pLOF)和功能获得(GOF)。这为鉴定致病性突变提供了精确的数据支持。例如,某些被认为是“无害”的同义突变(如G199=),实际通过破坏RNA剪接导致功能丧失,这种信息对于癌症遗传风险的精准评估具有重要意义。
通过对ClinVar数据库中超过1256种TP53变体的比对分析,该研究发现RFS(相对功能评分)可以有效区分致病性突变与良性突变,诊断准确率超过99%。这些数据为遗传咨询提供了可靠的工具,也有助于患者及其家属制定个性化的健康管理策略。
个性化治疗:为精准医疗指明方向
在临床治疗中,TP53突变的多样性对药物选择和疗效评估提出了巨大挑战。该研究揭示了一些具有药物反应性的突变,例如R175H、Y220C等,为设计精准疗法提供了直接的指导。这些突变在实验中对小分子药物(如APR-246)表现出显著的敏感性,提示通过针对特定突变类型开发靶向治疗药物,能够显著提高治疗效果。
此外,该研究中对于RNA剪接突变(如L137Q)修复的探索,为那些因剪接错误导致功能丧失的患者提供了新的治疗希望。通过结合剪接修复寡核苷酸(SSOs)和p53激活剂,研究人员有望开发出更有效的联合疗法,针对不同突变类型实现“精准打击”。
对癌症研究的新启示
TP53基因的深度研究不仅为理解癌症机制提供了宝贵的资源,更为其他癌症相关基因的研究开创了新的方法学范式。该研究为探索复杂基因突变功能、多样性及其临床意义提供了重要的参考,也启发了未来癌症基因研究的新方向。
高分辨率基因筛选的普适性
该研究采用的CRISPR-HDR技术和大规模突变功能筛选,展示了精准解析基因突变功能的强大潜力。这一技术不仅限于TP53,还可以扩展到其他癌症相关基因的研究,如BRCA1、EGFR和KRAS等,通过全面筛选突变功能,解析其对肿瘤形成的驱动作用以及潜在的治疗靶点。这种高分辨率方法能够识别传统研究中容易忽视的隐性突变,为全基因组水平的癌症研究提供了新思路。
从机制到治疗:揭示功能多样性的意义
TP53研究的一个重要启示在于,它证明了许多基因突变的功能并非简单的“有害”或“无害”。例如,功能丧失(LOF)、部分功能丧失(pLOF)和功能获得(GOF)突变的划分,不仅揭示了基因突变的多样性,还提供了新的治疗靶点。这一思路同样适用于其他肿瘤基因的研究,尤其是那些具有复杂调控网络的基因,通过挖掘突变对细胞功能的不同影响,研究人员可以开发更加精准的靶向疗法。
推动个性化医疗的发展
该研究中的RFS(相对功能评分)为评估基因突变的临床意义提供了量化工具。这一方法具有普适性,可推广至其他癌症相关基因突变的分类和预测模型。通过大规模筛选和数据分析,研究人员能够更全面地了解基因突变的临床表现,从而制定更有针对性的治疗策略。例如,在KRAS和PIK3CA等基因的研究中,类似的功能评分体系可以帮助识别药物敏感性突变,推动个性化治疗的发展。
通过对TP53研究的延展和借鉴,研究人员有望在更广泛的癌症基因研究中找到新的突破口。这项研究标志着癌症基因研究从单一突变分析向系统性、综合性探索的转变,为未来的肿瘤学研究铺平了道路。
参考文献
Funk, J.S., Klimovich, M., Drangenstein, D. et al. Deep CRISPR mutagenesis characterizes the functional diversity of TP53 mutations. Nat Genet (2025). https://doi.org/10.1038/s41588-024-02039-4
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CRISPR基因编辑技术# #TP53基因#
5