嗜酸性粒细胞性食管炎伴吞咽困难1例
3小时前 协和医学杂志 协和医学杂志 发表于上海
本文报道1例以吞咽困难起病,治疗前后均完善白光胃镜、超声胃镜、高分辨率食管测压、组织病理学检查的EoE患者,以期加深临床医生对该病的认知,提高临床诊断率。
嗜酸性粒细胞性食管炎(EoE)为一种慢性炎症,其特征是食管上皮内出现多个嗜酸性粒细胞浸润,临床主要表现为吞咽困难,部分病例可有胸骨后疼痛、反酸、烧心等不适。EoE临床较为罕见,每万人中可见1~5例EoE病例,但近年来该病在亚洲人群的患病率呈上升趋势[1]。本文报道1例以吞咽困难起病,治疗前后均完善白光胃镜、超声胃镜、高分辨率食管测压、组织病理学检查的EoE患者,以期加深临床医生对该病的认知,提高临床诊断率。
病例资料
患者女性,54岁,因吞咽困难、反酸喛气伴全身皮肤瘙痒3个月而就诊。1个月前于外院行白光胃镜检查,未见明显异常。由于吞咽困难程度加剧,为求进一步诊治于2019年9月10日就诊于南京鼓楼医院消化内科。既往有高血压病史5年,21年前因锁骨骨折曾行手术治疗。无吸烟、饮酒史,否认食物、药物过敏史。
入院查体:体温36.4 ℃,血压128/79 mm Hg(1 mm Hg=0.133 kPa),心率71次/min,呼吸频率20次/min,体质量指数18.03 kg/m2。神志清,精神一般;皮肤巩膜无黄染;浅表淋巴结无肿大;心律齐、心音可,各瓣膜区未闻及杂音;两肺呼吸音清,未闻及干、湿啰音;腹软无压痛,双下肢无水肿。
实验室检测:血常规示嗜酸性粒细胞百分比为7.1%(参考范围:0.4%~8.0%),嗜酸性粒细胞计数为0.24×109/L[参考范围:(0.02~0.52)×109/L]。免疫常规示IgM 3.34 g/L(参考范围:0.5~2.2 g/L)和IgE 182 IU/mL (参考范围:0~100 IU/mL)。便常规、胃肠道肿瘤标志物、巨细胞病毒DNA、EB病毒DNA、结核T细胞检测、尿常规均未见明显异常。
辅助检查:白光胃镜示食管痉挛、黏膜充血和水肿,血管透见性下降(图1A);
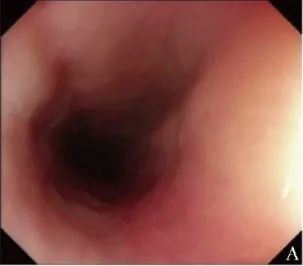
图1A 患者治疗前白光胃镜检查(2019年9月12日),示食管痉挛、黏膜充血和水肿
超声胃镜示食管中下部弥漫性增厚(图1B);
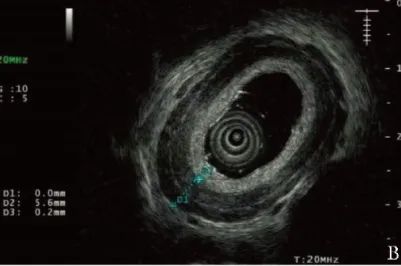
图1B 患者治疗前超声胃镜(2019年9月12日)示食管中下部弥漫性增厚,肌层厚度约为5.6 mm
胸部CT示右肺上叶磨玻璃结节、食管壁增厚;病理活检示食管鳞状上皮内散在嗜酸性粒细胞浸润伴嗜酸性粒细胞微脓肿形成,嗜酸性粒细胞计数密度约为30个/HPF(图1C);
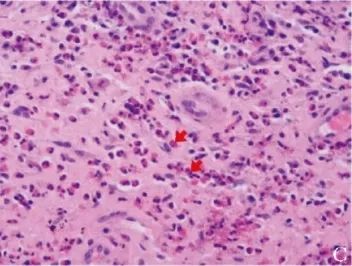
图1C 患者治疗前病理(2019年9月18日)示食管鳞状上皮内散在嗜酸性粒细胞浸润(红色箭头)伴嗜酸性粒细胞微脓肿形成,密集处嗜酸性粒细胞计数约为30个/HPF(HE,×400)
高分辨率食管测压(2019年9月27日)示食管下括约肌静息压94.1 mm Hg(参考范围:13~43 mm Hg)、残余压56.3 mm Hg(参考范围:<15 mm Hg),食管上括约肌静息压78.4 mmHg(参考范围:34~104 mm Hg)、残余压12.9 mm Hg(参考范围:<12 mm Hg),食管体部蠕动10次,表明患者食管-胃交界出口处存有梗阻。
诊断与治疗:根据患者临床表现、辅助检查、病理结果,符合EoE的诊断标准(中度活动性)。治疗方案为口服醋酸泼尼松30 mg/d,同时加用质子泵抑制剂保护胃黏膜,予以钙片和维生素 D预防骨质疏松。醋酸泼尼松治疗6 d后,患者自诉吞咽困难、反酸嗳气、皮肤瘙痒均有明显改善。
随访与复查:出院1周后,根据医嘱将醋酸泼尼松减量为25 mg/d,出院3周后减为20 mg/d,后续每2周减量2.5 mg/d,直至停药。治疗3个月后复诊,白光胃镜可见正常的食管黏膜和食管蠕动(图2A);
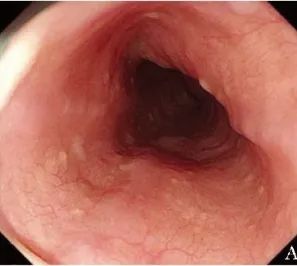
图2A 患者治疗后白光胃镜(2019年12月24日)检查可见正常的食管黏膜和食管蠕动
超声胃镜示食管壁厚度减小(图2B);
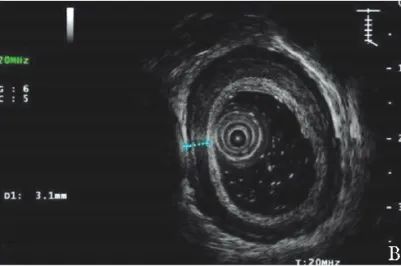
图2B 患者治疗后超声胃镜(2019年12月24日)示弥漫性食管增厚较前减轻,肌层厚度约为3.1 mm
病理检查示食管组织中仅可见极个别嗜酸性粒细胞 (图2C);
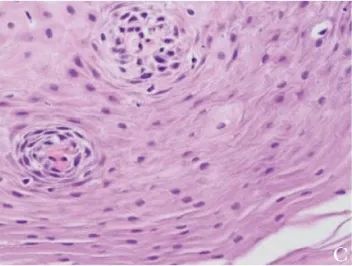
图2C 患者治疗后病理 (2019年12月26日)示食管组织内仅见极个别嗜酸性粒细胞(HE,×400)
高分辨率食管测压示食管下括约肌静息压12.5 mm Hg、残余压1.6 mm Hg,食管上括约肌静息压60.6 mm Hg、残余压10.7 mm Hg,表明食管动力基本正常。2022年9月和2023年9月电话随访时,患者未报告有吞咽困难等不适症状,拒绝胃镜等相关检查。目前该患者仍在长期随访中。
讨论
EoE是指在无胃食管反流病(GERD)或贲门失弛缓症等与食管嗜酸性粒细胞增多相关其他疾病的情况下,出现呕吐、吞咽困难或进食障碍等食管功能障碍症状,且食管黏膜活检显示嗜酸性粒细胞≥15个/HPF的慢性食管炎症疾病[1]。
自1978年首例EoE被报道以来,其在儿童和成人中的发病率均呈升高趋势[2-4]。对于EoE患者,长时间未被治疗的炎症与较高的食管纤维化、吞咽困难及食物的食管嵌顿发生率相关[5]。
荷兰一项纳入721例EoE患者的队列研究显示,在确诊时症状持续时间超过21年的患者中,食管狭窄和食物嵌顿的比例分别为52%和57%;而在症状持续时间不足2年的患者中,该数据分别为19%和24%。大型队列研究显示,出现EoE症状后未干预时间每延长1年,食管狭窄风险增加9%(OR=1.09,95% CI:1.05~1.13)[6]。除可引起躯体症状外,EoE导致的社会心理负担,如过度警觉与症状特异性焦虑亦不容忽视,且此类精神表现可在确诊EoE前即存在数年[7-8]。
一项来自美国芝加哥的研究纳入了103例EoE患者,结果显示41%的病例存在吞咽困难,46%的病例出现过度警觉与症状特异性焦虑。上述研究提示,临床医师应重视EoE的早期诊断与干预,对于治疗效果欠佳、健康相关生活质量较差的EoE患者,临床还应评估其心理健康变化[7]。
EoE的诊断需结合内镜检查及病理活检结果,其中内镜表现包括轮状沟、波纹、白斑、纵行沟、黏膜水肿、狭窄等改变,病理活检可见食管上皮内嗜酸性粒细胞计数增多,每个高倍视野可见15个及以上的嗜酸性粒细胞[9-10]。目前,虽然EoE的诊断标准已达成共识,但临床实践中尚缺乏简便实用的疾病严重程度评估工具。
为此,由多名变态反应学、胃肠病学和病理学专家组成的国际专家小组开发了适用于成人和儿童的EoE严重指数(I-SEE)[11],该指标包括症状与并发症、炎症特征、纤维狭窄程度3部分。I-SEE评分<1分为静止性EoE,1~6分为轻度活动性EoE,7~14分为中度活动性EoE,≥15分为严重活动性EoE。
食管嗜酸性粒细胞增多不仅见于EoE,还可见于GERD、寄生虫与真菌感染、克罗恩病、结缔组织病、药物过敏等多种疾病[12]。EoE最常见的鉴别疾病是GERD。GERD内镜特点表现为食管下段黏膜糜烂。高度支持EoE的组织学特征为食管鳞状上皮内大量嗜酸性粒细胞,每高倍镜视野下存在超过20个嗜酸性粒细胞浸润[13],其他组织学表现包括近端食管受累、上皮下和固有层纤维化、嗜酸性粒细胞脓肿等[14-15]。研究发现,EoE和GERD可共同存在,EoE可由于食管顺应性降低或动力障碍引起继发性GERD,而GERD则可通过影响上皮屏障完整性,导致抗原暴露,促进EoE的发生[12]。
本例患者为中老年女性,主要表现为吞咽困难,外周血嗜酸性粒细胞虽处于正常范围但偏高,白光胃镜下可见食管痉挛、黏膜充血和水肿,未见肿瘤相关证据,因此应考虑EoE的可能。随后通过超声胃镜测定了患者食管壁的厚度,发现食管壁弥漫性增厚,进一步病理活检可见每高倍视野中食管黏膜约30个嗜酸性粒细胞浸润并伴嗜酸性粒细胞微脓肿形成。结合内镜检查、病理结果,该患者明确诊断为EoE。根据I-SEE评分,该患者总分为13分,为中度活动性EoE。
目前临床尚无法治愈EoE,治疗目标以缓解症状为主,并尽量清除食管黏膜中的嗜酸性粒细胞,以避免疾病发展和不良预后,治疗手段包括饮食控制、药物治疗及应对食管狭窄的扩张术3个方面。其中饮食控制包括氨基酸配方饮食、经验性食物排除的饮食,药物治疗包括糖皮质激素、质子泵抑制剂、生物制剂[16]。糖皮质激素是治疗EoE的一线药物,无论是全身还是局部给药,糖皮质激素均能明显改善EoE的临床症状和组织学特征[17-18]。
国外指南强调了局部糖皮质激素布地奈德在EoE治疗中的重要性,该药物对于诱导组织学缓解具有显著疗效,且不良反应较少、安全性高[19-20]。由于目前国内尚无布地奈德制剂的购买渠道,故本例患者采用口服醋酸泼尼松的治疗策略。醋酸泼尼松是一种全身给药的糖皮质激素,可减轻食管炎症反应,有助于修复黏膜屏障,防止组织损伤加重和纤维化,并促进组织重塑。治疗6 d后,患者的临床症状较前明显好转,提示口服醋酸泼尼松治疗EoE效果良好。
达必妥单抗(dupilumab)是一种针对IL-4受体的单抗,2022年5月经美国食品药品监督管理局批准用于治疗EoE,为首个被批准用于治疗EoE的药物[21-22]。一项美国进行的多中心、随机、双盲、安慰剂对照试验将47例成年EoE受试者随机分配至达必妥单抗组和安慰剂组,结果显示相较于安慰剂组,达必妥单抗组治疗后食管上皮平均每高倍视野嗜酸粒细胞峰值更少,EoE组织学严重程度评分更低,但其注射部位红斑、鼻咽炎发生率更高[23]。
Tezepelumab是一种人源性抗胸腺基质淋巴细胞生成素的单克隆 IgG2 抗体,目前正在全球进行一项为期52周的临床试验,旨在评估其治疗成人和青少年EoE的有效性和安全性,中国约15家医院参加了该临床试验,期待结果的公布。除此之外,针对EoE的生物制剂还包括靶向IL-13通路的RPC4046与QAX576、选择性CRTH2抑制剂、靶向IL-5通路的美泊利珠单抗和瑞替珠单抗等[24]。本例患者就诊于2019年,考虑到当时上述生物制剂的疗效和适应证尚未在大范围人群中得到验证且价格高昂,患者最终选择了糖皮质激素疗法。
目前,EoE仍被视为一种慢性病,需重视该病的早期诊断、长期治疗及定期随访[11]。Von Arnim等[25]提出,应在开始针对性诱导治疗后2~3个月进行随访,如病情稳定,建议每12~24个月定期临床随访,以评估疾病活动性、患者治疗依从性,同时监测药物副作用,从而及时调整治疗方案。经证实,临床和组织学缓解的EoE患者如果出现症状复发,应尽快接受内镜检查和组织学评估[26]。本例患者治疗3个月后,复查超声内镜示食管厚度明显降低,食管测压示动力状态较治疗前改善,病理活检示食管黏膜中嗜酸性粒细胞的数量明显减少,提示治疗效果良好,其长期预后尚需进一步随访。
综上所述,EoE是一种以食管上皮内嗜酸性粒细胞性浸润为主要特征的慢性炎症疾病,成人和儿童均可患病,临床通常以吞咽困难为主要表现,并可伴其他不适。对于临床存在吞咽困难的病例,如无其他疾病的证据,应高度怀疑EoE的可能性,可综合外周血嗜酸性粒细胞检测、高分辨率食管测压、超声内镜及病理活检协助诊断。由于该病发病率较低,临床可能存在对其认识不足的局限性。本文总结1例EoE患者的诊疗经过,以供临床同行借鉴。
参考文献
[1]Muir A, Falk G W. Eosinophilic esophagitis: a review[J]. JAMA, 2021, 326(13): 1310-1318.
[2]Landres R T, Kuster G G, Strum W B. Eosinophilic esophagitis in a patient with vigorous achalasia[J]. Gastroenterology, 1978, 74(6): 1298-1301.
[3]Navarro P, Arias Á, Arias-González L, et al. Systematic review with meta-analysis: the growing incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies[J]. Aliment Pharmacol Ther, 2019, 49(9): 1116-1125.
[4]Dellon E S, Hirano I. Epidemiology and natural history of eosinophilic esophagitis[J]. Gastroenterology, 2018, 154(2): 319-332.e3.
[5]Schoepfer A M, Safroneeva E, Bussmann C, et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner[J]. Gastroenterology, 2013, 145(6): 1230-1236.e2.
[6]Warners M J, Oude Nijhuis R A B, De Wijkerslooth L R H, et al. The natural course of eosinophilic esophagitis and long-term consequences of undiagnosed disease in a large cohort[J]. Am J Gastroenterol, 2018, 113(6): 836-844.
[7]Taft T H, Carlson D A, Simons M, et al. Esophageal hypervigilance and symptom-specific anxiety in patients with eosinophilic esophagitis[J]. Gastroenterology, 2021, 161(4): 1133-1144.
[8]Naik R D, Patel D A. Unlocking the mind might be critical in management of eosinophilic esophagitis: expanding beyond drugs, dilation, and Diet[J]. Gastroenterology, 2021, 161(4): 1099-1101.
[9]Hirano I, Moy N, Heckman M G, et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system[J]. Gut, 2013, 62(4): 489-495.
[10]Gonsalves N P, Aceves S S. Diagnosis and treatment of eosinophilic esophagitis[J]. J Allergy Clin Immunol, 2020, 145(1): 1-7.
[11]Dellon E S, Khoury P, Muir A B, et al. A clinical severity index for eosinophilic esophagitis: development, consensus, and future directions[J]. Gastroenterology, 2022, 163(1): 59-76.
[12]Dellon E S, Liacouras C A, Molina-Infante J, et al. Updated international consensus diagnostic criteria for eosinophilic esophagitis: proceedings of the AGREE conference[J]. Gastroenterology, 2018, 155(4): 1022-1033.e10.
[13]Steiner S J, Gupta S K, Croffie J M, et al. Correlation between number of eosinophils and reflux index on same day esophageal biopsy and 24 hour esophageal pH monitoring[J]. Am J Gastroenterol, 2004, 99(5): 801-805.
[14]Parfitt J R, Gregor J C, Suskin N G, et al. Eosinophilic esophagitis in adults: distinguishing features from gastroesophageal reflux disease: a study of 41 patients[J]. Mod Pathol, 2006, 19(1): 90-96.
[15]Lee S, De Boer W B, Naran A, et al. More than just counting eosinophils: proximal oesophageal involvement and subepithelial sclerosis are major diagnostic criteria for eosinophilic oesophagitis[J]. J Clin Pathol, 2010, 63(7): 644-647.
[16]Biedermann L, Straumann A. Mechanisms and clinical management of eosinophilic oesophagitis: an overview[J]. Nat Rev Gastroenterol Hepatol, 2023, 20(2): 101-119.
[17]Schaefer E T, Fitzgerald J F, Molleston J P, et al. Comparison of oral prednisone and topical fluticasone in the treatment of eosinophilic esophagitis: a randomized trial in children[J]. Clin Gastroenterol Hepatol, 2008, 6(2): 165-173.
[18]Tan N D, Xiao Y L, Chen M H. Steroids therapy for eosinophilic esophagitis: systematic review and meta-analysis[J]. J Dig Dis, 2015, 16(8): 431-442.
[19]Lucendo A J, Molina-Infante J, Arias Á, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults[J]. United European Gastroenterol J, 2017, 5(3): 335-358.
[20]Dellon E S, Woosley J T, Arrington A, et al. Efficacy of budesonide vs fluticasone for initial treatment of eosinophilic esophagitis in a randomized controlled trial[J]. Gastroenterology, 2019, 157(1): 65-73.e5.
[21]Dellon E S, Rothenberg M E, Collins M H, et al. Dupilumab in adults and adolescents with eosinophilic esophagitis[J]. N Engl J Med, 2022, 387(25): 2317-2330.
[22]Straumann A. Biologics in eosinophilic esophagitis-ready for prime time?[J]. N Engl J Med, 2022, 387(25): 2379-2380.
[23]Hirano I, Dellon E S, Hamilton J D, et al. Efficacy of dupilumab in a phase 2 randomized trial of adults with active eosinophilic esophagitis[J]. Gastroenterology, 2020, 158(1): 111-122.e10.
[24]Ridolo E, Barone A, Ottoni M, et al. The new therapeutic frontiers in the treatment of eosinophilic esophagitis: biological drugs[J]. Int J Mol Sci, 2024, 25(3): 1702.
[25]Von Arnim U, Biedermann L, Aceves S S, et al. Monitoring patients with eosinophilic esophagitis in routine clinical practice-international expert recommendations[J]. Clin Gastroenterol Hepatol, 2023, 21(10): 2526-2533.
[26]De Bortoli N, Visaggi P, Penagini R, et al. The 1st EoETALY consensus on the diagnosis and management of eosinophilic esophagitis-definition, clinical presentation and diagnosis[J]. Dig Liver Dis, 2024, 56(6): 951-963.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














前往app查看评论内容
0 0
#嗜酸性粒细胞性食管炎# #吞咽困难#
2