J Clin Invest:王红艳/沈键锋教授团队合作揭示microRNA调控心脏内皮细胞发育新机制
2024-12-02 论道心血管 论道心血管 发表于加利福尼亚
揭示了心脏内皮细胞专一性高表达的miR-187在诱导先天性心脏病发生中的关键调控作用。
先天性心脏病(CHD)是中国连续十年排名第一的出生缺陷,对患儿家庭和社会都带来沉重负担。尽管在早期诊断和手术治疗已有极大进展,但CHD的发病机制仍未完全清楚,约55%的病例缺乏明确的遗传解释。深入研究CHD的分子机制,有助于理解疾病起源,推动早期干预和精准治疗,最终改善患者的预后。
心脏内皮细胞约占心脏细胞总数的三分之一。在胚胎发育中,心脏内皮细胞通过内皮间充质干细胞转分化(EMT)调控心脏间隔和瓣膜的形成,维持心脏结构的完整性。心脏内皮细胞分化和功能受损,可能导致心脏间隔缺损等心脏结构性异常,心内皮发育失常可能引发严重的先天性心脏缺陷,但其发病机制尚未明确。
2024年11月25日,复旦大学附属妇产科医院王红艳教授课题组联合上海交通大学医学院附属第九人民医院沈键锋教授,在国际学术期刊Journal of Clinical Investigation上以Research Article形式发表了题为“Elevated microRNA-187 causes cardiac endothelial dysplasia to promote congenital heart disease through inhibition of NIPBL”的研究成果,揭示了心脏内皮细胞专一性高表达的miR-187在诱导先天性心脏病发生中的关键调控作用。

该研究通过比对结构异常心脏和正常心脏的RNA测序数据,继而在因法洛氏四联症(TOF, CHD的一种严重类型)流产的胎儿心脏组织中,发现miR-187显著高表达,且其高表达只专一性发生于心脏内皮细胞,而非发生于心肌细胞。在内皮细胞中条件性高表达miR-187的胎鼠模型呈现与人类CHD相似的心脏缺陷。
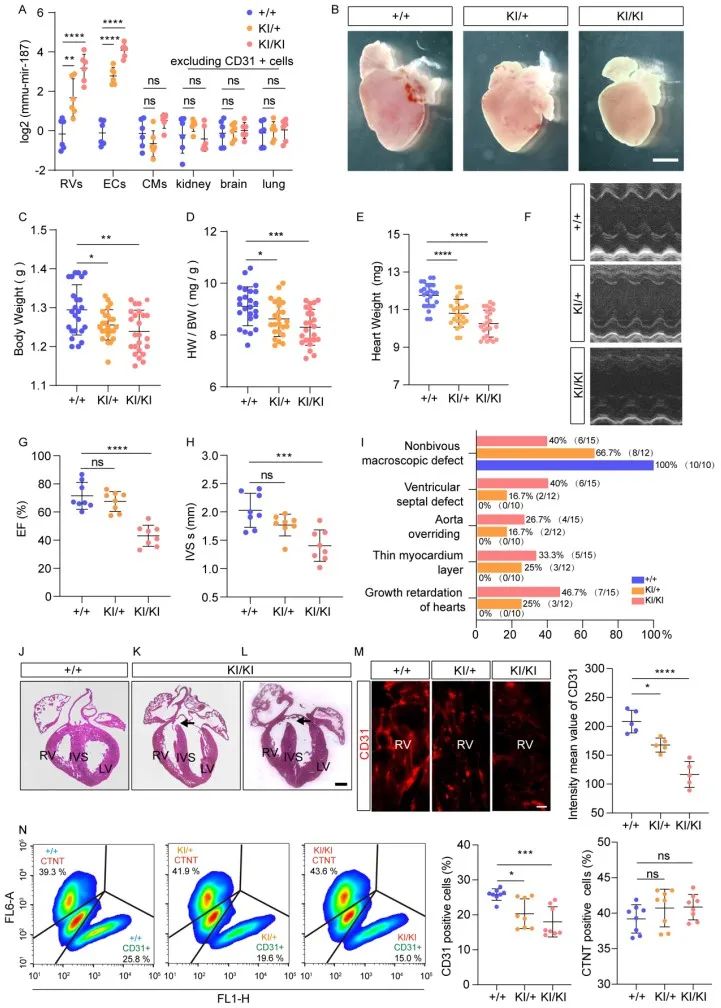
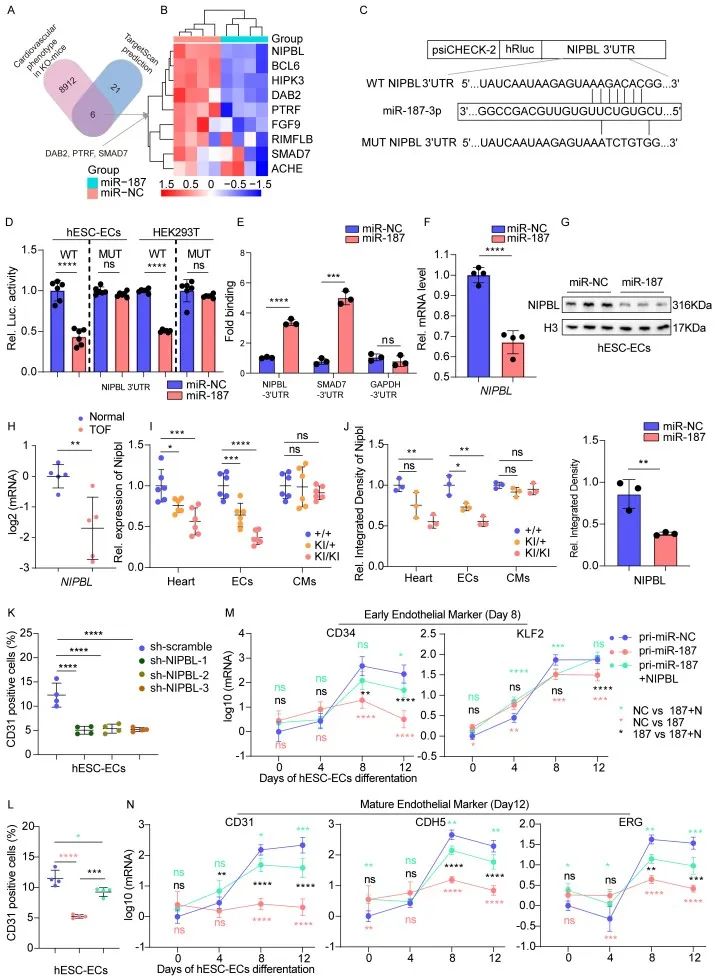
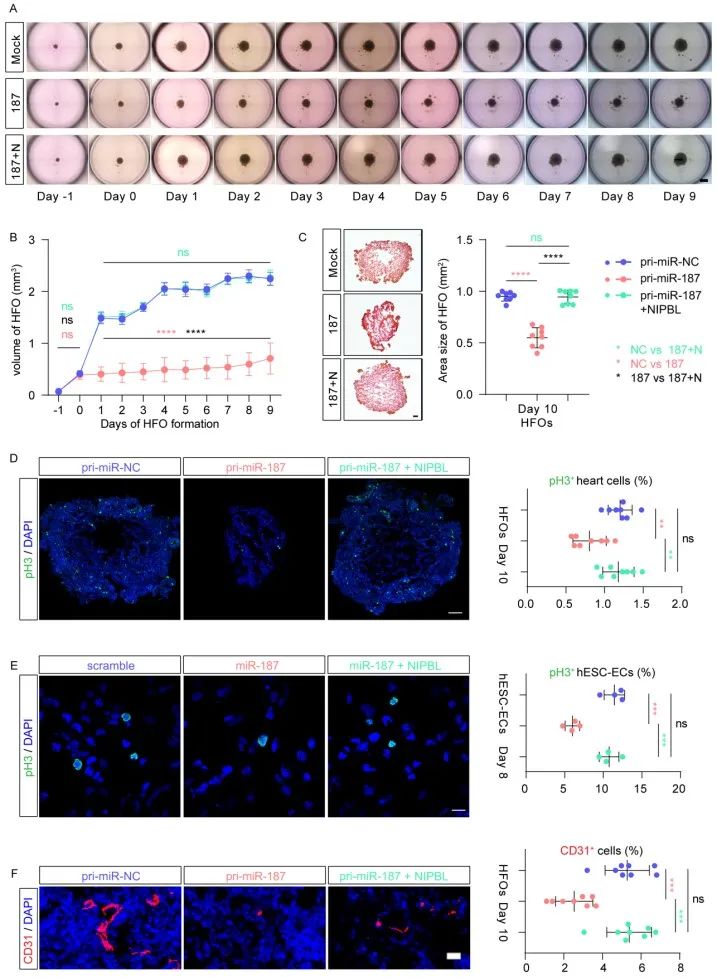
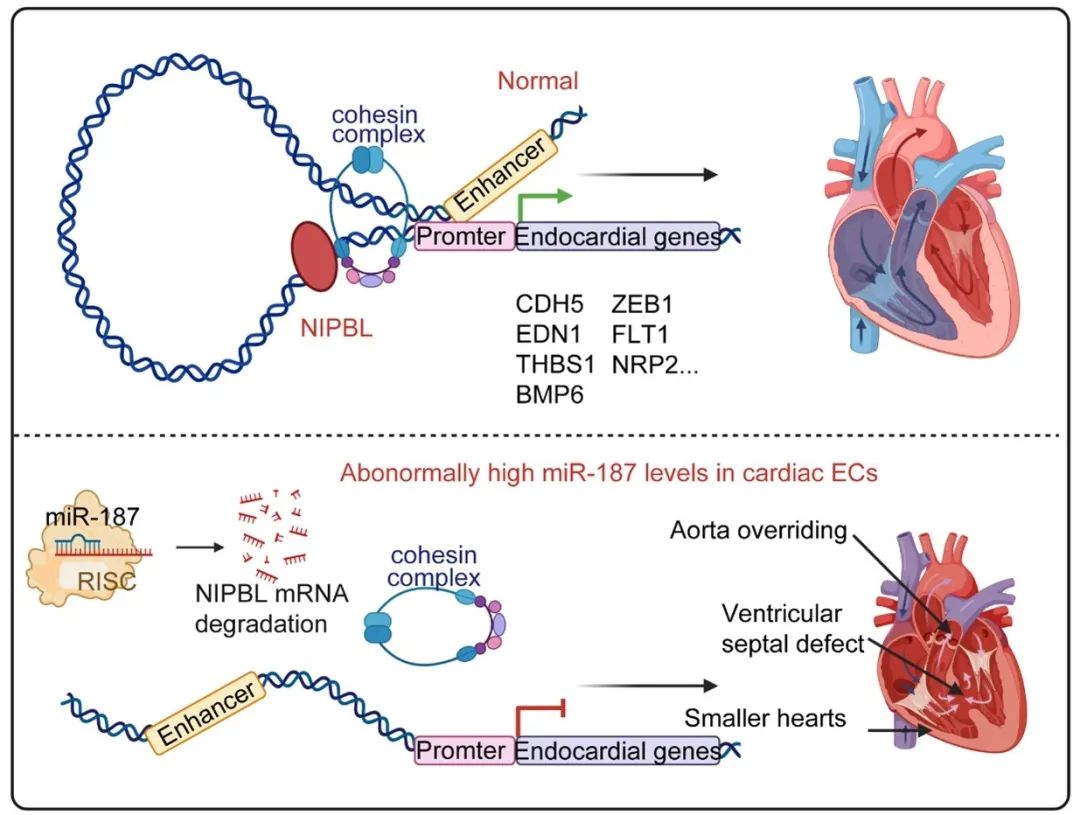
机制上,miR-187靶向抑制NIPBL基因, NIPBL负责招募凝聚素复合体,调控染色质的可及性。在内皮细胞中特异性高表达miR-187可显著抑制NIPBL的功能,进而全面影响心脏内皮细胞基因的正常表达,导致心内皮细胞发育受损,最终引发严重的心脏发育障碍,表现为心脏间隔瓣膜缺损、心脏体积缩小等病理特征。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#心脏内皮细胞#
3