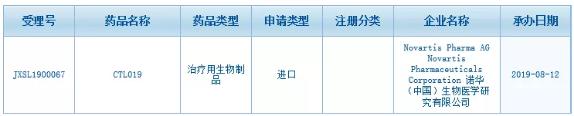
全球首款获批的CAR-T疗法临床试验申请在华获得受理
昨日(8月12日),中国国家药监局药品审评中心(CDE)正式受理了由诺华提交的CAR-T疗法CTL019(Kymriah)的临床试验申请(受理号:JXSL1900067)。
医谷 - CAR-T疗法 - 2019-08-15
美国FDA受理君实生物重新提交的特瑞普利单抗治疗鼻咽癌上市申请
FDA已将特瑞普利单抗BLA的目标审评日期定为2022年12月23日。 如若获批,特瑞普利单抗将成为美国首个且唯一用于鼻咽癌治疗的肿瘤免疫药物。
网络 - 鼻咽癌,美国FDA,特瑞普利单抗 - 2022-07-07
基石药业RET抑制剂普拉替尼中国上市申请获受理并纳入优先审评
近日,中国国家药品监督管理局(NMPA)正式受理普拉替尼(Pralsetinib)胶囊的上市申请并纳入优先审评,用于治疗经含铂化疗的RET融合阳性的非小细胞肺癌(NSCLC)患者。
医药魔方 - 审评,基石药业,受理 - 2020-09-06
海和药物紫杉醇口服溶液(RMX3001)中国上市许可申请获正式受理
目前全球大部分地区大多使用注射剂型紫杉醇,需经配制后在医院经静脉滴注给药,患者需频繁返院,且会有注射部位不良反应,因此口服紫杉醇制剂的开发一直是行业研究的热点。
海和药物 - 胃癌,紫杉醇口服溶液 - 2022-09-14
FDA受理默沙东抗毒素产品bezlotoxumab上市申请,预防艰难梭菌(C.difficile)感染的复发
美国制药巨头默沙东(Merck & Co)近日宣布,FDA已受理单抗产品bezlotoxumab的生物制品许可申请(BLA),这是一种实验性抗毒素(antitoxin),用于预防艰难梭菌(C.difficile
生物谷 - 默沙东,艰难梭菌感染,C.difficile,bezlotoxumab,单抗 - 2016-02-01
联康集团首款全生物表达新药三期临床试验申请获国家药监局受理
具备研发、生产及销售的一体化生物制药商 -- 联康生物科技集团有限公司(“联康集团”或“本集团”,股份代号:690)欣然宣布,本公司提交的重组促胰岛素分泌素注射液(“第二代Uni-E4”)三期临床试验申请于2018年11月20日获得国家食品药品监督管理总局审评中心(“药监局”)受理,并收到《受理通知书》,受理号为CXSB1800011及CXSB1800012。
美通社 - 联康集团,临床试验 - 2018-11-26
欧盟受理辉瑞口服JAK抑制剂Xeljanz治疗类风湿性关节炎的上市申请
美国制药巨头辉瑞(Pfizer)近日宣布,欧洲药品管理局(EMA)已受理口服JAK抑制剂Xeljanz(tofacitinib,5mg片剂,每日2次)的上市申请(MAA),此次申请寻求批准Xeljanz与最初所提交的MAA申请相比,此次申请提供了额外的信息,包括来自在RA群体中开展的III期ORAL全球开发项
生物谷 - 辉瑞,口服JAK抑制剂,Xeljanz,Tofacitinib,类风湿性关节炎 - 2016-03-26
和黄医药治疗非胰腺神经内分泌瘤新药“索凡替尼”中国上市申请获受理
和黄中国医药科技有限公司(以下简称“和黄医药”)宣布,索凡替尼(surufatinib)用于治疗晚期非胰腺神经内分泌瘤的新药上市申请(NDA)获中国国家药品监督管理局(NMPA)已受理,成为继爱优特®(用于结直肠癌治疗的呋喹替尼胶囊)去年在中国成功推出市场后,和黄医药第二款自主研发并在中国提交新药上市申请的创新肿瘤药物。
医谷 - 和黄医药,非胰腺神经内分泌瘤,索凡替尼 - 2019-11-12
FDA受理安斯泰来新一代前列腺癌口服药物Xtandi补充新药申请
安斯泰来(Astellas)与合作伙伴Medivation近日宣布,FDA已受理新一代前列腺癌口服药物Xtandi(enzalutamide)治疗转移性去势抵抗性前列腺癌(mCRPC)的补充新药申请(sNDA),该申请纳入了来自2个头对头II研究TERRAIN和STRIVE的数据,研究结果证实Xtandi治疗mCRPC疗效显著优于比卡鲁胺(bicalutamide)。
生物谷 - 安斯泰来,前列腺癌,Xtandi,Enzalutamide - 2016-03-02
医学部2018年关于肿瘤学、影像医学、放射医学项目的注意事项与不予受理情况
按照《2018年度国家自然科学基金项目指南》的规定,申报肿瘤学相关领域项目,以及影像医学、放射医学等相关领域研究项目的申请者请注意,2018年未按照下述要求进行申报的相关项目申请将不予受理(来源:NSFC
解说国自然 - 医学部,2018年,肿瘤学,影像医学,放射医学,注意事项,不予受理情况 - 2018-01-23
百济神州PD-1第6项适应症上市申请获受理,治疗非小细胞肺癌
今日,百济神州宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理其抗PD-1抗体百泽安?(替雷利珠单抗)用于治疗接受铂类化疗后出现疾病进展的二或三线局部晚期或转移性非小细胞肺癌(NS
医药魔方 - 非小细胞肺癌,适应症,百济神州 - 2021-03-07
国家自然科学基金委员会关于推迟2020年度项目申请与结题时间等相关事宜的通知
全面落实党中央国务院关于打赢疫情防控阻击战工作部署要求,按照“疫情防控是当前最重要的工作”的原则,进一步凝聚科技工作者力量,做好疫情防控工作,国家自然科学基金委员会(以下简称自然科学基金委)特对2020年度国家自然科学基金项目申请与结题等工作做出相应调整一、推迟申请和结题材料等
NSFC - 基金 - 2020-02-02
原料药、药用辅料和药包材注册申请不再单独受理,CDE建立登记平台
厅字〔2017〕42号)与《国务院关于取消一批行政许可事项的决定》(国发〔2017〕46号),取消药用辅料与直接接触药品的包装材料和容器(以下简称药包材)审批,原料药、药用辅料和药包材在审批药品制剂注册申请时一并审评审批
中国食事药闻 - 关联审评,CFDA,注册申请 - 2017-12-03
为您找到相关结果约500个