南开大学张新歌/郭东升ACS Nano:治疗蛀牙!
2024-09-27 BioMed科技 BioMed科技 发表于上海
这项研究强调了大环化合物的特殊识别和组装能力,为创造有效的联合抗菌膜疗法提供了一种有前景的策略。
在抗生素危机日益升级的背景下,光疗因其固有的优势,包括高选择性、无创性和低耐药性,已成为一种有前景的治疗方法。光热疗法(PTT)和光动力疗法(PDT)是两种互补且有前景的光疗方法,其中PTT在实现精确热限制和避免脱靶损伤相关风险具有挑战,而PDT则面临着生物膜中普遍存在缺氧微环境的问题。
在此,南开大学张新歌副教授和郭东升教授等人设计了一种超分子纳米制剂,具有胍修饰的杯[5]芳烃接枝氟碳链(GC5AF5)的络合诱导淬灭、三磷酸腺苷(ATP)的有效识别和氟碳链的携氧能力等特性。这种智能纳米制剂能够自适应增强光热疗法(PTT)和光动力疗法(PDT),并可在两种模式之间按需切换。该纳米配方利用死细菌释放的ATP来加速生物膜的消除,使细菌无法抵抗,同时最大限度地减少对健康组织的伤害。这项研究强调了大环化合物的特殊识别和组装能力,为创造有效的联合抗菌膜疗法提供了一种有前景的策略。相关工作以“A Supramolecular Nanoformulation with Adaptive Photothermal/Photodynamic Transformation for Preventing Dental Caries”为题发表在ACS Nano。

【文章要点】
如图1所示,本文设计了一种由胍修饰的杯[5]芳烃接枝氟碳链(GC5AF5)和酞菁四磺酸锌(ZnPcS4)组成的自适应超分子纳米制剂,该制剂在三磷酸腺苷(ATP)的触发下可进行PTT到PDT的性能转变。具体而言,受益于杯芳烃富电子腔内的光诱导电子转移效应引起的络合诱导淬灭作用,作者将ZnPcS4预加载到GC5AF5的腔中(形成超分子纳米制剂ZnPcS4@GC5AF5,GFZ),由此可导致光动力效应的湮灭(OFF状态),以及光热效应的增强(high状态)。
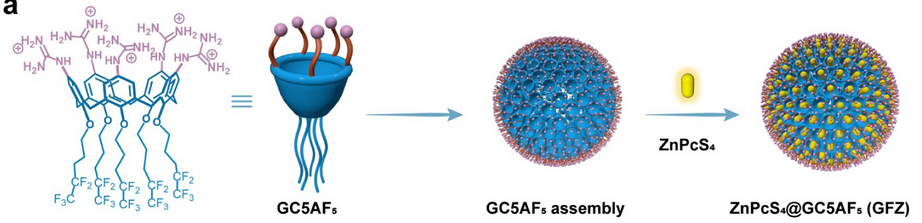
图1 GFZ的设计制备
通过可见光照射激活GFZ的光热特性导致细菌细胞膜破裂和细胞内ATP的释放。随后,GFZ对ATP的竞争性结合可引发ZnPcS4的释放,从而可恢复光动力活性(ON状态)并降低光热活性(low状态)。由于GC5AF5中氟碳链的携氧能力,在可见光照射下激活释放的ZnPcS4产生了大量的细胞毒性单线态氧,从而加速了口腔细菌生物膜的清除、恢复口腔菌群并可预防龋齿(图2)。总体而言,GC5AF5的识别、组装和携氧特性的巧妙整合使其能够与PTT和PDT兼容,并随着治疗的进展实现了从PTT到PDT的按需切换,并增强每一种治疗模式,最终更准确地消除细菌生物膜,同时避免对健康组织的不必要损伤。超分子大环有助于轻松实现功能整合,为顽固的细菌生物膜感染提供了有前景的解决方案。
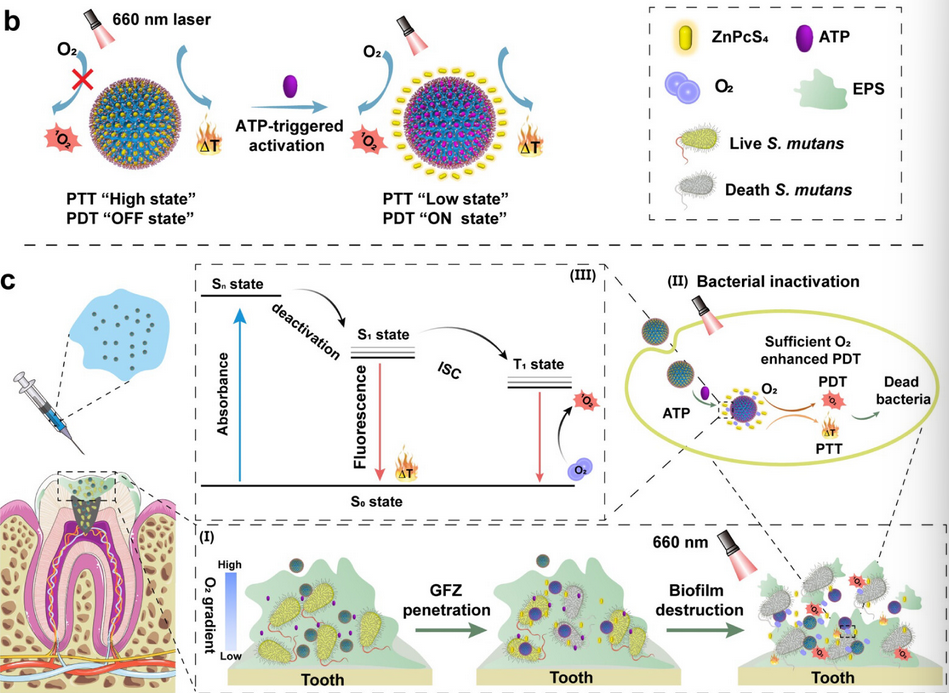
图2 GFZ清除细菌生物膜的机制
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c06051
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#龋齿# #光热疗法# #超分子纳米制剂# #抗菌膜疗法#
61