Cardiovasc Res 武汉大学唐其柱教授团队发现TRAF7介导心肌重构的分子机制
2024-10-09 论道心血管 论道心血管 发表于上海
本文首次提出TRAF7通过影响ASK1的泛素化水平,调节ASK1及下游信号通路的激活,加剧了心肌重构的发展,该研究为心肌重构治疗提供了新思路。
心肌重构是多种心血管疾病进程中共同的病理生理过程,尽早干预病理性心肌重构的发生发展对心力衰竭的早期预防及治疗至关重要,但目前具体机制尚不清楚,仍缺少有效的临床干预手段。
TRAF7是一种E3泛素连接酶,是肿瘤坏死因子超家族的一员,该家族其他成员已有通过调控炎症、增殖、分化影响心肌重构的相关报道,而TRAF7在心血管疾病中的研究大多为空白。
2024年10月7日,武汉大学人民医院唐其柱团队在Cardiovascular Research杂志上发表了题为“Cardiac tumour necrosis factor receptor-associated factor 7 mediates the ubiquitination of apoptosis signal-regulating kinase 1 and aggravates cardiac hypertrophy”的研究论文,揭示TRAF7在心肌重构中的作用及分子机制,本文首次提出TRAF7通过影响ASK1的泛素化水平,调节ASK1及下游信号通路的激活,加剧了心肌重构的发展,该研究为心肌重构治疗提供了新思路。

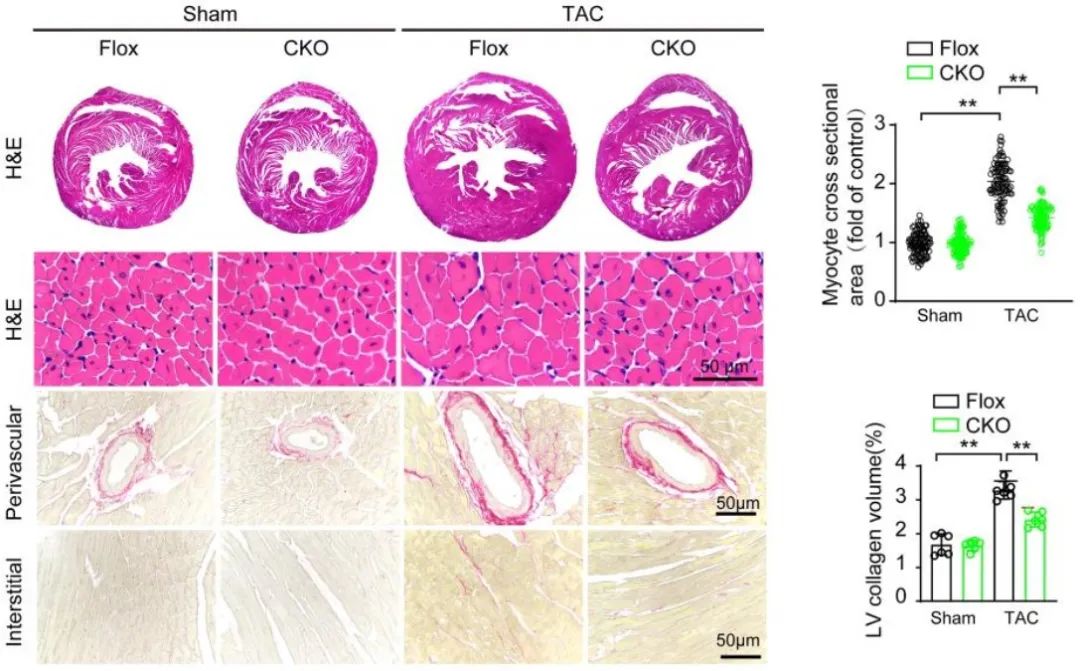
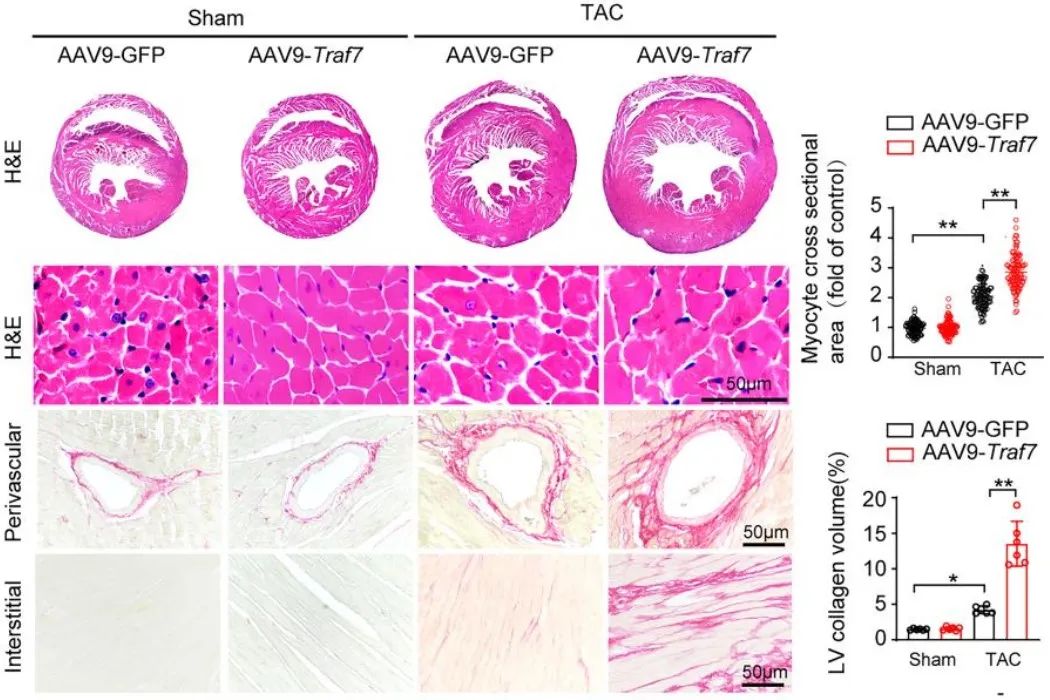
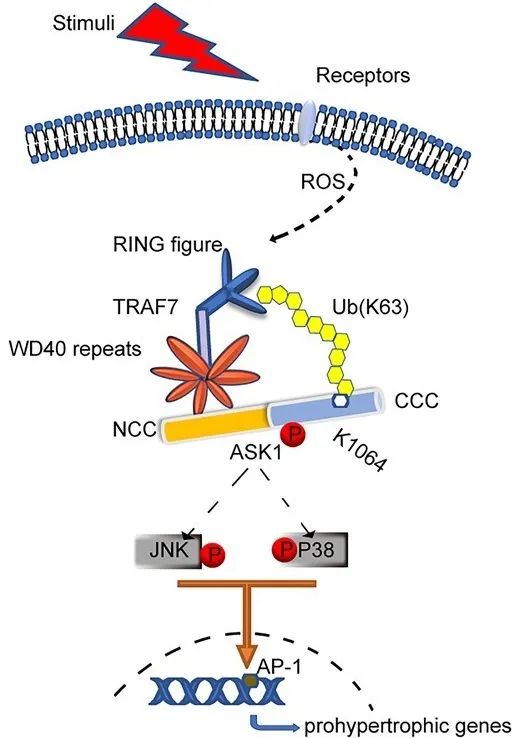
首先,研究人员在心肌重构的体内体外模型中检测到TRAF7蛋白的表达增加,这种刺激由ROS介导,且TRAF7表达的增加主要来源于心肌细胞。接着,研究者通过构建TRAF7心肌特异性敲除小鼠及尾静脉注射TRAF7腺相关病毒的心肌特异性过表达小鼠,明确心肌特异性敲除TRAF7减轻压力负荷诱导下小鼠的心肌重构水平,而过表达则加剧了心肌重构。
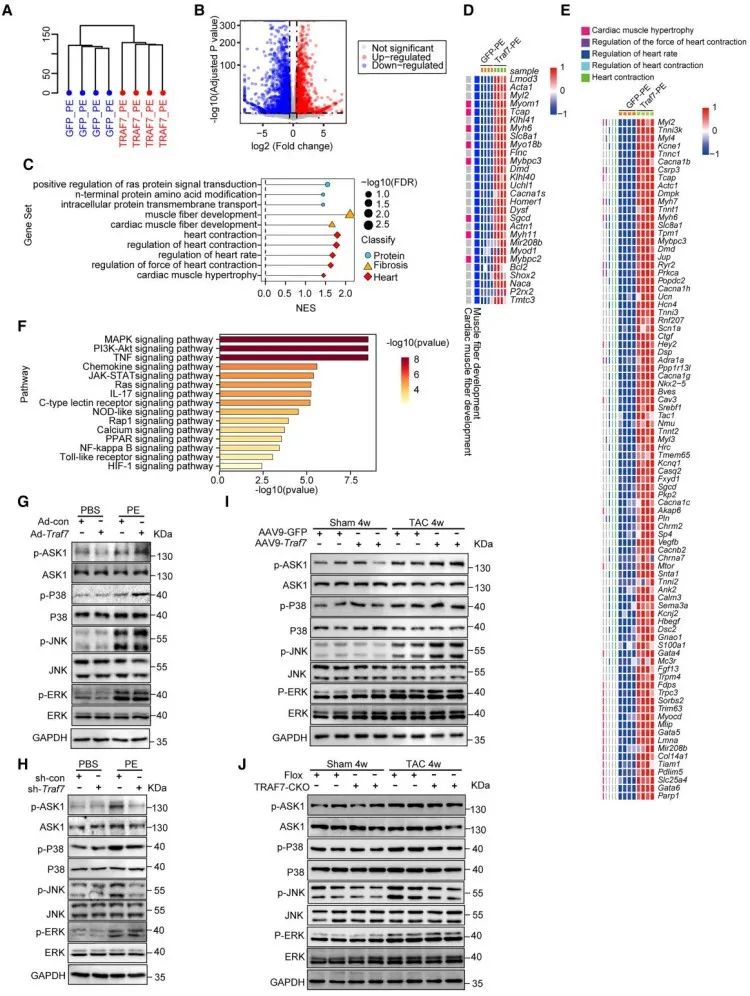
为进一步探究TRAF7影响心肌重构的机制,研究人员使用过表达TRAF7的原代心肌细胞进行转录组学测序分析,结果发现MAPK信号通路的富集,并在体内体外模型中验证了TRAF7对ASK1及其下游信号分子的调控。
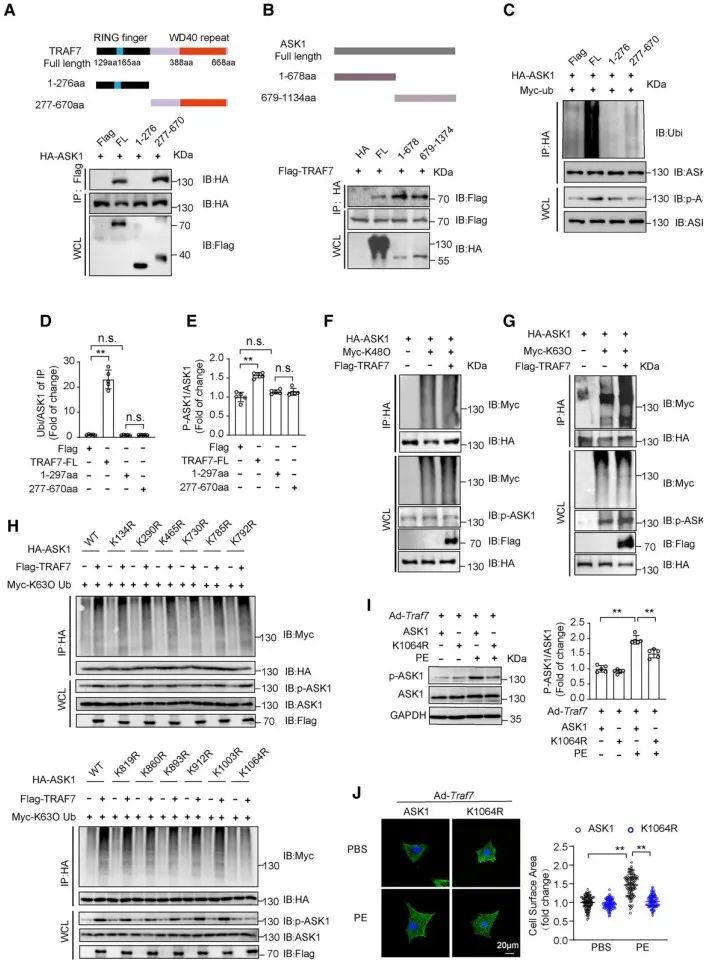
机制方面,研究人员通过免疫共沉淀、mapping、泛素化等分子实验验证了TRAF7通过WD40结构域与ASK1结合,通过RING结构域促进ASK1中lys1064位点的K63泛素化水平,使其磷酸化水平增加,并导致了下游信号通路的激活。最后,研究人员通过敲除ASK1的方式验证了ASK1是TRAF7影响压力负荷诱导心肌重构的主要靶点。
综上,本研究阐述了TRAF7在心肌重构中发挥的作用,即压力负荷诱导下ROS触发的TRAF7表达增加,通过WD40结构域与ASK1结合,在RING结构域的催化下ASK中lys1064位点的K63泛素化水平增加,促使ASK1磷酸化水平提高,激活了下游的JNK和P38活化以及心肌肥厚相关基因表达。
本研究由武汉大学人民医院唐其柱教授团队完成,博士车妍和博士生刘雨婷为本文共同第一作者,武汉大学人民医院唐其柱教授为本文独立通讯作者。本研究受到国家重点研究计划项目、国家自然科学基金研究项目、医学科学技术发展中心心血管疾病防治工程项目、湖北省科研项目、武汉市科技计划项目以及中央高校基本科研计划项目的资助。
原文链接:
https://doi.org/10.1093/cvr/cvae217
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#心肌重构# #TRAF7#
0