厦门大学刘刚/杨银贤Biomaterials: 基于巨噬细胞的抗肿瘤纳米药物
2024-12-18 BioMed科技 BioMed科技 发表于陕西省
作者概述了TAMs的特征,并讨论了靶向TAMs的纳米药物,重点介绍抑制TAMs募集、消耗和重编程TAMs、增强巨噬细胞吞噬作用、工程化巨噬细胞以及靶向TAMs进行肿瘤成像等纳米策略。
肿瘤相关巨噬细胞(TAMs)作为肿瘤微环境(TME)非常重要的构成组分,其具有高度的可塑性,能够响应复杂的TME信号而极化成不同表型,进而发挥不同的功能。根据TAMs的功能,可将TAMs分为抗肿瘤的M1型TAMs和促肿瘤的M2型TAMs。M1/M2极化过程是一种可逆的动态现象,在这一过程中,巨噬细胞会发生表型转变,从而影响其抗肿瘤功能。因此,靶向调节TAMs以释放其潜在的抗肿瘤能力对于提高癌症免疫治疗的有效性至关重要。
近期,厦门大学刘刚和杨银贤团队综述了基于巨噬细胞的抗肿瘤纳米药物,相关内容以“Emerging nanomedicines for macrophage-mediated cancer therapy”为题发表在Biomaterials上。在这篇综述中,作者概述了TAMs的特征,并讨论了靶向TAMs的纳米药物,重点介绍抑制TAMs募集、消耗和重编程TAMs、增强巨噬细胞吞噬作用、工程化巨噬细胞以及靶向TAMs进行肿瘤成像等纳米策略。此外,本文还讨论了靶向TAMs的纳米药物的潜在挑战和临床潜力,旨在推进纳米药物在癌症免疫治疗中的开发。
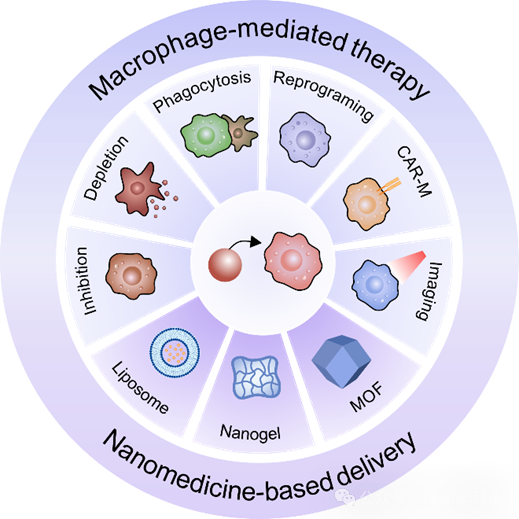
图1. 基于巨噬细胞的抗肿瘤纳米药物策略。
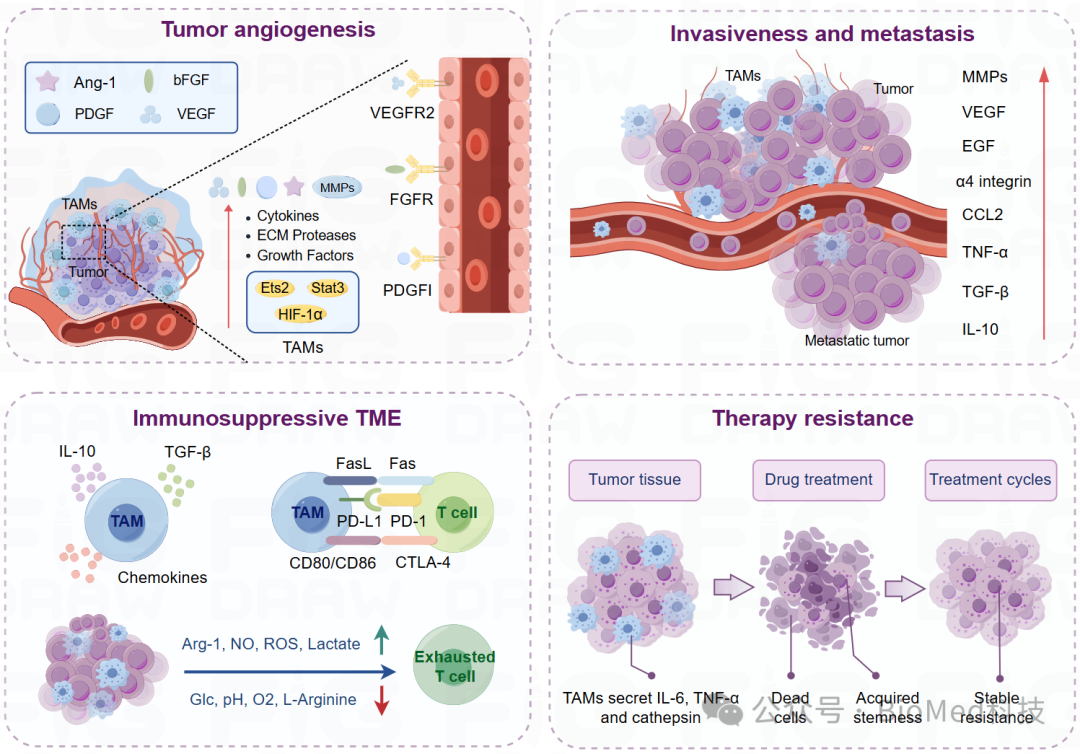
图2. TAMs在肿瘤微环境中的作用。随着肿瘤的发生发展,TAMs通过分泌免疫抑制因子、细胞因子和生长因子等方式,促进肿瘤细胞的生长增殖、血管生成、侵袭和转移、治疗抵抗以及抑制先天型和适应性免疫应答。
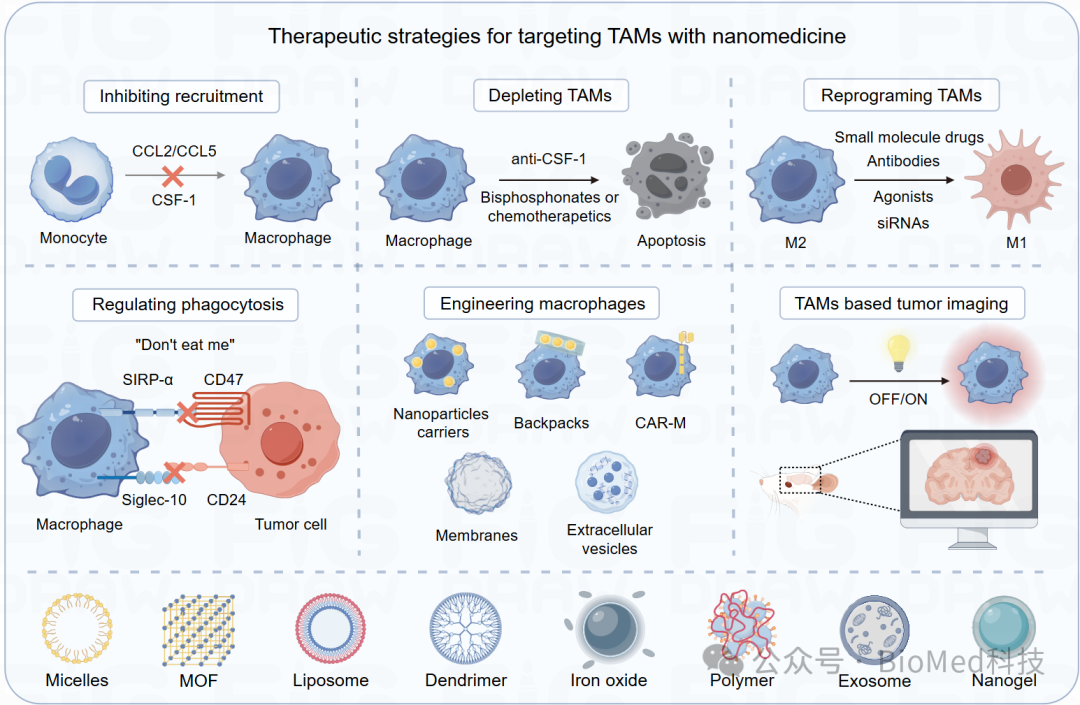
图3. 靶向TAMs的纳米药物策略。主要分为六类,包括:1)抑制TAMs的募集;2)耗竭TAMs;3)重编程TAMs向抗肿瘤表型的转化;4)增强TAMs介导的肿瘤吞噬功能;5)工程化巨噬细胞;6)基于TAMs的肿瘤成像。
厦门大学公共卫生学院刘刚教授和厦门大学药学院杨银贤副教授为该论文的通讯作者,博士后史雪莹为该论文第一作者,博士后Syed Faheem Askari Rizvi为该论文的共同作者。该论文获得国家自然科学基金和国家重点研发计划等项目的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961224005647
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#巨噬细胞# #抗肿瘤纳米药物#
9