AJH:预测CMML患者allo-HSCT后生存期的ABLAG模型
2023-07-08 聊聊血液 聊聊血液 发表于上海
国内27个中心合作开发了一种专门针对接受 allo-HSCT 的 CMML 患者的新型预后模型(ABLAG),以估计生存结局并做出治疗决策。
ABLAG模型
慢性粒-单核细胞白血病(Chronic myelomonocytic leukemia,CMML)的标准治疗包括支持治疗和细胞减灭术(cytoreductive therapy),而异基因造血干细胞移植(allo-HSCT)是其唯一的治愈手段。目前已建立多种预后系统(包括临床和遗传学特征),主要用于预测新诊断 CMML 患者的生存期,但这些预后系统对于预测 allo-HSCT 后 CMML 患者的生存期效果不佳。
因此,国内27个中心合作开发了一种专门针对接受 allo-HSCT 的 CMML 患者的新型预后模型(ABLAG),以估计生存结局并做出治疗决策,研究近日发表于《American Journal of Hematology》,通讯作者为北京大学人民医院张晓辉教授。

研究结果
该研究为全国、多中心、真实世界研究,纳入2005-2022年期间首次接受allo-HSCT的≥18岁CMML(根据WHO第五版)患者,共27家中心参加,其中26家中心为推导队列、1家中心为验证队列。
患者特征
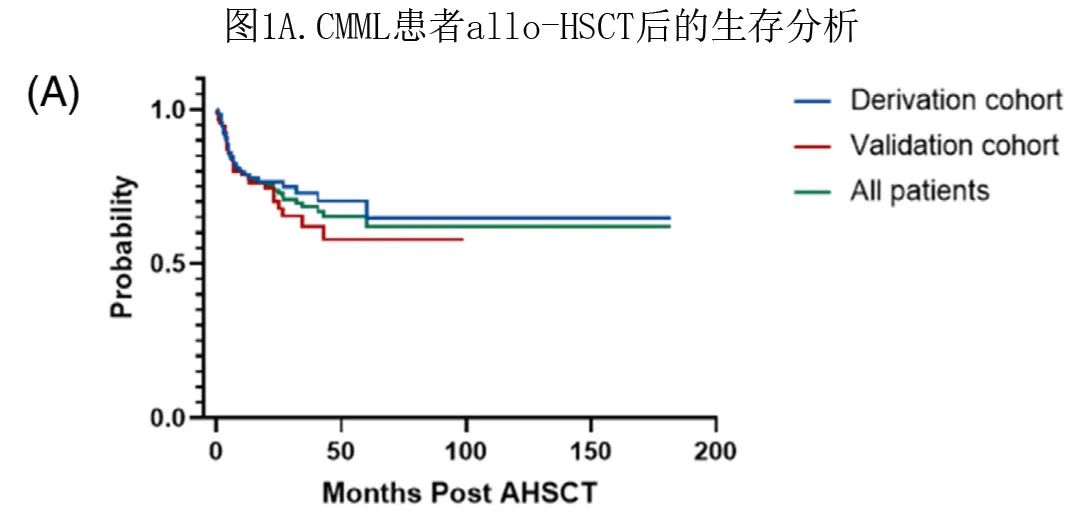
共纳入218例患者,包括推导队列119例和验证队列99例。推导队列和验证队列之间未发现患者年龄、性别、WHO分类、法美英 (FAB) 分类、细胞遗传学风险、CPSS、生化值、allo-HSCT前的治疗策略、供者类型、预处理方案或急性和cGVHD存在显著差异(表1)。
对于整个队列 (N=218),CMML诊断时的中位年龄为43岁,从诊断至移植的中位时间为5.55个月;大多数患者为男性 (65.6%)。根据 WHO 和 FAB 分类,大多数患者在移植时为WHO-2(n = 111,51%) 和骨髓增生性CMML(MP CMML;n=143,66%)。此外,根据细胞遗传学危险分层,半数患者为低危。在197例有基因突变信息的患者中,最常发生突变的基因为TET2(54.55%)、SRSF2(46.97%)、ASXL1(38.64%)、NRAS(21.21%)、DNMT3A(13.64%)、CBL(12.88%)、NPM1(12.12%)、RUNX1(12.12%)、U2AF1(11.36%)、KRAS(10.61%)、SETBP1(9.85%)、FLT3(8.33%)、JAK2(7.58%)、PTPN11(6.82%) 和GATA2(6.06%);大约一半的患者 (49.08%) 有1-3个体细胞突变。
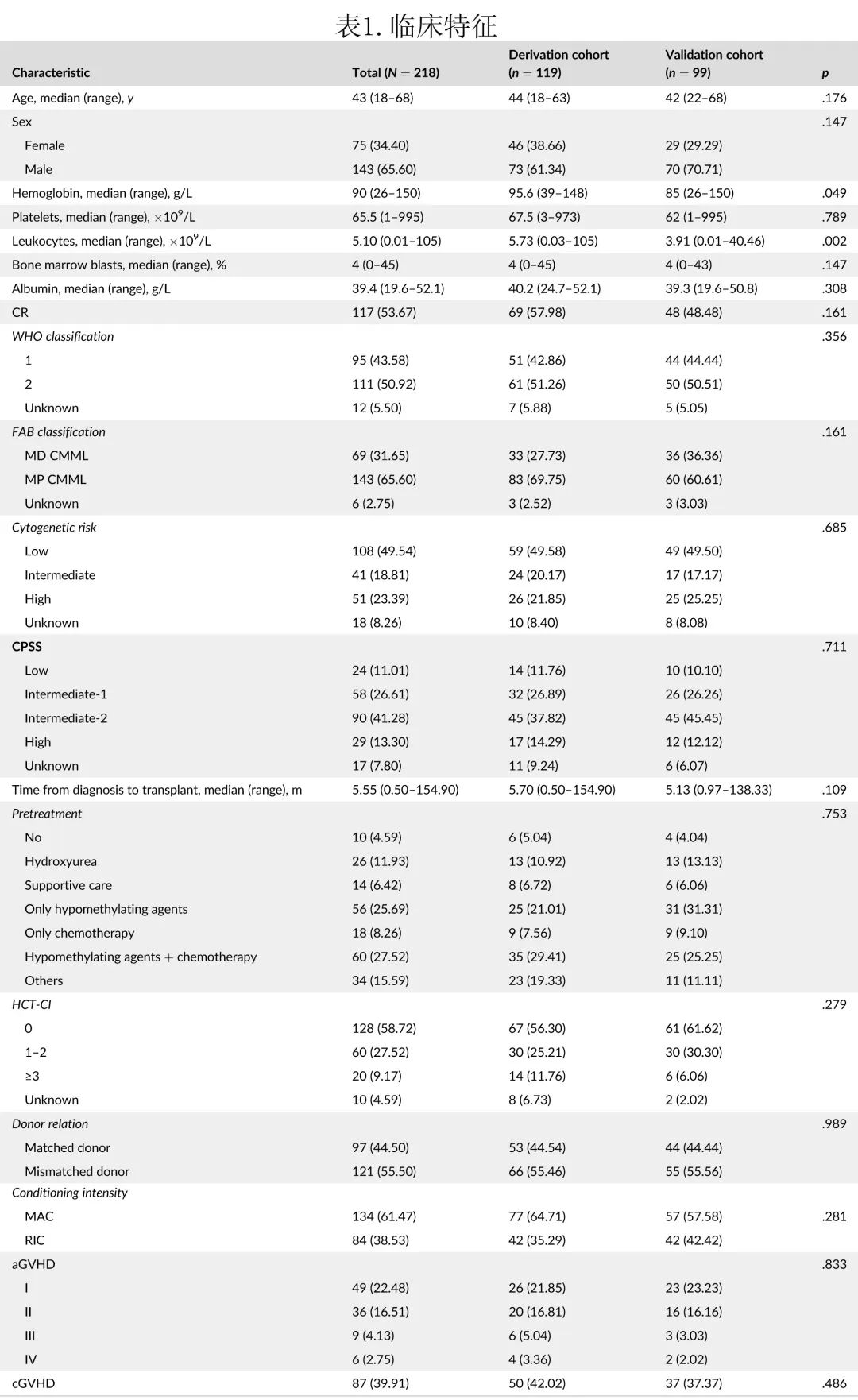
中位随访21.77个月,CMML 患者移植后的生存期见图1A,1年和3年 OS 率分别为78.9%和68.3%。
进行移植时20.18%(n=44)已经进展为AML,21.56%(n=47) 的患者在移植前依赖输血。共有44.50%的患者接受相合HSCT,其余55.50%接受单倍体相合HSCT。移植物类型以PB(65.14%) 为主,38.53%的患者采用减低强度预处理 (RIC),而61.47%的患者采用清髓性预处理 (MAC)。
末次联系时高危组中有26例患者死亡,8例死于 CMML 进展或复发,18例死于非复发相关原因,包括病毒或真菌感染 (n=6)、多器官功能衰竭(n=4,1例与 GVHD 相关)、呼吸衰竭 (n=3)、肺出血 (n=1) 和GVHD(n=1);3例患者的死亡原因未定。
临床变量和体细胞突变的预后价值
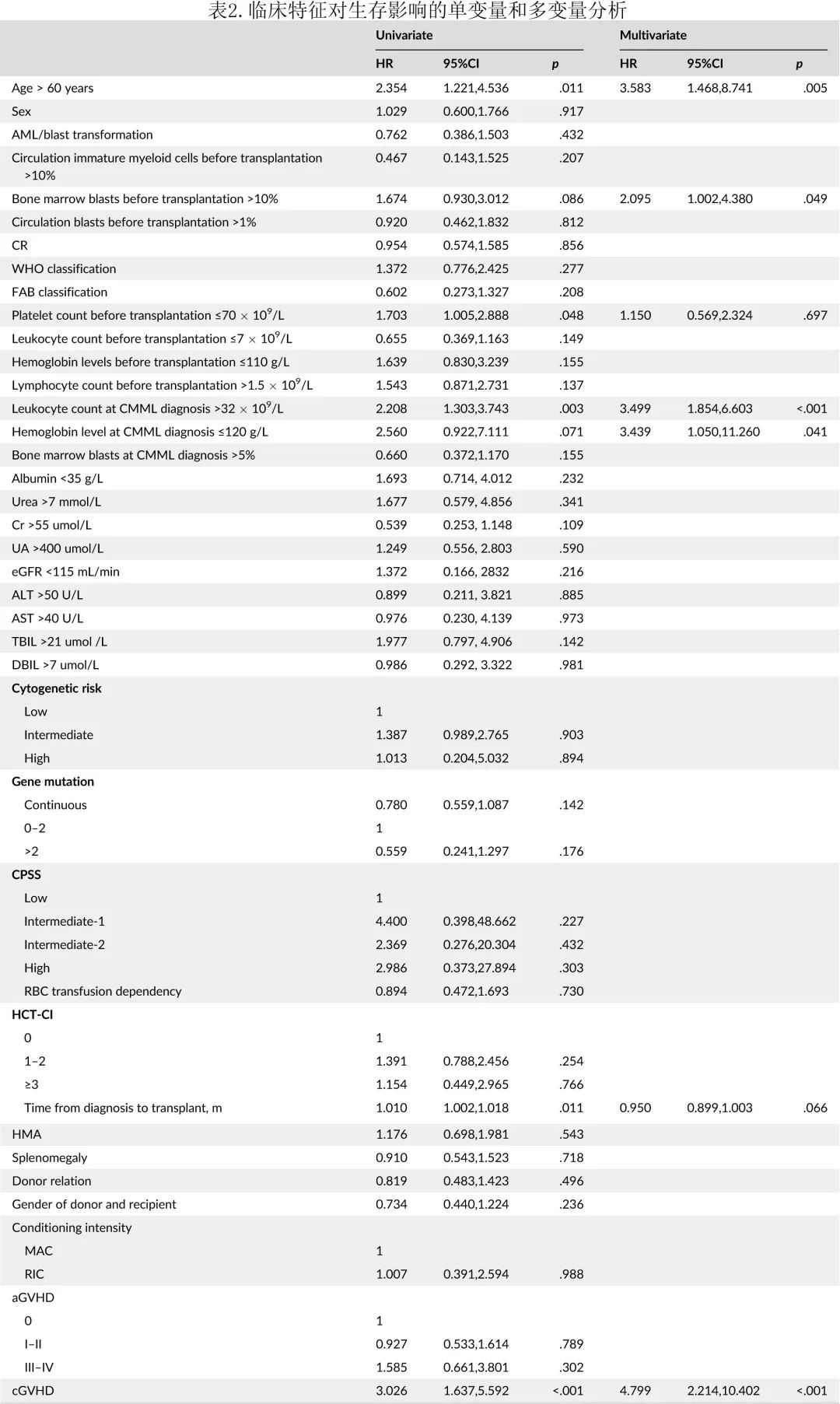
在单变量分析中,高龄(>60岁,p=0.011)、初诊时白细胞计数>32 X109/L(p=0.003)和贫血(血红蛋白≤120g/L,p=0.071)、allo-HSCT前骨髓原始细胞计数>10%(p=0.086)和血小板计数≤70 X109/L(p=0.048)、从诊断到移植的时间(p=0.011)和无cGVHD(p<0.001)与不良预后相关(表2)。
体细胞突变数量与生存率无显著相关性(p=0.142)。关于特定突变方面,ASXL1(风险比 [HR]=1.534)、NRAS (HR=1.326) 和RUNX1 (HR=1.982) 与较差的生存期相关,但差异不显著,p>0.1。
生存期的多变量分析及开发CMML预后模型
多变量分析显示,高龄(HR=3.583,95%置信区间 [CI],1.468–8.741;p=0.005)、初诊时白细胞计数(HR=3.499,95%CI,1.854–6.603;p<0.001)和贫血(HR=3.439,95%CI 1.050-11.260;p=0.041)、allo-HSCT前骨髓原始细胞计数(HR=2.095,95%CI,1.002-4.380;p=0.049)和无cGVHD(HR=4.799,95%CI,2.214–10.402;p<0.001)是CMML 患者 allo-HSCT 后生存期的独立预后因素(表2)。
基于回归系数开发了一种称为ABLAG(包括年龄Age、原始细胞Blast、白细胞Leukocyte、贫血Anemia、cGVHD)的新型 CMML 移植预后模型,每个变量指定为以下几点:初诊时年龄>60岁、骨髓原始细胞计数>10%、白细胞计数>32X 109/L和血红蛋白≤120 g/L分别为1分,未发生 cGVHD 为2分。
基于该模型可区分移植后死亡风险不同的三个风险组(p<0.001,图1B)。低危 (0-1) 组3年 OS 为93.3%;中危 (2~3) 组为78.9%;高危 (4-6) 组为51.6%。评分增加也与 PFS 降低显著相关(p<0.001)。
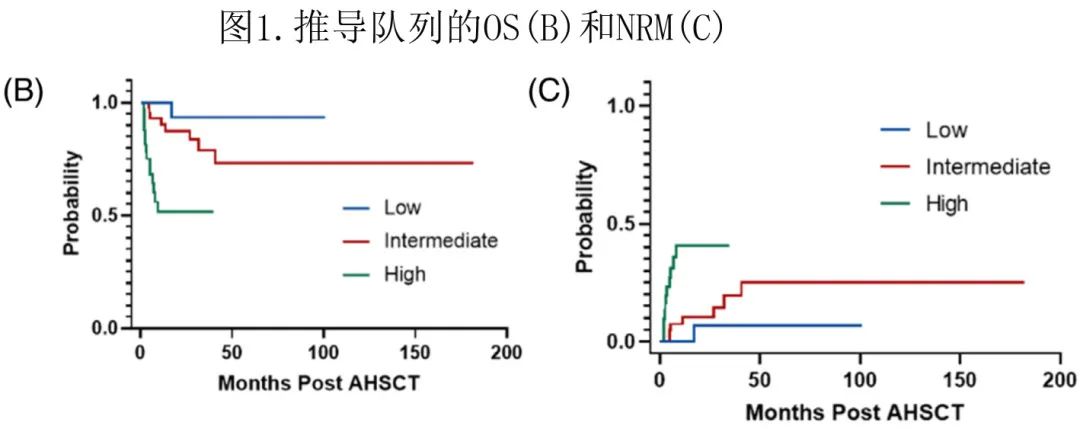
基于竞争风险框架评估提出的 ABLAG 模型对 NRM 的预后效用。CMML 风险分层与 NRM 有显著相关性(p<0.001,图1C)。3年 NRM:低危为6.1%,中危为17.3%,高危为36.8%。此外3个风险组的累积复发率无显著差异(p=0.077)。
预后模型的内部验证
在推导队列中进行了1000次自举重复的内部验证,AUC为0.829(95%CI,0.776–0.902,p<0.001),表明 ABLAG 模型在估计移植后 CMML 患者死亡概率的区分能力方面具有良好的性能(图2A)。根据校准图,估计的和实际的3年死亡风险高度一致(图2C),进一步证明了 ABLAG 模型的预后疗效优于之前定义的其他5个预后评分。此外作者构建了 DCA 曲线以检查模型对 allo-HSCT 后 CMML 患者的临床获益,如图 2E 所示,与之前的预后评分模型相比,新型预后模型促成了实质性的净获益。
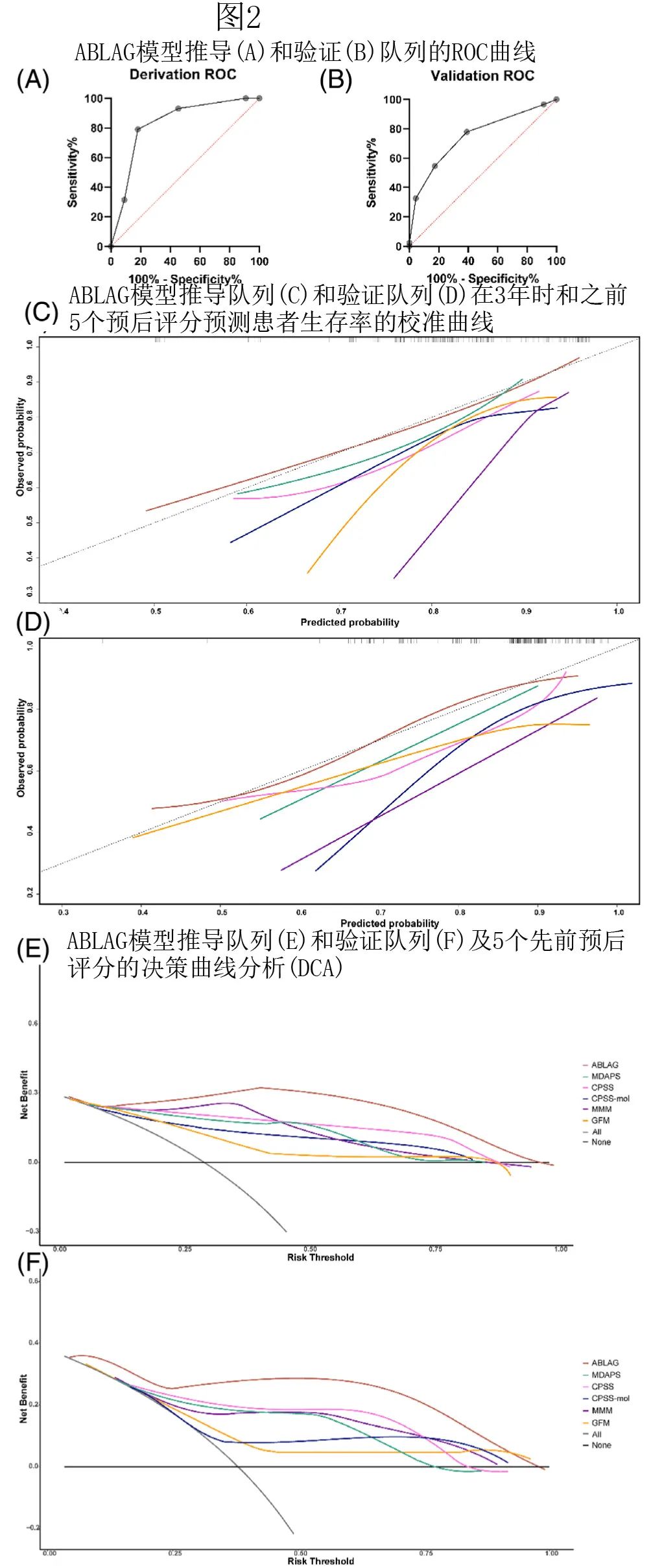
预后模型的外部验证
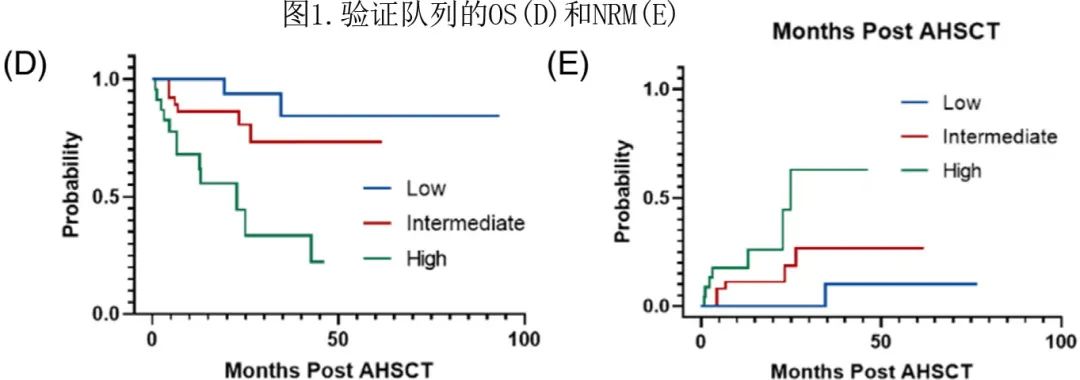
为进一步评价 ABLAG 模型的预测能力,作者对来自另1个中心的99例患者组成的验证队列的数据进行了独立外部检验。每个风险组的3年 OS 和 NRM 分别为84.4%、73.3%和33.4%(p<0.001,图1D)和8.9%、23.4%和48.4%(p=0.003,图1E)。此外,风险评分增加也与 PFS 降低显著相关(p=0.004)。
在验证队列中,ROC曲线的 AUC 为0.749(95%CI,0.684-0.85,p<0.001;图2B),进一步证明了死亡率 ABLAG 模型在区分度方面的性能良好。校准图证明,ABLAG模型的校准有效性高于之前定义的5个预后评分(图2D)。此外,该预后模型还为验证队列中的患者提供了净临床获益(图2F)。
总结
本研究中,作者通过对推导队列应用单变量和多变量 Cox 比例风险回归来确定风险因素,并建立一个新的预测 CMML 患者移植后生存率的ABLAG预后模型。在多变量分析中,高龄(风险比 [HR]=3.583)、白细胞计数 (HR=3.499)、贫血 (HR=3.439)、骨髓原始细胞计数 (HR=2.095) 和无慢性移植物抗宿主病 (cGVHD;HR=4.799) 与较差的生存期独立相关,因此开发了一种称为ABLAG的新型预后模型,并根据回归方程分配点。患者被分为低危 (0-1)、中危(2-3) 和高危 (4-6) 三组,3年总生存率 (OS) 分别为93.3%、78.9%和51.6%(p<0.001)。在内部和外部验证队列中,ABLAG模型的受试者工作特征 (ROC) 曲线下面积为0.829和0.749。与针对非移植环境设计的现有模型相比,校准图和决策曲线分析显示,ABLAG模型的预测和观察结局之间具有高度一致性,患者可从该模型中获益。
总的来说,通过将疾病和患者特征整合到一个新的 ABLAG 模型中,可为接受 allo-HSCT 的 CMML 患者提供了更好的生存分层。拥有这样的工具可能对更好地识别移植候选者具有重要意义,为移植前的 CMML 患者提供重要的预后信息,用于比较不同研究的移植结局,并可能对移植准备方案的强度选择以及移植后维持治疗产生影响。
参考文献
Zhou JY,Wang S,Yuan HL,et al. Impact of a novel prognostic model on allogeneic hematopoietic stem cell transplantation outcomes in patients with CMML.Am J Hematol . 2023 Jun 27. doi: 10.1002/ajh.26999.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







