JCO:C7R-GD2.CAR-T细胞治疗恶性脑瘤一期临床试验结果
2024-07-09 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
本研究通过对H3K27改变的CNS肿瘤患者进行GD2.CAR-Ts和C7R-GD2.CAR-Ts细胞治疗,发现C7R-GD2.CAR-Ts的副作用在可接受范围内,且展现出一定的临床疗效。
弥散性中线神经胶质瘤 (DMGs) 是一种侵袭性很强且难以治愈的中枢神经系统肿瘤。H3K27M DMGs是一种常见亚型,它的特征之一是OPCs (Oligodendrocyte Precursor Cells,寡突胶质细胞前体细胞) 中的组蛋白H3编码基因H3F3A (H3.3)或HISTIH3B (H3.1) 发生错义突变,组蛋白H3第27位的赖氨酸突变为甲硫氨酸,导致该位点无法进行三甲基化,进而改变了染色质结构,影响了相关基因的表达,从而导致了肿瘤发生。
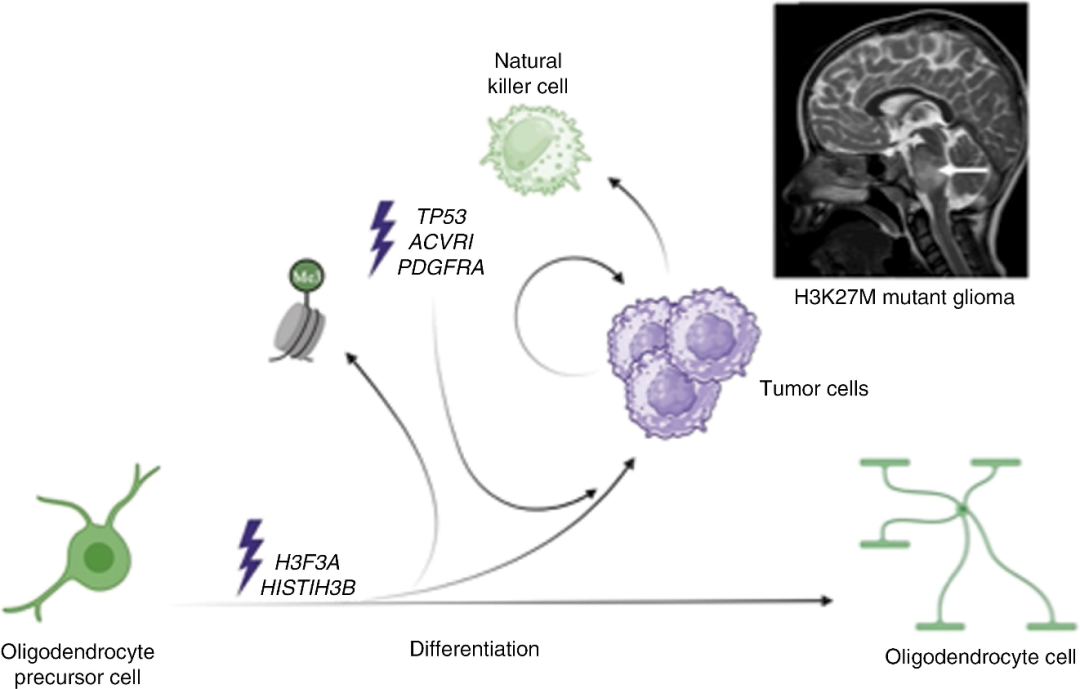
图1:H3K27M+ DMG的分子机制
该肿瘤主要发生于儿童和青少年中,通常预后很差。由于该肿瘤形成于中枢神经系统的中线结构中 (如丘脑,脑干和脊髓),因此手术治疗有限制。此外,该肿瘤对放疗和化疗的敏感性较差。姑息性放疗是目前唯一被证实有用的标准疗法,该疾病初次诊断后的OS (OS) 仅在10到15个月之间。
GD2 (双唾液酸神经节苷脂) 在H3K27改变的DMG和复发性中枢神经系统胚胎肿瘤中高度表达,因此被视为CAR-T细胞治疗的潜在靶点。GD2.CAR-T细胞治疗也是目前正在开发的新型治疗策略。然而,目前针对中枢神经系统肿瘤的CAR-T细胞治疗效果不尽如人意,主要原因是肿瘤微环境中的免疫抑制现象。
近日,由 Bilal Omer 和 Cliona M. Rooney 团队发表于 Journal of Clinical Oncology 题为 Phase I Trial of GD2.CART Cells Augmented With Constitutive Interleukin-7 Receptor for Treatment of High-Grade Pediatric CNS Tumors 的文章,该团队在GD2.CAR-T细胞上表达了IL7受体(C7R), C7R CAR-T细胞不需要依赖IL7就可以激活下游信号通路,增强CAR-T细胞疗效。在H3K27改变的CNS肿瘤患者中的一期临期试验,分析比较了C7R-GD2.CAR-Ts的治疗效果。结果表明,接受C7R-GD2.CAR-T细胞治疗的患者,显示出神经功能缺陷的短暂改善,血液中的细胞因子/趋化因子有所增加,部分患者的肿瘤也有所缩小。而且,C7R-GD2.CAR-Ts的副作用在可接受范围内,是一种有治疗前景的药物。

该临床试验的患者需要满足以下几个条件:
(1)年龄在12个月到21岁之间;
(2)患有 H3K27-altered的DMG (包括脑桥和丘脑部位), 复发性H3K27-altered DMG (除脑桥外部位)或其他H3K27-altered复发或恶化的CNS肿瘤;
(3)这些患者需要具有H3K27变异,或者50%以上的肿瘤细胞表达GD2;
(4)所有病人在临床试验之前,已经接受了至少四周的标准放疗;
(5)肿瘤最大直径≤5 cm(对于已经进行过减负手术的肿瘤,最大直径≤5.5 cm);
(6)Karnofsky或Lansky性能评分≥50;
(7)在稳定的类固醇剂量下,神经学检查稳定≥7天;
(8)所有的患者在接受CART疗法前都需要安装脑室导管。
依据这些条件,最终有11位具有资质的患者进入临床试验。
这些患者的的中位年龄是12岁,女性和男性患者的比例几乎相等。11名患者中有10名(91%)在入组时有神经功能缺损。其中,有8名DMG患者,包括丘脑型4名、桥脑型3名、脊髓型1名;四名丘脑型患者里,有三名(患者3、9和12)是复发型。
其次,有两名复发性髓母细胞瘤和1名复发性非典型性畸胎瘤/横纹肌肉瘤(AT/RT,1名)。
所有患者在接受CAR-T疗法前都接受了放疗,DMG患者从放疗到CAR-T注射的中位时间是10周,胚胎瘤患者是38周。两名复发性丘脑型DMG患者在入组研究前接受了放疗和化疗,而所有其他DMG患者在放疗后的3个月内接受了CAR-T细胞注射。两名复发性髓母细胞瘤患者都接受了多种化疗方案,而复发性AT/RT患者在CAR-T细胞注射前接受了辅助化疗和全脑全脊髓再次放疗。
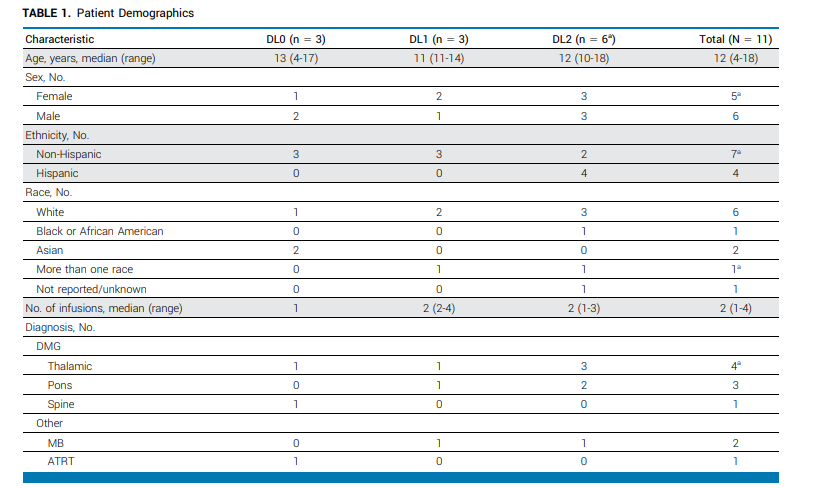
表1:入组患者总结
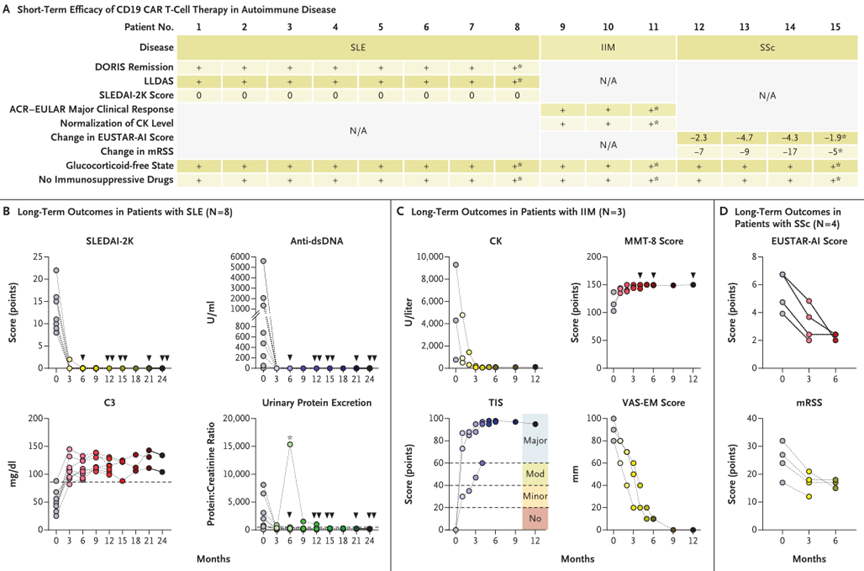
在试验开始前,所有的患者都会接受淋巴细胞清除(清淋)的过程,以为CAR-T细胞治疗做好准备。然后,他们被分为三个研究组。第一组(DL0)接受了不含C7R基因的GD2.CAR-T细胞治疗,剂量1 x 10^7 cells/m^2。第二组(DL1)和第三组(DL2)则接受含有C7R基因的C7R-GD2.CAR-T细胞治疗。DL1组的剂量与DL0组相同,即1 x 10^7 cells/m^2。而DL2组的C7R-GD2.CAR-T细胞剂量则增加到3 x 10^7 cells/m^2。对于疾病状态在接受治疗后稳定或有所改善的患者,他们可以再次接受治疗,最多可接受三次CAR-T细胞注射,两次注射的间隔时间至少为6周。
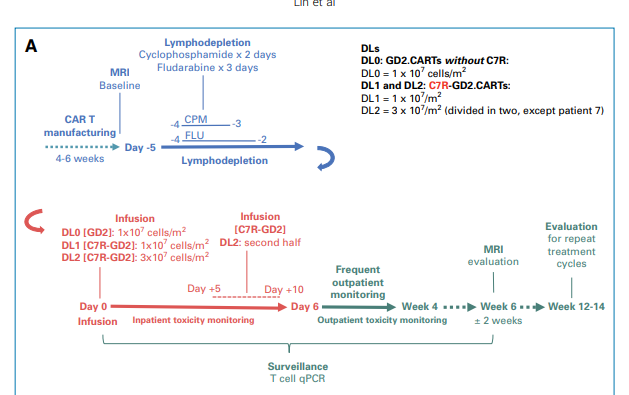
图2:临床试验方案图示
毒性和不良反应
11名患者共接受了24次CAR-T注射。8名接受C7R-GD.2 CAR-T治疗的患者中,有七名 (88%) 接受了多次治疗,没有观察到DLT (Dose-limiting toxicity,剂量限制性毒性)。
接受不含C7R基因的GD2.CAR-T治疗的患者(即DL0组)中,没有发生CRS (Cytokine Release Syndrome,细胞因子释放综合征) 或TIAN (Tumor Inflammation-associated neurotoxicity, 肿瘤炎症相关神经毒性)。
8名接受C7R-GD2.CAR-T疗法的患者中,有7名(88%)出现了1级TIAN,5名(63%)出现了1级CRS。所有出现CRS的患者在接受Tocilizumab(托珠单抗)治疗后24小时内症状得以缓解,所有TIAN患者在接受anakinra(阿那白滞素)治疗一周内症状消失。其中,两名1级TIAN患者的颅内压保持在正常范围内。
第一位接受C7R-GD2.CAR-Ts治疗的患者 (DL2组,患者7), 在注射3×10^7 cells/m^2C7R-GD2.CAR-Ts的48小时后,出现了4级CRS。然而,72小时后,病情改善为2级CRS。在接受了anakinra、tocilizumab和dexamethasone(地塞米松)治疗后的第五天,症状完全消失。
为了确保治疗的安全性,所有DL2组的患者在后续进行治疗时,不再一次性注射3x10^7 cells/m^2的C7R-GD2.CARTs,而是分为两次注射,每次注射1.5x10^7 cells/m^2的C7R-GD2.CARTs,每次间隔5-7天。在接下来的五位DL2组的患者中没有再出现高于2级CRS。
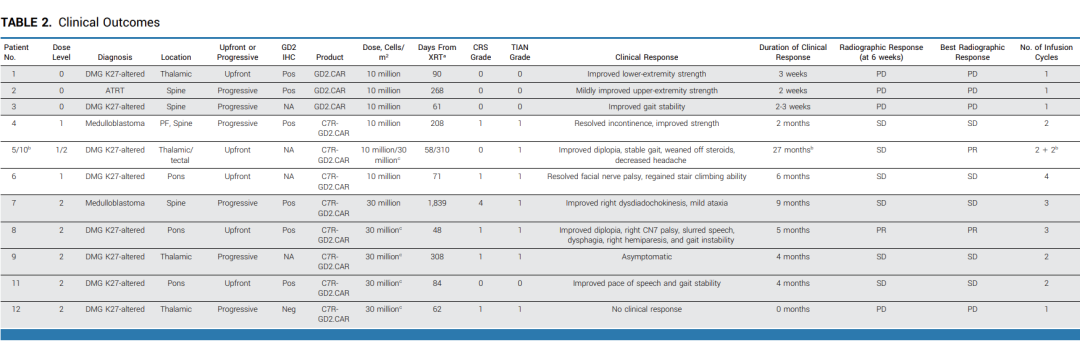
表2 : 临床结果总结
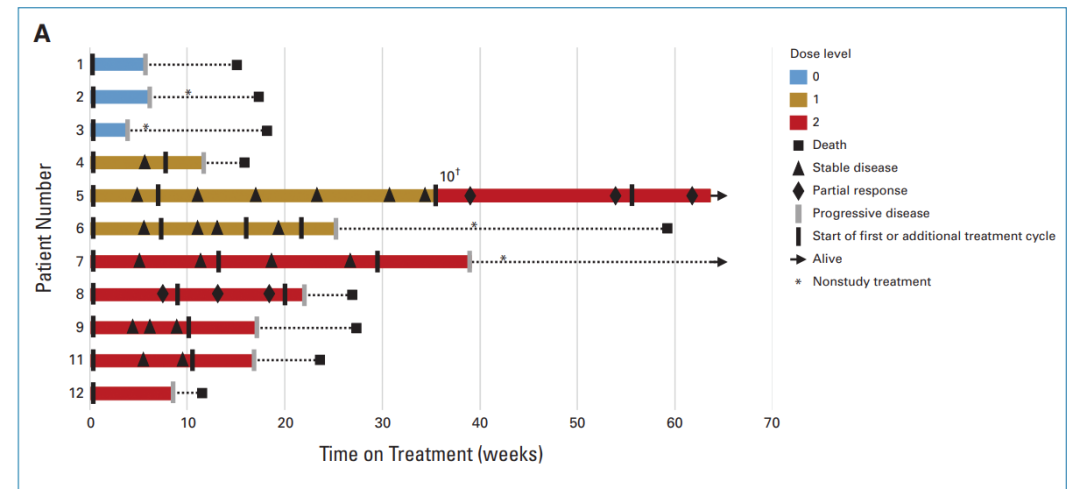
图3: 临床结果统计
治疗效果评估
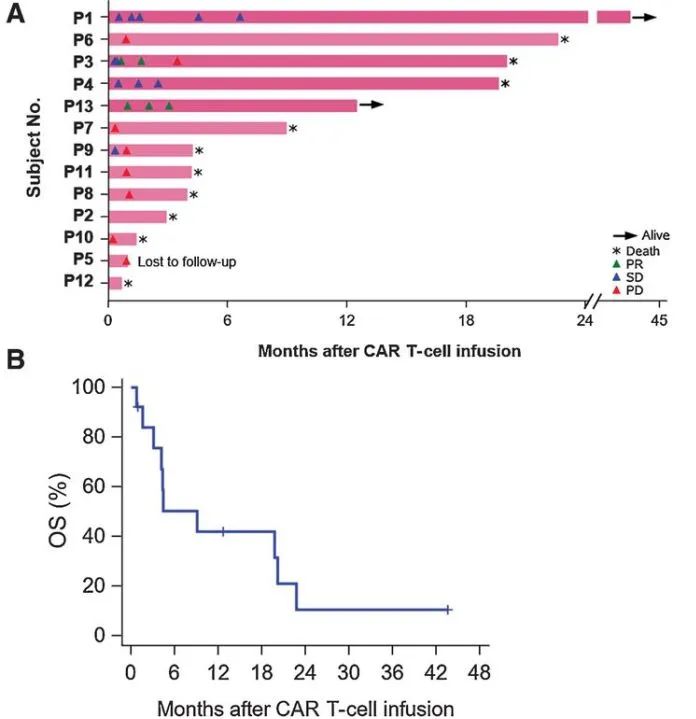
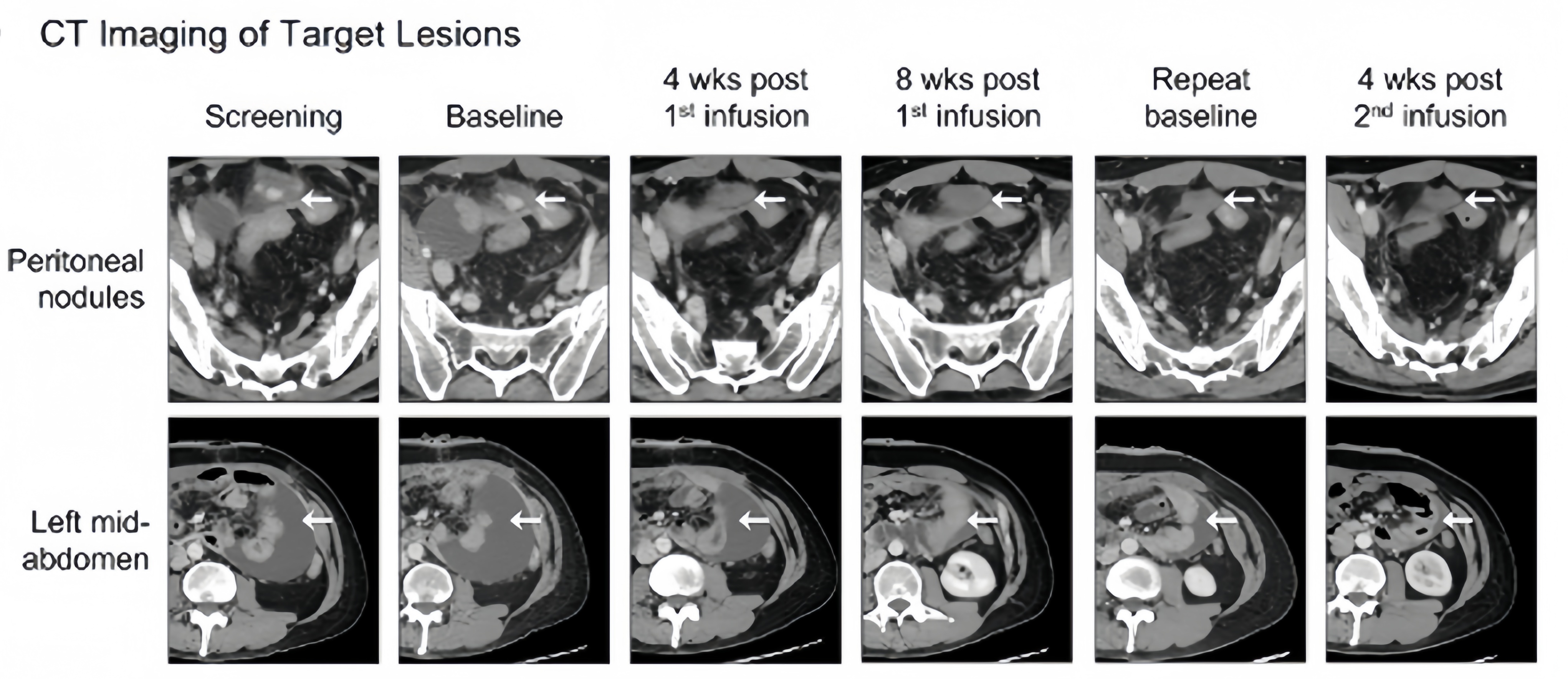
在接受CAR-T治疗前,有10名患者存在神经功能缺陷,其中9名(90%)在治疗后神经功能有所改善。对于接受不含C7R的GD2.CAR-Ts治疗(即DL0组)的患者,其神经功能改善的持续时间不超过三周。对于接受C7R-GD2.CAR-T治疗的患者,86%的患者神经功能缺陷有所减少,持续时间的中位数为5个月。其中,88%的患者疾病状态呈现部分缓解(PR)或病情稳定(SD),具体来说,1名患者疾病部分缓解,6名患者疾病稳定 (图4)。对于5名在疾病前期就进行DMG治疗的患者,其中2位表现出了PR作为最佳的放射学反应。有三位(60%)表现出SD,并观察到了肿瘤组织内部坏死 (图5A, 5B)。相比于接受GD2.CARTs的患者,C7R-GD2.CAR-Ts患者的无进展生存期比使用GD2.CARTs治疗的患者更长。然而,尽管进行了重复的CAR-T细胞疗法,大多数患者的病情最终还是进展了。
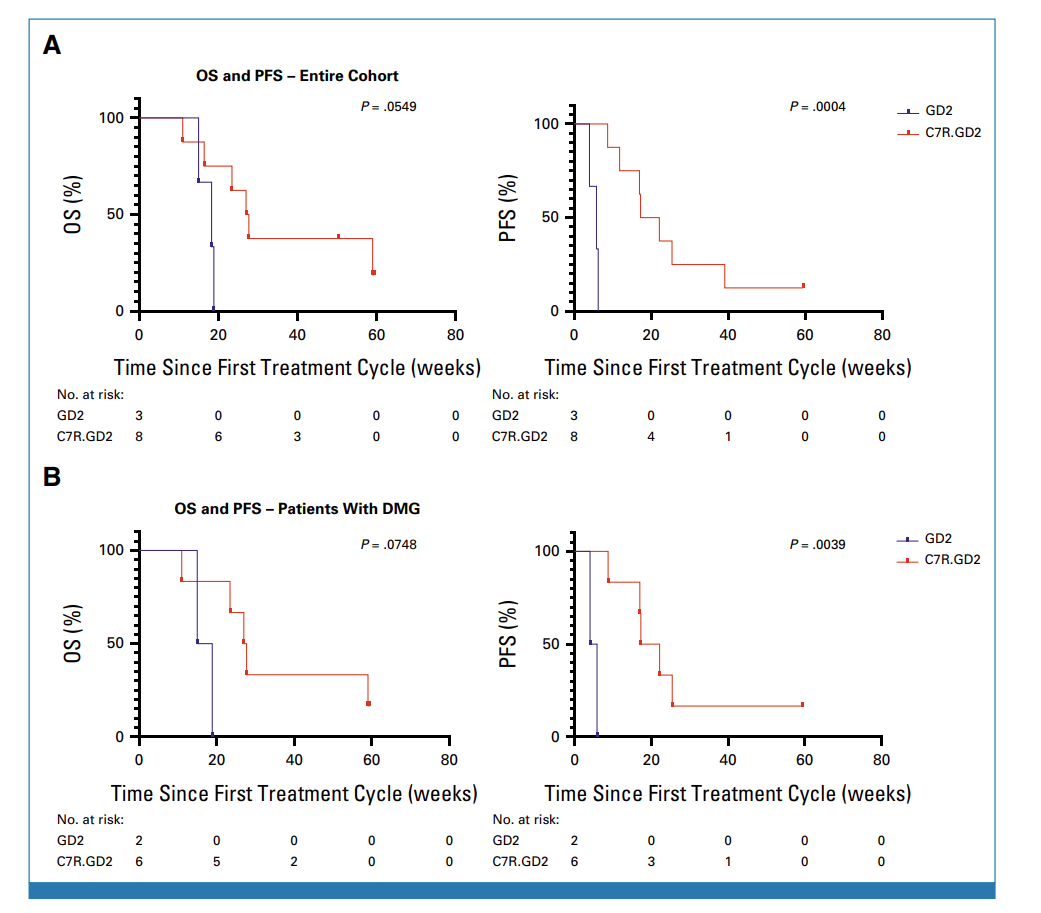
图4 所有试验患者 (A) 和 DMG患者 (B) 的OS和PFS统计
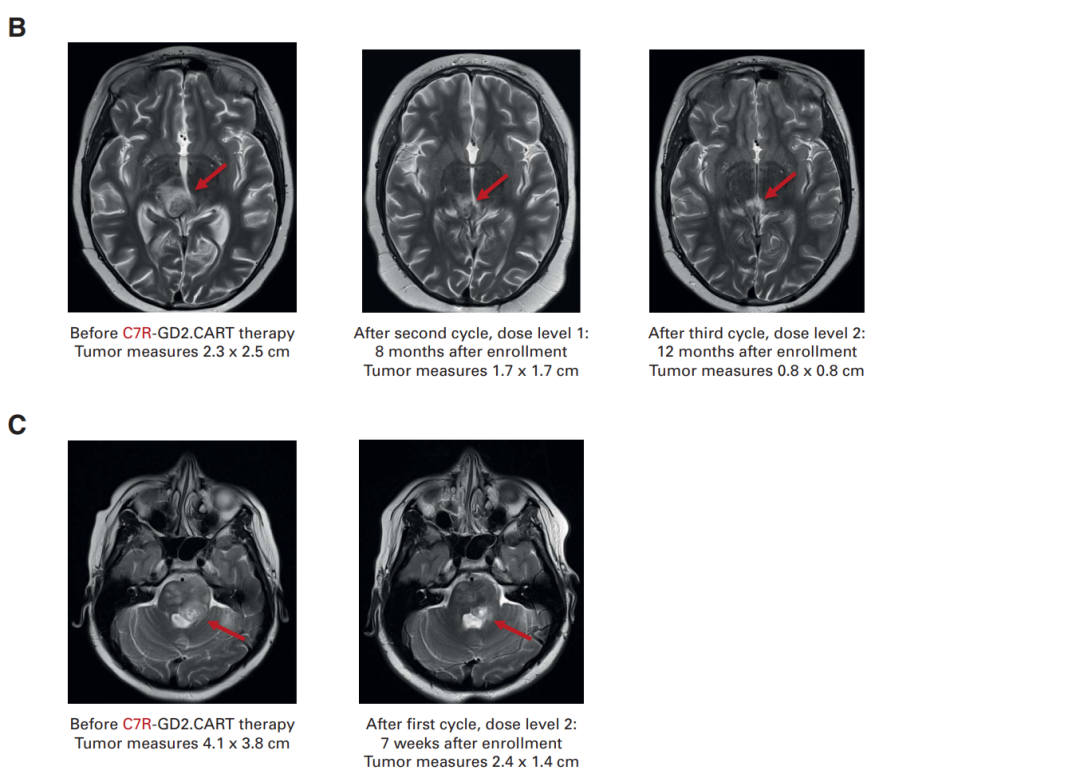
图5 脑部核磁成像显示肿瘤有所缩小。A:患者5/10 B:患者8
CAR-T持久性和注射后细胞因子水平
不管是GD2.CAR-T还是C7R-GD2.CAR-T,在患者外周血中都观察到大量的增殖。对于所有剂量组,C7R和GD2的mRNA表达水平在第一周达到峰值,然后逐渐下降,C7R的下降比GD2更为缓慢。在第二次和第三次注射后,两种基因的表达趋势和第一次相似 (图6A)。患者8在接受了C7R-GD2.CAR细胞注射后3个月,对其肿瘤组织进行了检测,此时可以检测到C7R基因,但无法检测到GD2.CAR。
对患者的与细胞因子水平进行检测发现, 接受C7R-GD2.CAR-Ts治疗的患者有更高的细胞因子水平响应 (图6B)。注射后一周,发生CRS患者有更高水平的IL6和IP-10, 发生4级CRS的患者具有最高水平IL6和IP-10响应 (图6C)。
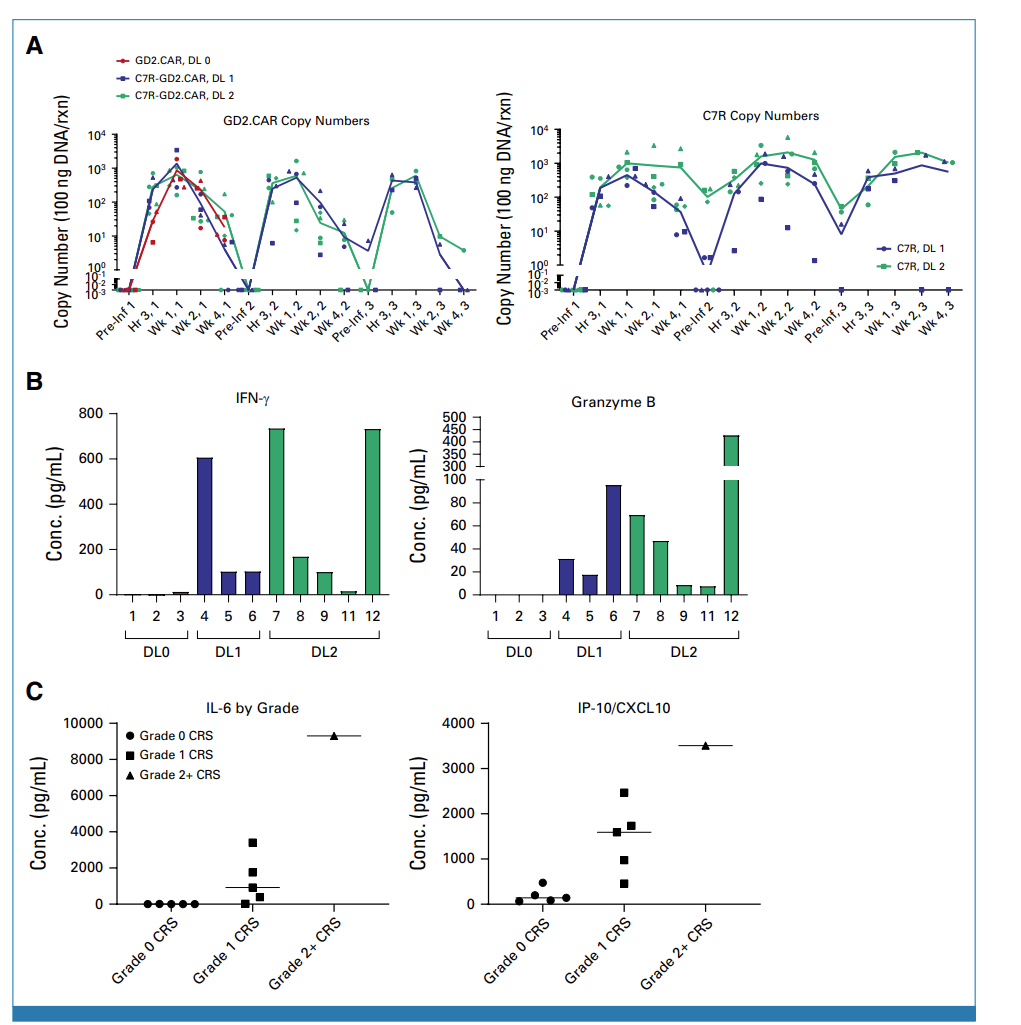
图6 GD2表达、CAR-T动力学和细胞因子检测
总之,本研究通过对H3K27改变的CNS肿瘤患者进行GD2.CAR-Ts和C7R-GD2.CAR-Ts细胞治疗,发现C7R-GD2.CAR-Ts的副作用在可接受范围内,且展现出一定的临床疗效。但是,仍需要进一步的研究来优化CAR-T细胞治疗,并在更广泛的患者群体中进行临床试验。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#CAR-T细胞治疗# #H3K27M# #弥散性中线神经胶质瘤# #IL7受体#
116