【协和医学杂志】艾司氯胺酮通过海马BDNF-TrkB通路改善神经病理性疼痛所致小鼠工作记忆障碍
2024-04-23 协和医学杂志 协和医学杂志 发表于陕西省
艾司氯胺酮可能通过海马BDNF-TrkB神经通路促进海马齿状回神经再生,进而改善小鼠神经病理性疼痛所致的工作记忆障碍。
神经病理性疼痛患者常伴随记忆障碍[1],工作记忆作为一种通过信息加工处理任务信息的系统,对日常生活意义重大, 但临床上约60%的慢性疼痛患者常出现明显的注意力缺陷或工作记忆障碍[2-3]。动物实验亦表明,小鼠神经损伤后会出现明显的工作记忆障碍[4],然而目前神经病理性疼痛相关的记忆障碍治疗手段有限。氯胺酮是一种常用麻醉药,主要包括消旋氯胺酮、左旋氯胺酮、艾司氯胺酮(又名右旋氯胺酮)[5]。2019年3月,美国食品药品监督管理局和欧洲药品管理局批准艾司氯胺酮鼻喷雾剂用于治疗成人难治性抑郁症[6],然而艾司氯胺酮对神经病理性疼痛所致工作记忆障碍的作用及可能机制目前尚不清楚。本研究拟通过建立小鼠动物模型,探索这一作用及其可能机制。
1 材料与方法
1.1 实验动物及分组
体质量21~25 g的2月龄雄性C57BL/6J小鼠50只[生产许可证号:SCXK(浙)2021-0006],小鼠自由饮食,饲养环境23~25 ℃,相对湿度40%~60%,12 h的光照/黑暗周期(07:00~19:00之间给予光照)。采用随机数字表法将小鼠分为假手术+生理盐水组(SN组)、慢性坐骨神经压迫(CCI)+生理盐水组(CN组)、CCI+艾司氯胺酮组(CE组)、CCI+ANA-12(TrkB拮抗剂)组(CA组)、CCI+ANA-12+艾司氯胺酮组(CAE 组)5 组,每组10只。
本研究已通过东部战区总医院实验动物伦理审查委员会审批(审批号:2023JLHGZRDWLS-00054)。
1.2 方法
1.2.1 主要试剂及药物
主要试剂:兔源性脑源性神经营养因子(BDNF)一抗(ab108319,Abcam公司,美国),小鼠源性Doublecortin一抗(sc-271390,Santa Cruz 公司,美国),兔源性溴脱氧尿嘧啶核苷(BrdU)一抗(ab152095,Abcam公司,美国),兔源性β-actin一抗(CTX124212,GenTex公司,美国),抗兔红外染料偶联二抗IRdye 800( 926-32211,LI-COR Biosciences公司,美国 ),山羊抗小鼠二抗(115-005-003,Jackson ImmunoResearch 公司,美国),山羊抗兔二抗(111-005-003,Jackson ImmunoResearch 公司,美国),4′,6-二脒基-2-苯基吲哚(DAPI)染料(D9542,Sigma-Aldrich公司,美国),蔗糖(57-50-1,上海生工生物工程有限公司,中国),冰冻切片包埋剂(4583,SAKURA公司,美国)。
主要药物:艾司氯胺酮(210511BL,江苏恒瑞医药有限公司,中国),用生理盐水稀释至1 g/L。ANA-12(219766-25-3,MCE公司,美国),一种选择性TrkB受体拮抗剂,被广泛用作TrkB受体的拮抗剂,ANA-12通过与TrkB受体结合抑制其活性,从而阻断BDNF信号通路;根据药品说明书配制储备液,然后依次加入5% DMSO,40% PEG 300,5% Tween-80,50%生理盐水配制为澄清溶液。BrdU[B5002,西格玛奥德里奇(上海)贸易有限公司,美国],一种类似于DNA前体胸苷激酶的物质,在S期可替代胸腺嘧啶核苷选择性结合至细胞DNA中,从而判断细胞的增殖能力;用 1×PBS 溶解适量的 BrdU 配制成10 g/L储存液。
1.2.2 CCI模型建立及药物干预
CCI模型建立:三溴乙醇(0.2 mL/10 g)腹腔注射麻醉小鼠,将小鼠左后肢剪毛后碘伏消毒,于股骨下方切开皮肤,钝性分离股二头肌,暴露出坐骨神经,用玻璃分针将坐骨神经与周围软组织分开,5-0羊肠线结扎坐骨神经4道,每道间隔约1 mm。注意结扎松紧度,以打结时腿部肌肉轻微抽动为准。最后逐层缝合肌肉和皮肤。手术过程中使用保温垫维持体温,术毕将小鼠放回原鼠笼,于温暖安静的环境中恢复至清醒状态。SN组小鼠仅暴露坐骨神经,不进行结扎处理。
药物干预:于造模后第16 天,CE组、CAE 组给予艾司氯胺酮(10 mg/kg)腹腔注射,CAE组于艾司氯胺酮注射前半小时给予ANA-12(0.5 mg/kg),CA组仅给予ANA-12腹腔注射,SN组、CN组仅给予等量生理盐水腹腔注射,连续给药5 d。于造模后第21~23天腹腔注射BrdU。
1.2.3 机械痛阈测定
造模后第21天将小鼠放置于有网格的金属筛网上,用有机玻璃箱将小鼠隔开,适应30 min后,应用一系列 von Frey 细丝(力度0.008~2.0 g) 垂直刺激小鼠足底皮肤,力度从0.008 g开始,观察小鼠缩足反应。如果细丝刺激小鼠无缩足反应则给予大一级力度的细丝刺激,直至小鼠出现缩足反应,记为“X”并记录此次细丝的力度,然后改用小一级力度的细丝再刺激,如果小鼠有缩足反应,则记为“X”并减小细丝力度,若无缩足反应则记为“O”,改用大一级力度的细丝再刺激,按照上诉原则连续测量4次,得到一串以“X”和“O”组合的序列,将该序列和第一次出现缩足反应的细丝力度输入软件,计算小鼠机械缩足反射阈值(PWT)。为避免频繁或长时间的刺激造成小鼠耐受或痛敏,前后两次不同刺激间隔至少1 min。
1.2.4 热痛阈测定
造模后第21天将小鼠置于3 mm厚的玻璃板上,用有机玻璃箱将小鼠隔开,适应环境30 min,将热测痛仪预热在(55.0±0.3)℃范围,自动切断时间设定为20 s,光源由玻璃板下方对准小鼠足底中部皮肤,出现抬足、舔足、逃避等反应时,记录刺激仪上的数值,连续测量5次,每次间隔5 min,去除最大值和最小值后取3次平均值为热缩足潜伏期(PWL)。
1.2.5 旷场实验
造模后第21天,采用旷场实验检测小鼠运动能力。测试前,将实验小鼠放入测试房间提前适应2 h,随后将小鼠放置于旷场实验箱(40 cm×40 cm×40 cm)中央,通过图像自动监视系统连续记录小鼠5 min自发活动轨迹。2次实验之间用75%酒精搽拭实验设备底部,以免上一只小鼠残留的信息影响下一只小鼠实验结果。
1.2.6 Y迷宫实验
造模后第22天,采用Y迷宫检测小鼠工作记忆。测试前将实验小鼠放入测试房间提前适应2 h,然后将小鼠置于一个共A、B、C 3个臂(臂长35 cm,臂宽8 cm,臂高15 cm),各个臂夹角120°的Y型迷宫的中央区域,记录8 min内小鼠进入各个臂的顺序。正确的自发性交替被定义为连续进入不同的三个臂,如ABC、BCA、CAB,然后计算自发性交替正确率=正确的自发性交替次数/(进臂总次数-2)×100%。
1.2.7 蛋白免疫印迹试验
造模后第24天,检测小鼠的BDNF表达水平,观察药物对小鼠海马神经再生功能的影响。具体操作:5组小鼠均随机选取5只麻醉后断头,剥离出完整大脑,分离出小鼠海马组织,放入EP管内,依次加入1×RIPA裂解液、蛋白酶抑制剂及磷酸酶抑制剂,然后使用匀浆器于冰上研磨组织,研磨完全后静置30 min。4 ℃离心机12 396×g离心15 min,取上清于-80 ℃保存。用BCA蛋白试剂盒测定蛋白浓度后计算40 μg总蛋白的溶液体积加入EP管中,后依次加入SDS-PAGE蛋白上样缓冲液,双蒸水共配成10 μL上样量,100 ℃煮沸5 min放置于冰上。
通过SDS-PAGE蛋白电泳分离蛋白,电泳完毕后,恒压100 mV,90 min,将蛋白转移至硝酸纤维素膜上,随后用5%脱脂牛奶封闭1 h,TBST洗膜3次,每次10 min,加入兔BDNF一抗(1:1000)于4 ℃冰箱中孵育过夜,并与抗兔红外染料偶联的二抗(IRdye800)反应。采用Odyssey红外成像系统对膜进行扫描成像。
1.2.8 免疫荧光试验
造模后第24天,检测小鼠BrdU及双皮质素(DCX)共染阳性(BrdU+/DCX+)细胞数量,观察药物对海马齿状回神经再生障碍的影响。
具体操作:5组小鼠剩下各5只麻醉后经右心室灌注4 ℃的1×PBS缓冲液,灌注完毕后,剪下头颅并剥离颅骨,暴露出完整大脑并取出放入4%多聚甲醛固定过夜。固定后放入30%蔗糖溶液脱水至沉底,彻底脱水后用冰冻切片包埋剂包埋后进行冰冻切片。室温下脑片干燥后放入1×PBS缓冲液漂洗3次,每次5 min,后放入盐酸37℃孵育变性,硼酸缓冲液中和后再用1×PBS漂洗3次,每次5 min;加入5%牛血清室温封闭1 h,然后加入小鼠源性Doublecortin一抗(1:200)4 ℃孵育过夜,1×PBS缓冲液于摇床上洗3次,每次5 min,室温避光加入山羊抗小鼠二抗孵育60 min,1×PBS缓冲液于摇床上洗3次,每次5 min,于室温下封闭1 h后加入兔源性BrdU一抗(1:500)4 ℃孵育过夜,1×PBS缓冲液漂洗3次,每次5 min,室温避光加入山羊抗兔二抗孵育60 min,于1×PBS缓冲液漂洗3次,每次5 min,最后用50%的甘油溶液封片,荧光显微镜下拍照。
1.3 统计学处理
采用SPSS 20.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 CCI及药物处理对小鼠机械痛阈及热痛阈的影响
与SN组比较,CN组、CE组、CA组、CAE组小鼠术后21 d的PWT均明显降低(P均<0.05),PWL明显缩短(P均<0.05),见表1。
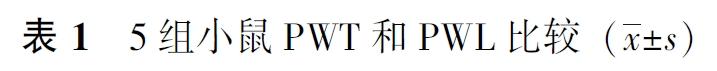

2.2 CCI及药物处理对小鼠旷场实验中运动总距离的影响
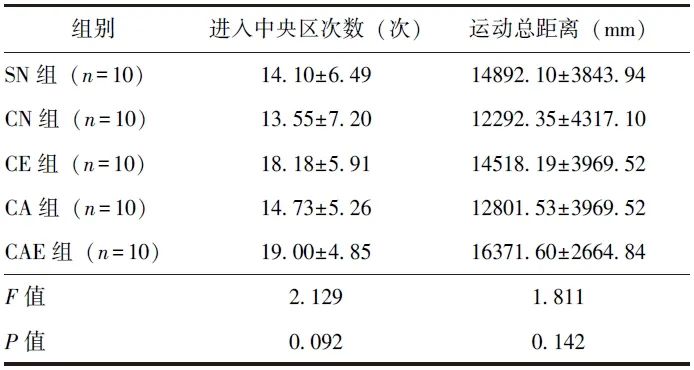
在旷场实验中,5组小鼠进入中心区域次数(P=0.092)及运动总距离(P=0.142)无统计学差异,说明造模及不同药物对小鼠的活动能力未产生影响,见表2。
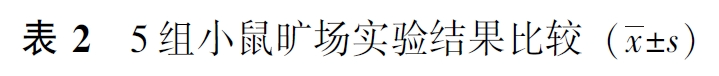
2.3 CCI及药物处理对小鼠工作记忆的影响
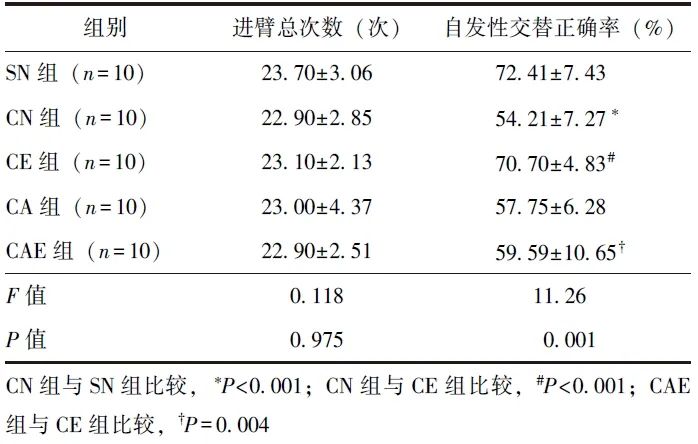
在Y迷宫实验中,与SN组相比,CN组自发性交替正确率明显降低(P<0.001),说明慢性疼痛会导致小鼠的工作记忆受损;与CN组相比,CE组自发性交替正确率明显升高(P<0.001),说明艾司氯胺酮改善了因疼痛导致的工作记忆损伤;与CE组相比,CAE组Y迷宫自发性交替正确率明显降低(P=0.004),说明ANA-12阻断了艾司氯胺酮的治疗作用,见表3。

2.4 CCI及药物处理对小鼠海马BDNF表达的影响
与SN组相比,CN组海马BDNF表达明显降低(P=0.021),与CN组相比,给予艾司氯胺酮治疗后的CE组海马BDNF表达上调(P=0.030),与CE组相比,当给予ANA-12拮抗TrkB受体后,CAE组海马BDNF表达下降(P=0.043),见图1。
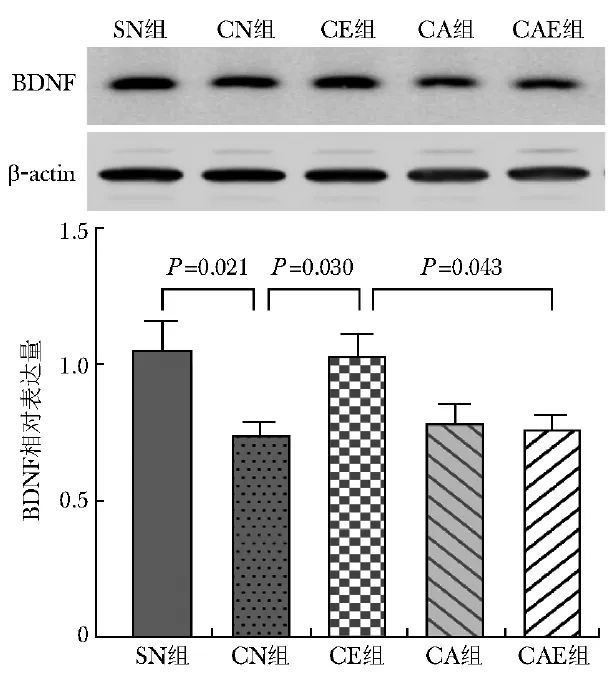
图1 5组小鼠海马BDNF相对表达水平(n=5)
A.BDNF及β-actin蛋白免疫印迹;B.BDNF相对表达量
2.5 CCI及药物处理对小鼠海马齿状回新生神经元发生的影响
与SN组相比,CN组海马齿状回BrdU+/DCX+细胞数明显降低(P=0.025),与CN组相比,CE组海马齿状回BrdU+/DCX+细胞数明显升高(P=0.003),与CE组相比,CAE组海马齿状回BrdU+/DCX+细胞数明显降低(P=0.014),见图2。

图2 5组小鼠BrdU+/DCX+在海马齿状回的表达水平(n=5)
A.免疫荧光检测(20×);B.BrdU+/DCX+细胞数目
3 讨论
本研究结果表明,艾司氯胺酮可明显改善神经病理性疼痛所致的小鼠工作记忆障碍、海马BDNF表达水平以及海马齿状回神经再生障碍,而给予TrkB拮抗剂ANA-12可明显阻断艾司氯胺酮上述作用,提示艾氯胺酮可能通过海马BDNF-TrkB通路改善神经损伤导致的小鼠海马齿状回神经再生障碍和工作记忆障碍。
艾司氯胺酮在国内目前主要用于临床麻醉[7]。既往有研究报道显示,消旋氯胺酮除具有抗抑郁作用外,对抑郁症患者的认知也有明显改善作用[8-9]。本研究发现,艾司氯胺酮可明显改善小鼠神经病理性疼痛所致的工作记忆障碍。Xia等[10]报道,连续5次给予小剂量消旋氯胺酮腹腔注射可明显改善慢性疼痛所致的记忆形成且与海马内BDNF的增加及神经再生密切相关,与本研究结果一致。
海马神经再生对记忆的形成、巩固、提取均至关重要[11]。既往研究发现,神经病理性疼痛会引起小鼠海马神经再生出现明显障碍,通过丰富环境促进神经再生可明显缓解神经病理性疼痛小鼠记忆障碍[12]。而BDNF-TrkB通路激活可促进海马齿状回神经再生[13],提示艾司氯胺酮可能通过BDNF-TrkB通路增加海马神经再生,从而改善神经病理性疼痛所致的工作记忆障碍。本研究发现,艾司氯胺酮可明显改善神经病理性疼痛小鼠海马神经再生功能,可能与艾司氯胺酮改善神经病理性疼痛小鼠工作记忆障碍密切相关。
BDNF-TrkB通路在神经系统中参与了多种生理和病理过程。抑制内源性BDNF-TrkB通路可能对动物行为产生广泛影响,比如学习和记忆[14-15]、情绪调节[16]、神经发育[17]、疼痛感知[18]和运动协调[19]等行为。
既往研究中,消旋氯胺酮和艾司氯胺酮均可通过BDNF-TrkB通路产生抗抑郁作用[20-21]。本研究发现,艾司氯胺酮可逆转神经病理性疼痛小鼠海马BDNF水平的降低,给予TrkB拮抗剂能够明显阻断艾司氯胺酮改善神经病理性疼痛所致的工作记忆障碍。ANA-12是一种已知的TrkB受体拮抗剂[22],调控TrkB受体的活性或表达可对BDNF的表达产生影响。TrkB受体激活后,其信号途径可能涉及多种信号分子和通路,如MAPK、PI3K/AKT等,这些通路可能与BDNF的合成、分泌或稳定性有关[23]。
此外,抑制TrkB受体活性可能介导一系列转录因子、核因子或调控因子的变化,直接或间接影响BDNF基因转录,导致BDNF mRNA水平变化[24]。总体而言,ANA-12作为TrkB受体拮抗剂,其对BDNF表达变化的机制可能涉及直接影响信号途径、基因转录、突触可塑性等多个方面,但具体机制仍需进一步的研究和实验加以验证。
综上所述,艾司氯胺酮可能通过海马BDNF-TrkB神经通路促进海马齿状回神经再生,进而改善小鼠神经病理性疼痛所致的工作记忆障碍。
参考文献
[1]Mazza S, Frot M, Rey A E. A comprehensive literature review of chronic pain and memory[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2018, 87(Pt B): 183-192.
[2]Miller E K, Lundqvist M, Bastos A M. Working memory 2.0[J]. Neuron, 2018, 100(2): 463-475.
[3]Berryman C, Stanton T R, Jane Bowering K, et al. Evid-ence for working memory deficits in chronic pain: a systematic review and meta-analysis[J]. Pain, 2013, 154(8): 1181-1196.
[4]Zhang G F, Zhou Z Q, Guo J, et al. Histone deacetylase 3 in hippocampus contributes to memory impairment after chronic constriction injury of sciatic nerve in mice[J]. Pain, 2021, 162(2): 382-395.
[5]Wei Y, Chang L J, Hashimoto K. Molecular mechanisms underlying the antidepressant actions of arketamine: beyond the NMDA receptor[J]. Mol Psychiatry, 2022, 27(1): 559-573.
[6]Wei Y, Chang L J, Hashimoto K. A historical review of antidepressant effects of ketamine and its enantiomers[J]. Pharmacol Biochem Behav, 2020, 190: 172870.
[7]Zhang C, He J Q, Shi Q Y, et al. Subanaesthetic dose of esketamine during induction delays anaesthesia recovery a randomized, double-blind clinical trial[J]. BMC Anesthesiol, 2022, 22(1): 138.
[8]Hashimoto K. Arketamine for cognitive impairment in psychiatric disorders[J]. Eur Arch Psychiatry Clin Neurosci, 2023, 273(7): 1513-1525.
[9]Zhang K, Yao Y T, Hashimoto K. Ketamine and its metabolites: potential as novel treatments for depression[J]. Neuropharmacology, 2023, 222: 109305.
[10]Xia S H, Hu S W, Ge D G, et al. Chronic pain impairs memory formation via disruption of neurogenesis mediated by mesohippocampal brain-derived neurotrophic factor signaling[J]. Biol Psychiatry, 2020, 88(8): 597-610.
[11]Wu A B, Zhang J Y. Neuroinflammation, memory, and depression: new approaches to hippocampal neurogenesis[J]. J Neuroinflammation, 2023, 20(1): 283.
[12]Wang X M, Zhang G F, Jia M, et al. Environmental enrichment improves pain sensitivity, depression-like phenotype, and memory deficit in mice with neuropathic pain: role of NPAS4[J]. Psychopharmacology (Berl), 2019, 236(7): 1999-2014.
[13]Hussain G, Akram R, Anwar H, et al. Adult neurogenesis: a real hope or a delusion?[J]. Neural Regen Res, 2024, 19(1): 6-15.
[14]Jaberi S, Fahnestock M. Mechanisms of the beneficial effects of exercise on brain-derived neurotrophic factor expression in Alzheimer's disease[J]. Biomolecules, 2023, 13(11): 1577.
[15]李亚南, 张琦, 于家旭, 等. BDNF/TrkB信号通路在预先注射青年大鼠血浆减轻七氟烷诱发老龄大鼠认知功能障碍中的作用[J]. 中华麻醉学杂志, 2022, 42(5): 546-550.
[16]Fabrazzo M, Cipolla S, Pisaturo M, et al. Bidirectional relationship between HIV/HBV infection and comorbid depres-sion and/or anxiety: a systematic review on shared biological mechanisms[J]. J Pers Med, 2023, 13(12): 1689.
[17]Pettorruso M, Miuli A, Clemente K, et al. Enhanced peripheral levels of BDNF and proBDNF: elucidating neurotrophin dynamics in cocaine use disorder[J/OL]. Mol Psychiatry. https://doi.org/10.1038/s41380-023-02367-7. doi: 10.1038/s41380-023-02367-7.
[18]Zhang S X, Chen Y R, Wang Y J, et al. Tau accumulation in the spinal cord contributes to chronic inflammatory pain by upregulation of IL-1β and BDNF[J/OL]. Neurosci Bull. https://doi.org/10.1007/s12264-023-01152-4. doi: 10.1007/s12264-023-01152-4.
[19]Cook A A, Leung T C S, Rice M, et al. Endosomal dysfunction contributes to cerebellar deficits in spinocerebellar ataxia type 6[J]. Elife, 2023, 12: RP90510.
[20]Borsellino P, Krider R I, Chea D, et al. Ketamine and the disinhibition hypothesis: neurotrophic factor-mediated treatment of depression[J]. Pharmaceuticals (Basel), 2023, 16(5): 742.
[21]Medeiros G C, Gould T D, Prueitt W L, et al. Blood-based biomarkers of antidepressant response to ketamine and esketamine: a systematic review and meta-analysis[J]. Mol Psychiatry, 2022, 27(9): 3658-3669.
[22]Zeng J S, Xie Z Q, Chen L, et al. Rosmarinic acid alleviate CORT-induced depressive-like behavior by promoting neurogenesis and regulating BDNF/TrkB/PI3K signaling axis[J]. Biomed Pharmacother, 2024, 170: 115994.
[23]Huang E J, Reichardt L F. Trk receptors: roles in neuronal signal transduction[J]. Annu Rev Biochem, 2003, 72: 609-642.
[24]Carvalho A L, Caldeira M V, Santos S D, et al. Role of the brain-derived neurotrophic factor at glutamatergic synapses[J]. Br J Pharmacol, 2008, 153(Suppl 1): S310-S324.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#神经病理性疼痛# #艾司氯胺酮#
11