最新进展:巴维妥昔单抗可减少新诊断胶质母细胞瘤患者的髓源性免疫抑制性细胞
2023-08-25 神外前沿 神外前沿 发表于上海
本研究为开放标签、单臂的Ⅱ期临床试验(NCT03139916),目的是评估巴维妥昔单抗与标准放化疗和TMZ辅助治疗对新诊断GBM的疗效。
【编译者按】胶质母细胞瘤(GBM)患者的预后仍旧较差,使用标准放化疗和辅助替莫唑胺(TMZ)治疗的患者中位总生存期(OS)小于15个月。其标准治疗包括在安全范围内进行最大程度的手术切除并进行基于替莫唑胺的放化疗。一旦肿瘤在标准治疗后发生进展,能够选择的治疗方式十分有限,针对复发胶质母细胞瘤的常用化疗药物包括替莫唑胺以及洛莫司汀。
磷脂酰丝氨酸(PS)具有高度免疫抑制性。PS是人体细胞膜系统中的主要酸性磷脂,是内质网、核膜、高尔基体、线粒体外膜和髓鞘的结构组成部分,PS同样位于正常细胞的质膜内叶,在 GBM 细胞和肿瘤微环境细胞(包括血管内皮细胞)中,PS外化至外叶,被免疫细胞上的PS受体识别并结合。这导致髓源性抑制细胞(MDSCs)和M2样肿瘤相关巨噬细胞(TAMs)的扩增,从而促进免疫抑制和促血管生成的肿瘤微环境。
在GBM异种移植模型中以PS为靶点可导致肿瘤细胞死亡。一方面,靶向PS具有抗血管生成作用。此外,PS靶向药物可将肿瘤微环境重编程为免疫激活状态,包括降低MDSCs的浸润、降低TGF-β和白细胞介素-10(IL-10)水平,提高 TNF-α和IL-12水平,将TAMs从M2表型重新极化为M1表型,以及诱导有效的适应性抗肿瘤T细胞免疫。在临床前模型中,PS靶向药物和TMZ以及放疗的联合使用已对于胶质瘤的治疗起到优良的效果,在现有研究中,PS靶向药物包括纳米粒子SapC-DOPS等[1; 2]。
巴维妥昔单抗(Bavituximab)是靶向PS的药物,通过逆转 PS 的免疫抑制作用在体外和体内的实验中均可以减少肿瘤生长,延长生存期,联合化疗和放疗使用有协同作用。
本研究为开放标签、单臂的Ⅱ期临床试验(NCT03139916),目的是评估巴维妥昔单抗与标准放化疗和TMZ辅助治疗对新诊断GBM的疗效。实验者通过序列灌注MRI和测量骨髓相关基因转录和髓细胞浸润来评估靶点特异性影响,以更好地了解巴维妥昔单抗在GBM中的作用机制。这项Ⅱ期试验最终结果首次证明了巴维妥昔单抗具有靶向效应,并减少了瘤内MDSCs浸润。但仍需要进一步研究以确定最有可能从巴维妥昔单抗和联合疗法中获益的患者,并在GBM中和免疫检查点抑制剂或其他免疫激活方法(如疫苗或嵌合抗原受体T细胞疗法)合用,以最大限度地提高瘤内免疫反应。
研究方法
患者入选标准
新诊断的组织学确诊的 GBM 或 GBM 变异型(如胶质肉瘤);IDH野生型;年龄≥18 岁;既往未接受过免疫疗法、烷化剂或其他药物治疗;KPS≥60;预期寿命大于6个月;具有良好的骨髓、肾和肝功能;能够接受磁共振检查;开始治疗时地塞米松或其他皮质类固醇剂量小于每天4毫克(或等效的其他皮质类固醇);基线时根据RANO标准患有不可测量和可测量疾病的患者均符合纳入条件。
治疗方案
患者在6周内接受同步放射治疗(累积60 Gy,单次剂量不超过2 Gy)和TMZ治疗(每天75 mg/m2),间隔4周后接受6个周期的TMZ辅助治疗(C1~6,每个周期前5天每天用药150-200 mg/m2);巴维妥昔单抗每周静脉注射3 mg/kg,从同步放化疗第一周开始给药,持续至少18周(至TMZ辅助治疗第2周期结束),如果耐受,可选择继续给药。必要时,参试者会预先静脉注射氢化可的松250mg和苯海拉明50mg。为了确定同时进行的类固醇治疗(包括氢化可的松预处理)是否会干扰反应,在使用巴维妥昔单抗治疗期间按类固醇剂量将患者分组(第1组:低剂量或无类固醇;第2组:高剂量类固醇。)
应答评估
首要终点:存活 12 个月的患者比例(OS-12)
次要终点:无进展生存期(PFS)、总生存期(OS)、放射学反应和巴维妥昔单抗毒性。
试验结果
患者特点
2017年7月至2018年7月间入组36名IDH-wt nGBM患者,33名患者可接受评估;患者中位年龄为59 岁,中位KPS为90;58%的肿瘤患者MGMT启动子未甲基化。
15名患者(45.5%)在治疗开始时和治疗期间不需要地塞米松;10名患者(30.3%)需要小剂量或不需要类固醇;23名患者(69.7%)在治疗期间需要大剂量类固醇。6名患者(18.2%)进行了组织活检;12名患者(36.4%)进行了次全切除,15名患者(45.5%)进行了全切除或接近全切除。
临床与影像学结果
存活 12 个月的患者比例(OS-12)为 72.7%,达到了研究的主要终点。截至2021年5月,中位PFS和中位OS分别为6.9个月(6.2 - 9.7)和15.4个月(13.3-23.6)。30例(90.1%)患者出现病情进展,3名未出现疾病进展的患者中,1人死于吸入性肺炎,1人仍在接受治疗,1人失访。甲基化MGMT状态与 PFS(p=0.003)和 OS(p=0.002)的改善有关,但年龄和类固醇的使用与之无关。
安全性
巴维妥昔单抗用药剂量的中位数为24次(5-85次)。28名患者(84.8%)的不良事件(AE)与巴维妥昔单抗有关。包括四例3级或4级AE,无5级AE出现。
生理成像分析
单变量分析显示,基线CE容积、FLAIR容积、泛血管和微血管rCBV、泛血管rCBF和CE区域内的Ktrans与OS相关。高基线泛血管rCBV和CE区域内的Ktrans高可预测较差的PFS。在C1前的时间点,分析了成像标记物与基线相比的差异倍数。泛血管rCBF的差异倍数中位数为 0.76。与差异倍数<0.76的患者相比,差异倍数≥0.76的患者死亡风险高出三倍。Ktrans的差异倍数中位数为1.34,与差异倍数<1.34的患者相比,差异倍数≥1.34的患者的死亡风险降低了83%。
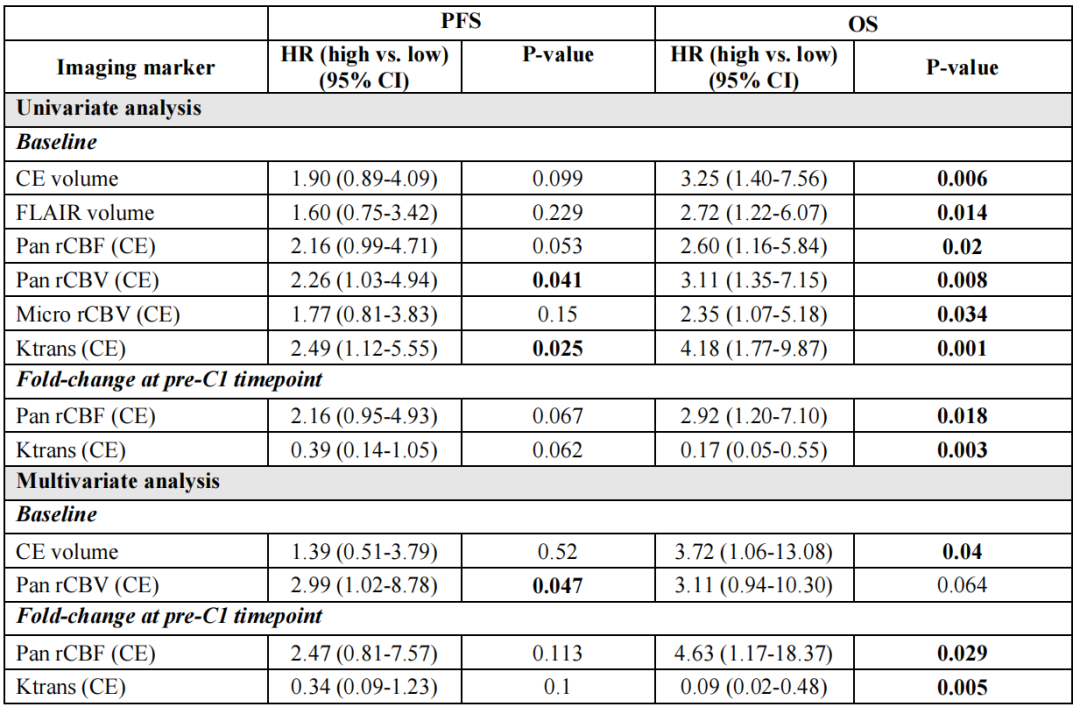
表1 基线和c1前时间点的肿瘤成像生物标志物与PFS和OS之间的相关性
除FLAIR体积外,所有成像标记物均来自对比增强(CE)感兴趣区域(ROI)
Pan:全血管;Micro:微血管
GBM组织和外周血中髓系相关RNA转录本的分析
单核细胞:对肿瘤标本和外周血单核细胞(PBMCs)进行基因表达谱分析。基线肿瘤样本(n=10)分析提示,较长生存期与髓系基因转录活跃有关,涉及炎症反应、细胞因子信号转导和白细胞活化。基线PBMCs样本(n=26)分析提示,髓系基因高转录与预后没有显著相关性。此外,通过对比分析新诊断肿瘤标本(n=10)与复发肿瘤标本(n=7),发现67个髓系相关基因表达发生改变,差异表达基因的元图谱聚类富集分析显示,最常见的上调和下调功能网络包括 IL-4、IL-10 和IL-13的表达变化,都与MDSC的成熟和信号传导有关。
多重免疫荧光:对比确诊时和进展期肿瘤组织中TAMs表型。发现肿瘤组织中的TAMs密度或M2/M1比率没有差异。然而巴维妥昔单抗治疗后,肿瘤组织中的MDSCs比诊断时有所减少。
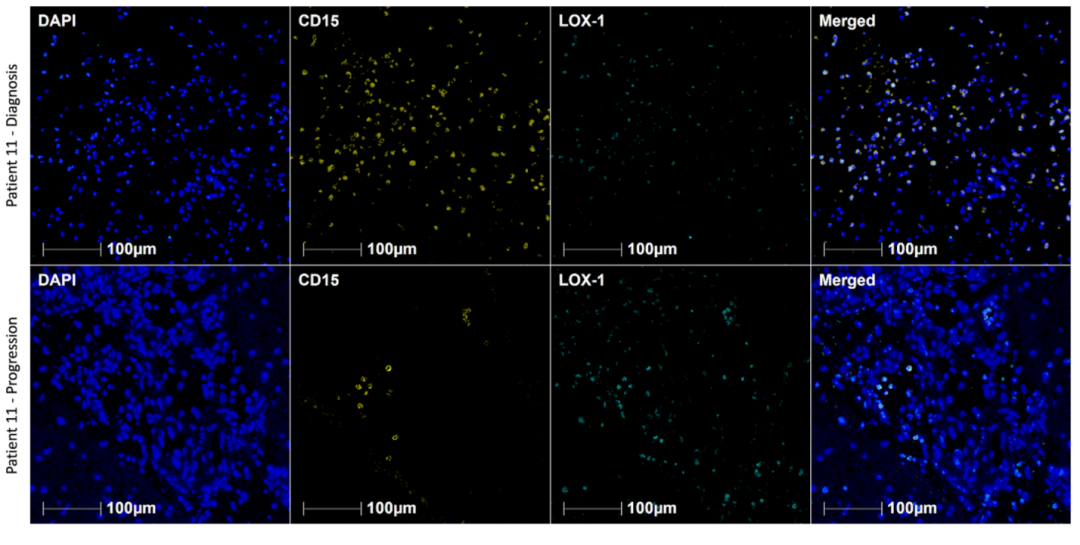
图1. 巴维妥昔单抗治疗前后肿瘤微环境中浸润性MDSCs的免疫荧光检测。
在巴维妥昔单抗治疗前(上)和巴维妥昔单抗治疗后(底部)配对肿瘤样本中浸润MDSCs的代表性免疫荧光图像。标本用抗DAPI、CD15和LOX-1的抗体进行标记
讨论
本研究评估了巴维妥昔单抗与标准放化疗和TMZ辅助治疗对33例IDH野生型nGBM患者的疗效,研究达到了主要终点,OS-12为72.7%。然而,在合并甲基化和未甲基化的GBM患者中,中位PF(6.9 个月)和OS(15.4 个月)与标准治疗相当。巴维妥昔单抗耐受性良好,无严重不良反应。
本研究首次使用灌注磁共振成像和免疫相关基因及相关免疫细胞亚群的表达,直接、前瞻性地探测肿瘤微环境并评估巴维妥昔单抗的靶向效应。基线升高和间期增加或泛血管rCBF稳定与生存率下降有关,这与之前的nGBM研究一致[3; 4]。在动物模型中,巴维妥昔单抗导致TAMs 从免疫抑制的M2表型重编程为免疫活性的M1表型,并减少了MDSCs。实验者发现肿瘤标本中的MDSC数量在病情进展时有所减少,这证实了巴维妥昔单抗的靶向瘤内效应,以及在调节GBM免疫微环境方面的作用。
本研究的局限性在于:单臂设计无法评估巴维妥昔单抗和标准疗法对免疫细胞调节的不同影响,只有21%的患者在病情进展时获得了肿瘤标本,因此可能无法准确反映治疗期间的肿瘤微环境。然而,GBM的进展通常与MDSCs数量增加有关,因此,进展期MDSCs减少可能反映了靶向治疗效果,而肿瘤进展可能是由于分子和/或免疫逃逸所致。巴维妥昔单抗通常会抑制 IL-10 的表达,因此进展期IL-10上调表明存在免疫逃逸过程。
总之,这项临床Ⅱ期试验首次证明了巴维妥昔单抗的靶向效应以及与瘤内MDSCs的减少的关系,治疗前肿瘤组织中髓系转录物的表达量增加与PFS和OS相关。在GBM的研究中,下一步研究方向可能为将巴维妥昔单抗与免疫检查点抑制或其他免疫激活方法相结合,以最大限度地提高瘤内免疫反应。
参考文献
[1] J. Wojton, W.H. Meisen, N.K. Jacob, A.H. Thorne, J. Hardcastle, N. Denton, Z. Chu, N. Dmitrieva, R. Marsh, E.G. Van Meir, C.H. Kwon, A. Chakravarti, X. Qi, and B. Kaur, SapC-DOPS-induced lysosomal cell death synergizes with TMZ in glioblastoma. Oncotarget 5 (2014) 9703-9.
[2] N. Hussain, H. Davis, S. Vallabhapurapu, Z. Chu, V. Blanco, and X. Qi, Atps-35radiation Treatment Increases Phosphatidylserine Externalization on Glioblastoma Cells – Indicates Potential Target for Therapy. Neuro-Oncology 17 (2015) v25.4-v26.
[3] K.I. Ly, B. Vakulenko-Lagun, K.E. Emblem, Y. Ou, X. Da, R.A. Betensky, J. Kalpathy-Cramer, D.G. Duda, R.K. Jain, A.S. Chi, S.R. Plotkin, T.T. Batchelor, G. Sorensen, B.R. Rosen, and E.R. Gerstner, Publisher Correction: Probing tumor microenvironment in patients with newly diagnosed glioblastoma during chemoradiation and adjuvant temozolomide with functional MRI. Sci Rep 9 (2019) 8721.
[4] E.R. Gerstner, Z. Zhang, J.R. Fink, M. Muzi, L. Hanna, E. Greco, M. Prah, K.M. Schmainda, A. Mintz, L. Kostakoglu, E.A. Eikman, B.M. Ellingson, E.M. Ratai, A.G. Sorensen, D.P. Barboriak, and D.A. Mankoff, ACRIN 6684: Assessment of Tumor Hypoxia in Newly Diagnosed Glioblastoma Using 18F-FMISO PET and MRI. Clin Cancer Res 22 (2016) 5079-5086.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言