张文宏教授:慢乙肝治愈的未来-理论将成为现实
2024-11-08 肝癌在线 肝癌在线 发表于上海
近期,国家传染病医学中心主任、复旦大学附属华山医院感染科主任张文宏教授做《乙肝功能性治愈:从概念到落地还有多远?》学术授课,肝胆相照平台特将精彩内容整理成文,以飨读者。
随着慢乙肝治疗领域药物研发不断取得进展,临床治愈已成为可能。近期,国家传染病医学中心主任、复旦大学附属华山医院感染科主任张文宏教授做《乙肝功能性治愈:从概念到落地还有多远?》学术授课,肝胆相照平台特将精彩内容整理成文,以飨读者。
一 功能性治愈定义的确定
• 定义:目前的CHB治疗目标是实现功能性治愈,即在停止治疗后24周内持续的HBsAg与HBV DNA低于检测下限,无论是否伴有抗HBs血清转换。
• 机制:CHB患者对抗病毒治疗的应答受多种因素影响,包括免疫学、病毒学和遗传学因素。
乙肝免疫活动期和急性恢复期的患者肝内有大量衰竭的CD8+T细胞。与免疫耐受发生机制相关的免疫学因素还包括髓源性抑制细胞(MDSCs)的频率、基线特异性B细胞水平等,都是治疗应答的重要预测因素。
▼ 慢乙肝的治愈仍是亟待解决的问题,其主要障碍是:
1、HBV复制周期复杂,匿于细胞核内的cccDNA持续存在且不断被补充、整合在干细胞基因组的HBV DNA基因也持续产生HBsAg。
2、慢性HBV感染诱导的HBV特异性T细胞和B细胞的耗竭(与持续抗原暴露和抑制性受体表达等机制相关)。
二 探索乙肝病毒储存库的研究
国家传染病医学中心、复旦大学华山医院前期发表在 Journal of Hepatology 的原创性研究诠释了HBV-RNA的来源和意义,血清HBV-RNA不仅与肝内HBV-RNA密切相关,且与肝内HBV-RNA与HBV cccDNA的比值也显著相关。
血清HBV-RNA和肝内HBV-RNA具有同源性,且在ETV治疗过程中即使血清HBV-DNA低于检测下限,血清HBV-RNA仍处于波动中[1]。
因此,乙肝病毒基因组的转录水平与在肝脏内的分布可能是慢乙肝获得功能性治愈前期的重要标志物,血清HBV-RNA与肝组织METAVIR病理得分(Grading和Staging)有相关性;通过原位杂交的方法观察到HBV-RNA阳性细胞“呈簇状”分布且与HBsAg在空间位置上较一致。
通过对乙肝复制转录中间体的HBV RNA进行持续的观察,发现治疗早期该指标的变化与疾病的最终结局有关。近期南方医科大学南方医院孙剑教授团队发表题为“Role of early on-treatment serum HBV RNA declines in predicting hepatocellular carcinoma risk in patients with chronic hepatitis B”的研究论文。
研究表明,治疗前两年的血清HBV RNA下降幅度与慢乙肝患者最终肝癌发生风险相关[2]。同时,一些前瞻性与回顾性的队列也显示,进行抗病毒治疗的患者中,获得HBsAg消失者,也就是达到功能性治愈的患者最终发生肝癌与肝硬化的风险显著降低,因此对患者进行功能性治愈具有重要的潜在临床价值。
三 干扰素治疗在功能性治愈中的地位
本团队近期发表在 Journal of Hepatology 的一篇RCT研究发现停用核苷酸类似物(NUC)并改用PegIFN α-2a治疗48周可以显著降低病毒学复发率,并提高HBsAg消失率[3](图1)。
• 背景:核苷酸类似物(NUC)可导致乙型肝炎表面抗原(HBsAg)清除,但停用也可引发高病毒学复发率。然而,PegIFN α-2a 对NUC停用后的病毒学复发影响未知。本研究旨在评估非活动期HBeAg阴性的慢性乙型肝炎患者从NUC转换为PegIFN α-2a治疗48周,直至第96周对病毒学复发的影响。
• 方法:这是一项由研究者发起的前瞻性、开放标签、随机对照、多中心临床试验(NCT02594293)。最终纳入分析180例非硬化性HBeAg-阴性慢性乙型肝炎患者,接受至少2.5年的连续NUC治疗。HBV DNA水平小于60 IU/ml。随机分为停用NUC组(n=90)或接受48周PegIFN α-2a治疗组(n=90),并随访至96周(图1)。主要终点是第96周的病毒性复发率。
• 结果:意向性治疗分析显示:与NUC停用组相比,干扰素单治疗组在第96周的累计病毒学复发率显著降低(20.8% vs 53.6%,P < 0.0001)。同样,在第48周停药时,干扰素单治疗组的病毒学复发率显著低于NUC停用组(17.8% vs 36.7%,P=0.007)。NUC停用组中,病毒学复发率与HBsAg水平正相关。与NUC停用组相比,干扰素单治疗组具有较低的累计临床复发率(7.8% vs 20.9%,P=0.008)和更高的HBsAg消失率(21.5% vs 9.0%,P=0.03)。但是所有获得HBsAg消失的患者的基线HBsAg均在1500IU/ml以下。
干扰素治疗证明了慢性乙肝功能性治愈的可能性,确定了功能性治愈的概念。但是仅仅通过干扰素治疗获得功能性治愈的患者比例还是有限的,仍需要更多的功能性治愈新药的加入,才能扩大功能性治愈患者的比例。
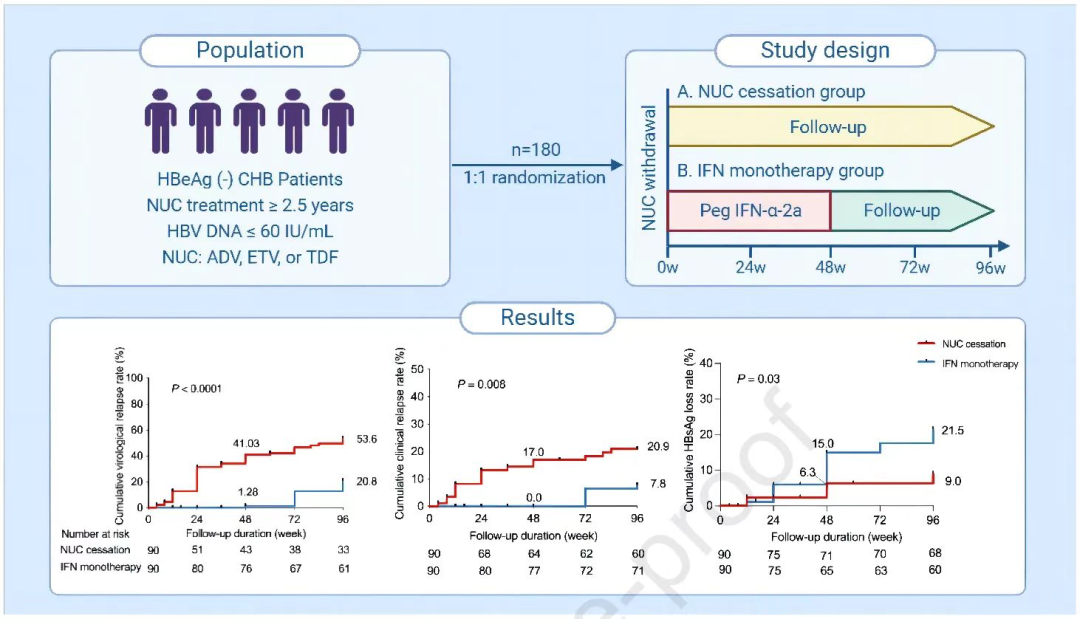
图1
四 可能最快进入临床的功能性治愈药物
国际上在功能性治愈的小分子新型药物序列中,ASO-Bepirovirsen目前处于临床研究的前沿。ASO-Bepirovirsen的使用呈现出与HBsAg下降的显著量效关系。
香港大学袁孟峰团队在 New England Journal of Medicine 杂志发表题为“Efficacy and Safety of Bepirovirsen in Chronic Hepatitis B Infection”的研究论文,研究表明每周300 mg剂量的bepirovirsen,持续24周,能够导致9%-10%的慢性HBV感染参与者出现持续的HBsAg和HBV DNA消失[4](图2)。
但是仅仅通过ASO-Bepirovirsen治疗获得功能性治愈的患者比例还是有限的,仍需要更多的功能性治愈新药的加入,才能扩大功能性治愈患者的比例。
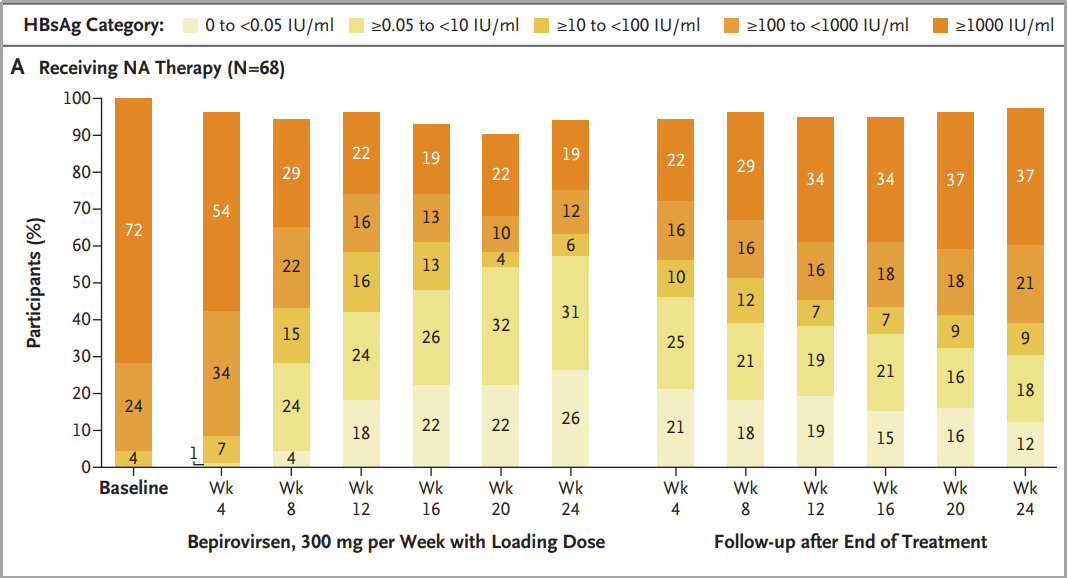
图2
五 未来十年慢乙肝治疗的策略图
常见的免疫调节剂作用位置和机制(图3):
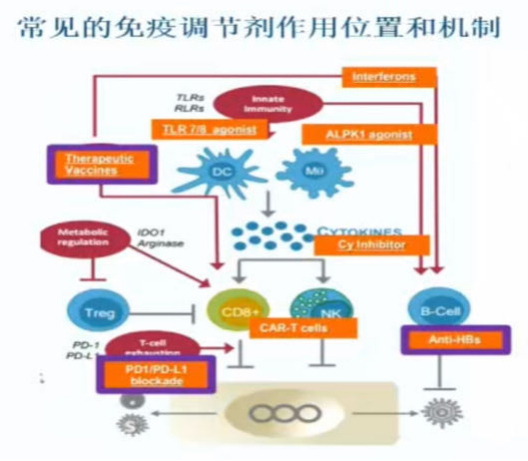
图3
(1) 干扰素:直接抗病毒和免疫调节的双重作用。
(2) 治疗性疫苗:激活人体特异性免疫NASVAC,FNX008,GS-4774,Hep Tcell。
(3) 单克隆抗体:中和病毒颗粒、刺激T细胞等VIR-3434,GC1102,RG6449。
(4) TLR激动剂:激活先天免疫系统GS9688,RG7854,TQA3334…
(5) T细胞治疗:外源性T细胞回输IMC-1109,ALVR107,SCG101…
(6) 免疫检查点抑制剂:调节T细胞耗竭ASC22,RG6084…
1、PD-1/PD-L1抑制剂——改善免疫耗竭
通过重建HBV特异性T细胞反应发挥作用,目前数据安全性良好,有显著的HBsAg下降,口服制剂(AB-101)也进入临床试验。
2、TLR7激动剂——激活宿主天然免疫
TLR7激动剂对表面抗原下降好,但易激活NF-KB,诱发全身炎症,是前期研究失败的主要原因。PRTX007是PRX034的口服原药,是一种基于核苷的TLR7激动剂,1期、单中心、前瞻性、随机、双盲、安慰剂对照研究;先天性免疫反应和适应性免疫反应被激活,但全身性促炎因子并未增加。
3、功能性治愈的新策略和新趋势——不同机制的免疫调节剂与直接抗病毒药物的联合用药
目前,NAs长期治疗的安全性已被证实,且价格较低,已成为基础用药。因此,下一个时代的新策略是通过不同机制的免疫调节剂与直接抗病毒药物的联合用药来追求临床治愈(图4)。
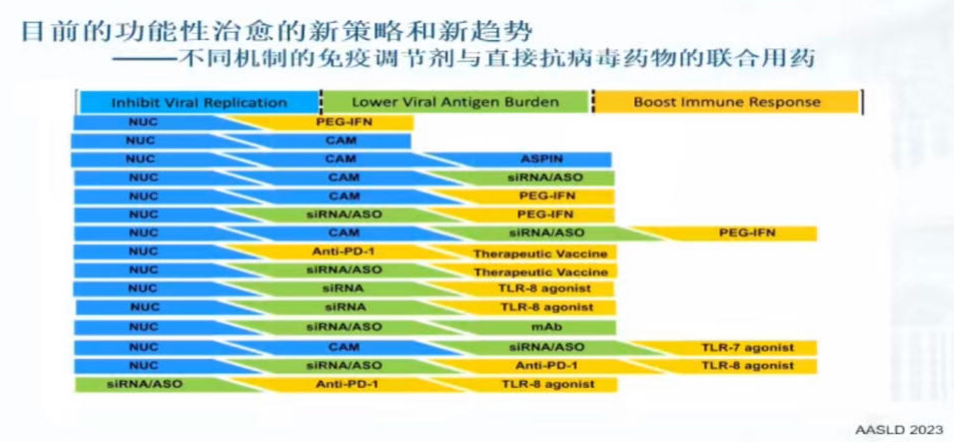
图4
4、同类药物的迭代成为常态
siRNA类药物+免疫调节剂——更高的HBsAg转阴率。
Xalnesiran是一种siRNA类药物;正在开展的一项2期平台型研究主要探究其联合Nuc(1组和2组),使用或不使用免疫调节剂(聚乙二醇干扰素,3组)或Ruzotolimod(一种TLRs 7激动剂,4组),AASLD 2023上公布的初步数据可看到,在治疗结束后24周,3组和4组,即联合免疫调节治疗的组别,有明显更高的HBsAg转阴率。
5、干扰素成为伴侣药物?RNAi±免疫调节剂
VIR-2218是一种siRNA,联合PegIFN的组别显著提高了HBsAg下降幅度。研究表明其联合免疫调节剂PEG IFNα治疗的II期研究数据显示,联合治疗时间越长,HBsAg水平越低;其中队列5(VIR-2218 × ≤ 13 + PEG IFNα × ≤ 44)在治疗结束时的HBsAg清除率可达30.8%。
6、干扰素未来应用场景
Sequential Peg-IFN after bepirovirsen may reduce post-treatment relapse in chronic hepatitis B[5],该研究表明,在接受稳定核苷类似物(NA)治疗的慢性HBV感染患者中,Bepirovirsen联合聚乙二醇干扰素的序贯治疗是可耐受且有效的(图5)。
这些研究的结果仍不足以使乙肝功能性治愈比例显著提高,显示在未来仍有更为广阔的功能性治愈药物联合治疗研究空间。
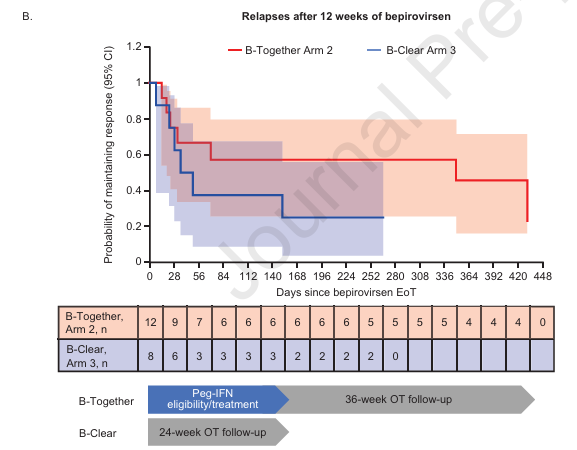
图5
7、免疫引导性治疗:治疗性疫苗——激活靶向性的T细胞免疫
针对慢性乙型肝炎的治疗性疫苗,在人和乙肝小鼠模型中评估了其抗病毒效果;结果显示该疫苗在免疫两针的情况下能够激起体内强烈的抗原特异性T细胞免疫反应并诱导肝内淋巴细胞聚积,至观察期结束时,60%小鼠实现HBsAg阴转或血清学转换,肝组织免疫组化和原位杂交显示HBV阳性肝细胞数显著减少,表现出较高的临床治疗潜力。
8、治疗性疫苗+PD-1抑制剂——持续显著的HBsAg下降
VTP-300是在研的治疗性疫苗,由黑猩猩腺病毒(ChAdOx1)初免和改良的安卡拉牛痘病毒(MVA)加强所组成。一项2b期、开放标签的研究,评估VTP-300联合低剂量纳武单抗(PD-1抑制剂)治疗CHB患者的安全性、有效性、免疫原性。
初步数据表明,VTP-300联合低剂量纳武单抗可使CHB患者获得有意义和持续的HBsAg下降,且在筛查HBsAg水平≤200 IU/ml的患者中,HBsAg的降低尤为显著。在第2组(ChAdOx1,初免后,使用2剂MVA-HBV强化+PD-1抑制剂)中观察到HBsAg平均降低幅度更大。
9、从功能性治愈迈向治愈:cccDNA降解、沉默和清除。
系列新药,包括Zinc-finger Nucleases(ZFNs)等核酶类药物,或者基因编辑技术,有望通过阻断cccDNA转录,抑制病毒的转录和复制。如CRISPR/Cas在Huh-7细胞模型中,可降低HBsAg和HBcAg,破坏HBV表达模板。Transcription activator-like effector nucleases(TALENs)则靶定S或C区的ORF,可导致35% cccDNA发生突变;通过靶定保守区可降低HBeAg、HBsAg、HBcAg和前基因组RNA产生,从而降低cccDNA的水平。二代磺胺类药物(CCC-0975、CCC-0346)也显示出有抑制HBV cccDNA的功能(图6)。
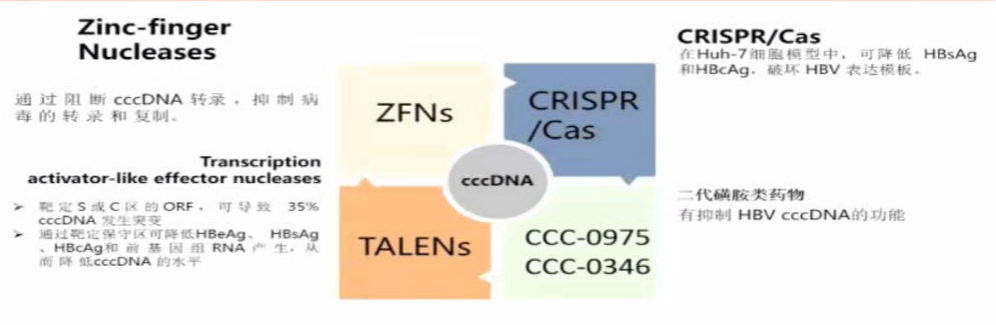
图6
六 结语:慢乙肝治愈的未来:理论将成为现实
慢乙肝的治愈是一个连续的过程,因此在此过程中明确“部分治愈”的指标较为困难。而最终获得HBsAg清除是广泛认可的“临床治愈”指标。获得HBsAg清除表明HBV的转录水平和翻译水平均被有效抑制,T细胞通过持续的免疫监视和免疫控制来保持功能性治愈的稳定性。
【参考文献】
[1] Wang J, Yu Y, Li G, et al. Relationship between serum HBV-RNA levels and intrahepatic viral as well as histologic activity markers in entecavir-treated patients [J]. J Hepatol, 2017.
[2] Liu S, Wong G L, Fan R, et al. Role of Early On-Treatment Serum HBV RNA Declines in Predicting Hepatocellular Carcinoma Risk in Patients With Chronic Hepatitis B [J]. Clin Gastroenterol Hepatol, 2024.
[3] Li F, Qu L, Liu Y, et al. PegIFN alpha-2a reduces relapse in HBeAg-negative patients after nucleo(s)tide analogue cessation: A randomized-controlled trial [J]. J Hepatol, 2024.
[4] Yuen M F, Lim S G, Plesniak R, et al. Efficacy and Safety of Bepirovirsen in Chronic Hepatitis B Infection [J]. N Engl J Med, 2022, 387(21): 1957-68.
[5] Buti M, Heo J, Tanaka Y, et al. Sequential Peg-IFN after bepirovirsen may reduce post-treatment relapse in chronic hepatitis B [J]. J Hepatol, 2024.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











血清HBV-RNA不仅与肝内HBV-RNA密切相关,且与肝内HBV-RNA与HBV cccDNA的比值也显著相关。
7
乙肝患者的福音
7
#HBV# #慢乙肝#
17