南京邮电大学晁洁教授团队JACS:智能模块化DNA LYTACs纳米装置用于肿瘤精准治疗
2024-10-29 BioMed科技 BioMed科技 发表于上海
南京邮电大学晁洁团队开发智能模块化 DNA LYTACs 纳米器件,可在肿瘤微酸环境降解致病蛋白,实现 EGFR 和 PDL1 协同降解用于肿瘤治疗,为创新疗法提供新思路。
蛋白质降解与肿瘤治疗
蛋白质降解是一种利用被称为蛋白质降解剂的肿瘤治疗策略。目前通过蛋白酶体或溶酶体系统选择性地靶向降解特定蛋白,在肿瘤治疗中具有明显的优势。溶酶体靶向嵌合体(LYTACs)作为一种通过劫持溶酶体转运受体(LTRs)来降解细胞外靶蛋白的策略,已成为消除传统上不可药的肿瘤相关致病蛋白的一种强有力的方式。然而,其低生物利用度和非特异性分布严重限制了肿瘤治疗的效果。随着“事件驱动”药物模型的推进,优化降解模式,开发一种能够选择性靶向肿瘤组织并实现模块化设计的LYTACs系统势在必行,这将有利于扩宽治疗窗口,促进肿瘤精准治疗的发展。
为了实现这一目标,南京邮电大学晁洁教授团队报告了一种可编码DNA纳米平台,利用智能模块化DNA LYTACs(IMTACs)纳米器件,在肿瘤微酸环境中特异性降解多种致病蛋白。DNA环状折纸具有高稳定性、低免疫原性和可编程性,及近端排布等优点,解决了对不同配体的精准排布的需求,是IMTACs的理想纳米载体。通过精确控制LTRs和蛋白配体的化学计量学和模块化分布,IMTACs纳米器件能够精确定位和递送到肿瘤组织中,在肿瘤组织中,酸性肿瘤微环境触发激活降解开关,IMTACs多价结合,并有效降解各种预先指定的蛋白质。IMTACs的组织特异性和多价配体显著提高了药物利用率,同时减少了脱靶效应。重要的是,该系统显示了肿瘤组织中EGFR和PDL1协同降解的能力,可用于肝细胞癌(HCC)的联合靶向和免疫治疗。此外,DNA折纸纳米结构可以结合不同类型的靶配体(适体、RNA、肽、抗体等),从而促进了新靶蛋白降解机器的灵活设计。该研究扩大了靶向蛋白降解的范围,并为发现各种疾病的创新疗法提供了新的思路。相关工作以“Intelligent Modular DNA Lysosome-Targeting Chimera Nanodevice for Precision Tumor Therapy”为题发表在JACS。

【文章要点】
为了提高LYTACs系统的肿瘤靶向能力,研究团队将pH敏感的DNA基序插入IGFIIR适体序列中,设计了一个具有pH选择性结合特性的分子开关(在肿瘤环境中,pH=∼6.5-7.0),称为pH响应蛋白降解启动子。基于DNA折纸的可编程性和修饰性,作者精确地设计了不同的DNA纳米环状载体,以实现对不同pH响应蛋白降解启动子和配体的化学计量学和模块化的精确调控。为了验证本研究中所描述的IMTACs纳米器件对EGFR蛋白降解能力,作者通过流式细胞术和免疫荧光分析和蛋白印迹分析等实验验证EGFR IMTACs能够在微酸性环境中多价结合,并有效降解HepG2细胞膜上的EGFR蛋白(图1)。
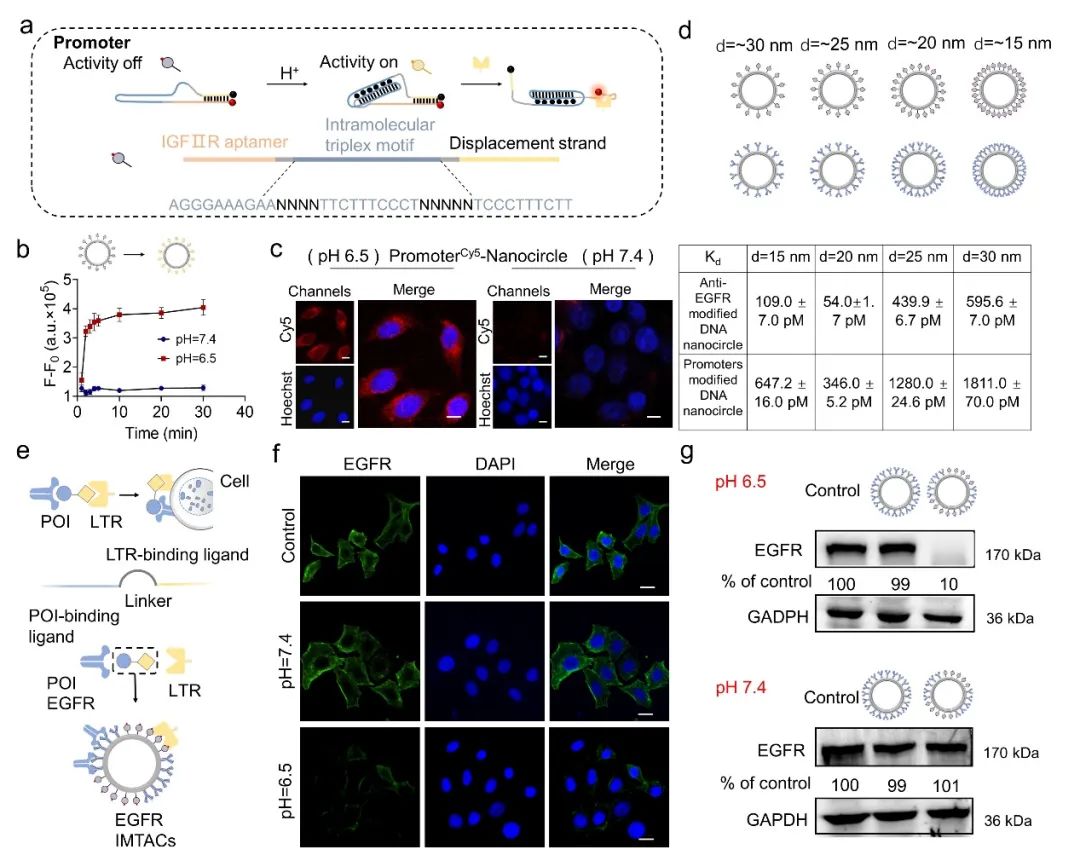
图1 pH响应DNA启动子的设计及IMTACs纳米装置的EGFR蛋白质降解能力验证
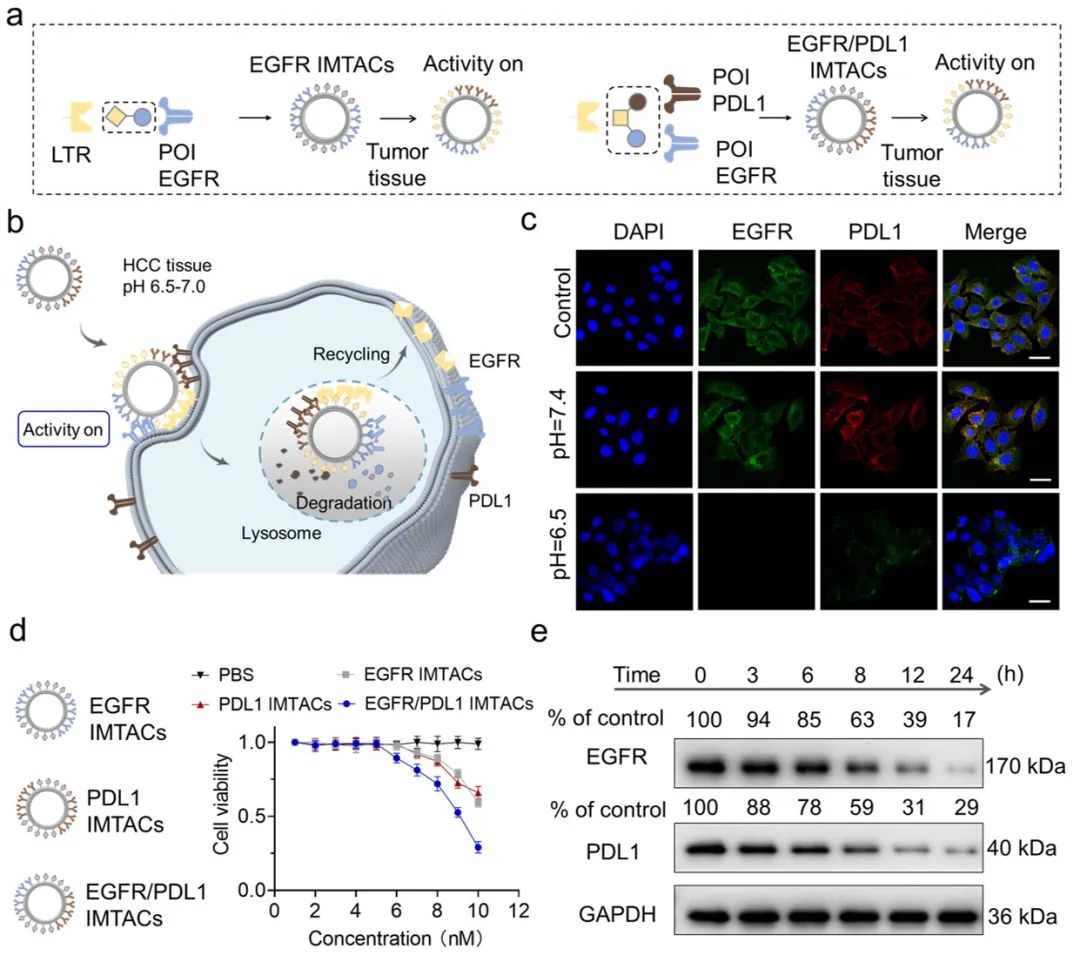
图2 EGFR/PDL1 IMTACs的设计及其对EGFR/PDL1蛋白的协同降解
为了进一步验证本研究中所描述的IMTACs纳米器件对EGFR/PDL1蛋白的协同降解能力,作者通过流式细胞术和免疫荧光分析和蛋白印迹分析等实验验证EGFR/PDL1 IMTACs能够在微酸性环境中同时降解HepG2细胞膜上的EGFR/PDL1蛋白,并且产生了显著的细胞凋亡效果(图2)。接着,作者利用HepG2细胞接种的小鼠模型进行生物分布评估和疗效验证(图3)。结果表明,EGFR/PDL1 IMTACs能够显著抑制肿瘤生长,并在低浓度下具有较强的抗肿瘤生长能力。EGFR/PDL1 IMTACs组显示出80%的肿瘤抑制率,显著高于EGFR IMTACs组(55%)或PDL1 IMTACs组(52%)。此外,使用Western blot和免疫组织化学实验对肿瘤组织进行分析。分析结果显示,EGFR/PDL1 IMTACs显著降低EGFR和PDL1水平,从而证明了有效的体内蛋白质降解。并且,作者进一步验证了IMTACs对主要器官无明显毒性作用,具有良好的生物安全性。
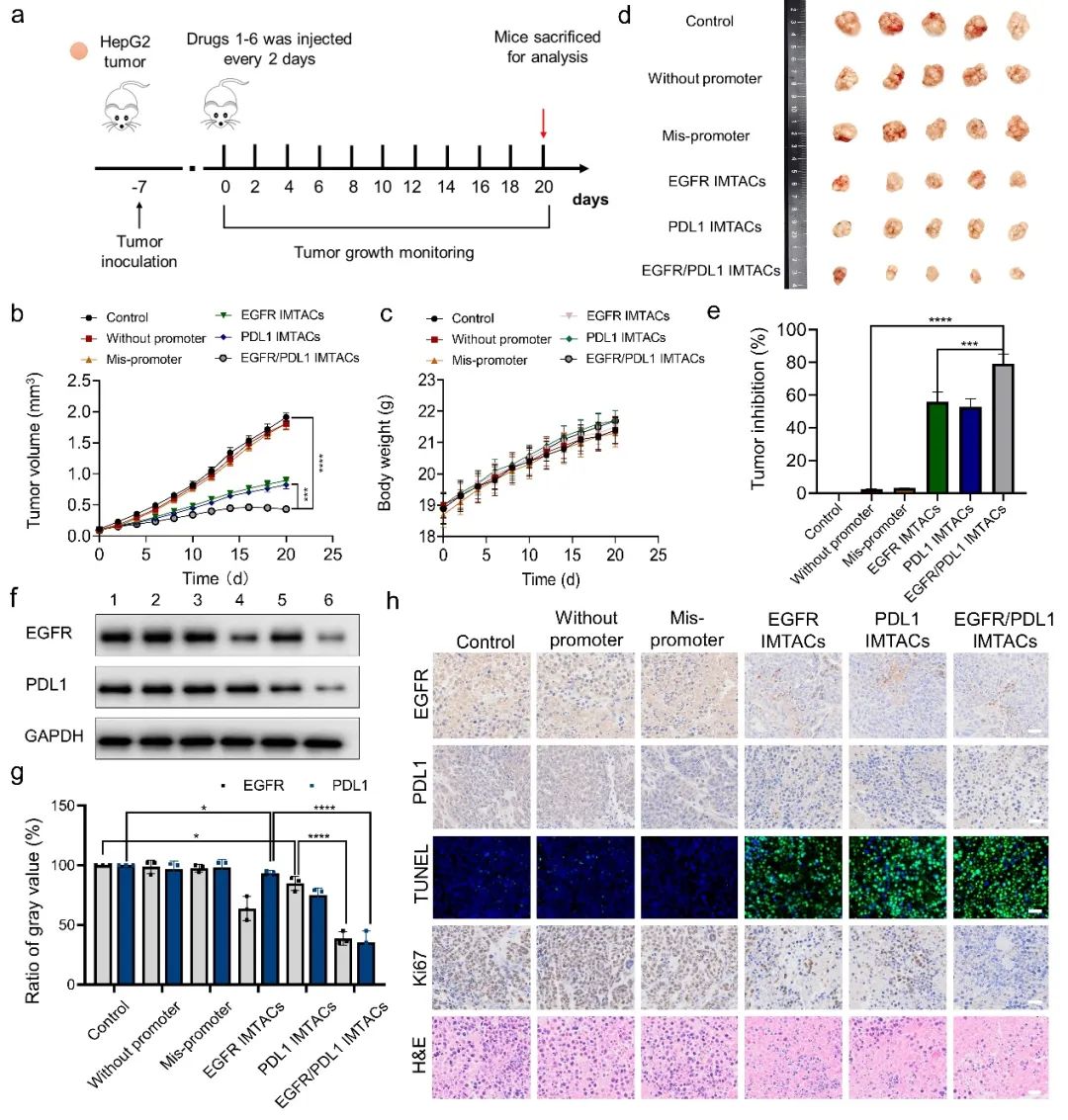
图3 EGFR/PDL1 IMTACs对HepG2荷瘤小鼠抗肿瘤能力的评估
【结论与展望】
在这项工作中,研究团队开发了一种智能模块化DNA LYTACs纳米器件,用于肿瘤特异性降解多致病性蛋白。作者强调了IMTACs在结构复杂和精心制备配体排布方面具有出色的可编程性。IMTACs的组织特异性和多配体显著提高了药物利用率,同时减少了脱靶效应。值得注意的是,在有效捕获蛋白之前,LYTACs可能面临细胞内吞作用的挑战,这是当前所有细胞外蛋白靶向降解方法共同面临的挑战。该策略通过多价蛋白配体结构设计对降解剂进行优化,使其能够更快、更高效地结合靶蛋白,同时最大限度地减少脱靶效应。总体而言,该策略为设计精准医学降解剂和开发专有抗肿瘤药物提供了一个通用、智能、模块化和简单的可编码纳米平台。
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.4c10010
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤治疗# #蛋白质降解#
11