【指南与共识】| 乳腺癌多学科诊疗标准与规范(2023年版)
2024-01-20 中国癌症杂志 中国癌症杂志 发表于陕西省
本标准与规范旨在从MDT所有参与的单学科或科室应该承担的职责出发,以患者为中心,提供一站式医疗服务。
[摘要] 2020年乳腺癌已成为全球发病率最高的恶性肿瘤,近年来随着诊疗技术的提升,中国乳腺癌患者生存率虽显著提高,但仍与西方国家存在较大差异。目前国内乳腺癌诊治仍存在诸多不足的地方,如院内缺少综合治疗的复合型医学人才、患者有效就诊时间短、就诊流程繁琐等。多学科团队诊疗(multidisciplinary team treatment,MDT)模式是由多个学科的资深专家团队合作,针对某一种或某一系统疾病的病例进行讨论,在综合各学科意见的基础上为患者制订出最佳治疗方案的诊疗模式。MDT已经逐渐被多个肿瘤治疗领域接受并广泛实施,很多常见肿瘤治愈率的提高是通过MDT实现的。该模式涉及方面广泛,包括医院制度化建设及核心科室和协同科室的专业合作等。其实施可以提高疾病的诊断率,减少误诊或漏诊,也可以提高指南实施规范性,从而在整体上提高以患者为中心的全病程管理能力及乳腺癌单病种科室的诊疗能力,最终助力《健康中国行动(2019—2030年)》实现。但全国各地MDT实施缺乏统一的流程及标准,国内外尚无专门针对乳腺癌单病种的MDT标准与规范,以指导并提升临床实践能力。本标准与规范由健康报社主办,中国抗癌协会乳腺癌专业委员会发起,在具有肿瘤诊疗相关专科的综合医院和肿瘤专科医院组织多学科专家,依据高级别循证医学依据,通过共同讨论形成赋能专科建设项目并制订《乳腺癌多学科诊疗标准与规范(2023年版)》。本标准与规范的具体内容包括:① 乳腺癌MDT组织建设及运营机制的基本要求;② 初诊(早期)乳腺癌患者MDT标准与规范;③ 复诊(复发转移性/初诊晚期)乳腺癌患者MDT标准与规范;④ 以患者为中心的MDT规范化标准诊疗流程;⑤ 乳腺癌MDT高质量发展的其他要求及建议。本标准与规范旨在从MDT所有参与的单学科或科室应该承担的职责出发,以患者为中心,提供一站式医疗服务,共同探索符合中国国情的MDT标准与规范,同时评选出优秀及标杆医院,以促进该领域的MDT进展,并进一步规范乳腺癌慢病化与规范化全程管理,最终推动乳腺癌领域的变革与进步,造福乳腺癌患者。
[关键词] 多学科团队诊疗;乳腺癌;综合治疗;规范化;全程管理
[Abstract] Breast cancer has become the most common malignant tumor in the world since 2020. With the diagnosis and therapeutic regimens improvement in breast cancer, survival rate of Chinese patients has been significantly enhanced in recent years. However, there is still significant difference in overall survival rate between China and western countries. Many unmet needs exist in daily clinical diagnosis and treatment of breast cancer in China e.g., shortage of high-quality versatile medical talents, insufficient effectively visiting duration for single patient, overly complicated outpatient or inpatient hospital process. Multidisciplinary team treatment (MDT) is an optimized therapeutic model or platform in which many senior medical experts from multiple disciplines would collaborate together to discuss each single case or each category of cases deeply and thoroughly, and then design the specific treatment plans based on all comprehensive recommendations. MDT has been gradually accepted and widely adopted in multiple anti-cancer therapy, and has somehow largely enhanced the cancer cure rate. The MDT model involves many aspects including hospital system construction, cooperation between core and collaborative departments. MDT can improve disease diagnosis rate, reduce misdiagnosis or missed diagnosis, enhance standardization of clinical guidelines, optimize patient-centered whole disease process management and finally strengthen the therapeutic capabilities for breast cancer as a single disease department, ultimately contributing to the achievement of the goal of 'Healthy China Initiative (2019-2030)' project. However, current reality is the lack of unified standard for MDT execution process in China, and there is no specific MDT guideline for breast cancer globally and domestically which can guide or enhance the daily clinical practice. Hosted by Chinese Health Newspaper and initiated by Breast Cancer Professional Committee of Chinese Anti-Cancer Association, this paper came from joint discussions of multidisciplinary experts from top general and specialized hospitals based on high-level evidence-based medicine. The main contents were as following: ① Basic requirement for hospital or department system construction or operating process for breast cancer MDT; ② Standard and requirement for early-stage breast cancer MDT; ③ Standard and requirement for late-stage breast cancer MDT; ④ Standard and requirement for patient-centered breast cancer MDT; ⑤ Other or further requirements for high-quality breast cancer MDT. Here we discussed the exact responsibility of each department involved in MDT, providing patient-centered and one-stop medical services, and then combined together to explore MDT execution standard which would be suitable for current medical care status in China. Meanwhile we selected the outstanding or benchmark hospitals to push forward MDT model enlargement and enhance whole management process of breast cancer as a chronic disease, ultimately to enhance therapeutic improvement in breast cancer and benefit breast cancer patients..
[Key words] Multidisciplinary team treatment (MDT); Breast cancer; Integrated treatment; Standardization; Integrated case management
《乳腺癌多学科诊疗标准与规范 (2023年版)》制订小组成员
(暨赋能专科建设一共创健康中国多学科专家委员会成员)
(以汉语拼音为序)
执笔专家:赋能专科秘书组成员
-
陈星星 | 复旦大学附属肿瘤医院放射治疗中心
-
李 薇 | 江苏省人民医院肿瘤科
-
齐晓伟 | 陆军军医大学西南医院乳腺甲状腺外科
-
邱鹏飞 | 山东第一医科大学附属肿瘤医院乳腺外科
-
邵 彬 | 北京肿瘤医院乳腺肿瘤内科
-
田 伟 | 浙江大学医学院附属第二医院乳腺外科
-
徐 菲 | 中山大学肿瘤防治中心内科
-
肖 勤 | 复旦大学附属肿瘤医院放射诊断科
-
杨犇龙 | 复旦大学附属肿瘤医院乳腺外科
-
杨辞秋 | 广东省人民医院乳腺肿瘤科
-
张 翔 | 重庆医科大学附属第一医院乳腺甲状腺外科
-
张 璋 | 四川大学华西医院病理科
-
卓 睿 | 桂林市中医医院乳腺科
校正专家:赋能专科建设学科带头人
-
陈益定 | 浙江大学医学院附属第二医院乳腺外科
-
金 锋 | 中国医科大学附属第一医院乳腺外科
-
厉红元 | 重庆医科大学附属第一医院乳腺甲状腺外科
-
刘 健 | 福建省肿瘤医院乳腺内科
-
罗 婷 | 四川大学华西医院乳腺疾病中心
-
王树森 | 中山大学肿瘤防治中心内科
-
王晓稼 | 浙江省肿瘤医院乳腺内科
-
王永胜 | 山东第一医科大学附属肿瘤医院乳腺外科
-
吴 炅 | 复旦大学附属肿瘤医院乳腺外科
-
杨文涛 | 复旦大学附属肿瘤医院病理科
-
张 瑾 | 天津医科大学肿瘤医院乳腺肿瘤科
-
张清媛 | 哈尔滨医科大学附属肿瘤医院乳腺内科
1 背景
乳腺癌作为女性发病率最高的恶性肿瘤,目前国内诊治仍存在一定的问题:首先,由于乳腺癌诊治大多在综合医院或肿瘤专科医院,患者到院诊疗时往往需辗转于多个科室,流程繁琐、经济成本高;其次,中国缺少综合治疗的复合型医学人才,患者的诊疗往往取决于首诊医师的专业水平,无法接受更合理的治疗方案。
2016年原国家卫生和计划生育委员会、国家中医药管理局印发《关于加强肿瘤规范化诊疗管理工作的通知》,强调优化肿瘤诊疗模式,推行 “单病种、多学科”诊疗模式[1]。《“健康中国2030”规划纲要》提出“到2030年,实现全人群、全生命周期的慢性病健康管理,癌症患者5年总生存率提高15%”目标[2],2019年6月为加快实现该目标,国务院印发《国务院关于实施健康中国行动的意见》[3],健康中国行动推进委员会同步印发《健康中国行动(2019—2030年)》,推出健康知识普及和癌症防治等15个专项行动,关注推进癌症筛查、早诊早治以及推进单病种多学科团队诊疗(multidisciplinary team treatment,MDT)模式[4]。
MDT对于提高肿瘤规范化诊疗水平具有十分重要的意义,面对病情复杂的患者,通过组织肿瘤内科、外科、放疗、病理、影像、检验等多个临床专科医师讨论,可以帮助制订更加科学的诊疗方案。通过积极推进MDT模式试点工作,可进一步向更广泛地区和更多病种推广,进一步优化诊疗模式,提升肿瘤诊疗水平[1-2]。
2 MDT模式由来及乳腺癌MDT模式的价值
1995年英国卫生部首次提出MDT理念[5],将其定义为“一个由不同医疗卫生领域工作人员组成的团队,通过讨论的形式,合理应用现有治疗手段,旨在为患者提供最优决策”。英国癌症诊治指南规定:所有确诊恶性肿瘤的患者,在接受治疗前必须经过相关MDT会诊,从而确立了 MDT在肿瘤诊治过程中的重要地位。
MDT已成为国际上积极倡导的一种新型诊疗模式,能够提高早期乳腺癌的检出率并完善治疗,最终转化为患者生存获益。① MDT可提高患者生存率,研究[6-7]发现,经MDT的患者可降低死亡率,提高5年生存率;② MDT可以降低乳腺癌患者的经济负担,通过诊疗明显缩短患者转诊和等待时间,治疗费用也相应降低;③ 从治疗经验来看,经过MDT制订的治疗方案,患者依从性也相应提高;④ MDT可以助力医学研究,借助MDT模式可建立乳腺癌临床数据库、组织标本库和影像学检查数据库等,并按研究方向建立相应子数据库;⑤ MDT可增益科学研究的时效性,提高患者临床试验入组率等;⑥ MDT还能促进医疗专业人员对疾病诊治水平的提高。MDT模式治疗乳腺癌可以实现全病程管理,从诊断到治疗、到患者随访,不仅让患者得到更好的诊断和治疗,也在康复和心理方面得到强有力的支持和指导,最终达到提高患者生存率与生活质量的双重目标。
3 乳腺癌MDT标准与规范制定的必要性
2020年乳腺癌已成为全球发病率最高的恶性肿瘤,中国女性新发病例约41.6万人。随着诊疗技术发展和治疗手段不断推陈出新,乳腺癌整体5年生存率已显著提升[8-9],基本可将其视为一种慢性疾病进行相关管理。但与西方国家相比,中国乳腺癌患者的生存率仍存在较大差异。乳腺癌是一种异质性很强的肿瘤,随着对疾病认知及患者对生活质量要求的提升,乳腺癌的准确诊断与分子分型、临床及病理学分期,如何确定最符合患者的手术方式,如何制订最佳新辅助治疗及辅助治疗等系统治疗方案,如何对复发转移的患者制订最优治疗策略,如何管理患者的依从性并定期随访,都成为临床诊疗需要解决的问题。而这些规范化诊疗的管理,无法由单一科室完成,需要统筹不同科室资源,为患者制订个性化的全程管理方案。
乳腺癌MDT模式在不同国家或地区,开展的形式存在一定差异。一项针对39个国家医务工作者的问卷调查显示,超过60%的欧洲肿瘤中心设有MDT团队,而在亚洲和南美洲仅为35%和25%;欧洲90%的机构每周举行1次MDT会议,而亚洲仅有50%的机构每周举行1次[10]。上述调查还显示MDT在不同分期患者中的展开比例不同:51%的机构会针对所有分期乳腺癌进行MDT讨论,22%机构仅聚焦于早期乳腺癌患者。2018年11月30日国家卫生健康委员会公布第一批肿瘤MDT试点医院名单[11],中国实施MDT的三级甲等医院共有231家,仅占三级甲等医院的16%,三级医院的9%。在三级以下的各级医院中,实施MDT模式的医院很少。
国内外乳腺癌MDT在开展时均面临一定的问题与挑战,如团队组建、团队管理、硬件设备及以患者为中心的决策过程等[12],缺乏MDT首席专家制度,MDT开展中专家意见不一致,缺乏病理及放疗科医师参会,病理学检查结果不能及时出具,科室/医院之间的竞争等都是影响MDT开展的实际困难,同时由于国内乳腺专科护士在评估患者整体需求方面参与率低,不利于改善患者体验和生活质量,优化这些因素可显著提高MDT的质量。中国幅员辽阔,乳腺癌诊治水平极不平衡,各医院MDT的开展水平参差不齐,MDT模式需要形成上级医院指导下级医院的联动模式,以便更好地执行MDT的决策效力。但目前乳腺癌MDT团队建设和执行仍欠缺统一的标准及指导建议,亟待形成规范化标准,广泛推广并应用。
4 乳腺癌MDT标准与规范的工作目标
临床路径是一种将临床诊疗行为标准化的过程,MDT管理有助于对乳腺癌诊治过程进行临床路径化管理,使乳腺癌的诊治进一步规范化。为了进一步提高乳腺癌单病种MDT能力提升,特发起“赋能专科建设—共创健康中国多学科规范化诊疗标准与规范”项目,制订《乳腺癌多学科诊疗标准与规范(2023年版)》。本项目旨在鼓励更多具备乳腺癌综合诊疗能力的专科医院或综合性医院参与到项目中来,提高其在乳腺癌单病种MDT方面的管理能力和规范化水平,从而更好地维护患者的健康权益。逐步建立以患者为中心的MDT的全病程、规范化管理模式和乳腺癌单病种的个案管理师模式,以提高乳腺癌患者的生存率,并保持良好的生活质量,最终助力健康中国2030目标的实现。
本项目计划于2023—2024年在全国有乳腺癌综合诊疗能力的肿瘤专科医院或综合性医院范围内,遴选300家医院开展乳腺癌单病种MDT试点及评选工作,开展“示范中心”医院的标杆优选项目,并发挥模范带头作用,以点带面逐步在全国推广MDT模式,促进乳腺癌单病种的综合诊疗水平。
5 乳腺癌MDT规范化试点或遴选范围
本项目由健康报社主办,中国抗癌协会乳腺癌专业委员会发起,在具有肿瘤诊疗相关专科的综合医院和肿瘤专科医院,选择乳腺肿瘤开展试点及评选工作,并遴选示范中心。
由国家卫生健康委员会医政医管局指导及监督,中国抗癌协会乳腺癌专业委员会接受委托,制订工作方案并组织实施;成立“赋能专科建设—共创健康中国多学科专家委员会”(以下简称专家委员会);并组织示范中心医院的审核认定和指导评估等工作,协助对优秀示范单位进行技术审核和指导,并开展相关工作信息分析和评估等。各参选医院根据中国抗癌协会乳腺癌专业委员会制定的具体要求及标准,先自行评估是否达到示范中心入选标准。对于自评达标的单位,提交专家委员会进一步审核,最后遴选出全国乳腺癌单病种MDT重点示范单位。
6 乳腺癌MDT规范化示范中心的具体要求
乳腺癌单病种MDT规范化示范中心,需要将精准医疗、规范化诊疗、标准化诊疗流程、个案管理师制度(从入院到出院以及出院后的全程跟踪管理)等融入乳腺癌诊疗的全过程,优化临床诊断及决策,提升乳腺癌的诊疗质量。通过建立MDT标准化操作流程及规范,加强对医务人员和患者的宣传,提高乳腺癌早诊早治及规范化诊疗,进一步改善乳腺癌患者的生存时间及生活质量。需要重点做好以下工作:
⑴ 建立乳腺癌MDT标准化操作流程,保证MDT运行效率和质量。可结合医院实际情况,制定MDT工作制度和相应的MDT(如门诊MDT、住院MDT或远程MDT等)标准化操作流程。
⑵ 提高乳腺癌MDT水平。遵循乳腺癌相关的肿瘤诊疗规范、指南和专家共识要求,不断提高医务人员乳腺癌MDT规范化诊疗水平。
⑶ 提高乳腺癌MDT质量管理及评估水平。成立院内乳腺癌MDT工作委员会,建立相应监督管理制度,对全院乳腺癌MDT工作进行全面管理及评估。专家委员会对部分自评达标医院MDT活动开展情况进行督查,对示范中心的标杆医院进行鼓励及宣传,持续提高MDT质量。
⑷ 加强对医务人员和患者的宣教。组织开展乳腺肿瘤防治知识的系列宣教活动,制订有针对性的培训计划,提高医务人员和患者对MDT重要性的认识,开展乳腺癌MDT规范化示范中心优秀案例的宣传。
7 乳腺癌MDT规范化示范中心遴选及评估的实施步骤
7.1 筹备赋能专科建设—共创健康中国多学科专家委员会
⑴ 由中国抗癌协会乳腺癌专业委员会牵头成立评估专家委员会,专家组建议包括乳腺外科、肿瘤内科、放疗科、护理部、病理科、影像科、超声科和药剂科,制定示范单位的遴选工作标准及具体方案。
⑵ 所有参选医院根据示范中心的试点及遴选要求,先进行自我测评,并将自评结果的书面材料以纸质形式和电子信箱推荐至专家委员会和秘书组。
⑶ 专家委员会和秘书组对所有自评医院的书面材料进行审核,必要时开展现场抽查,最终将评选结果报中国抗癌协会乳腺癌专业委员会,并呈报国家卫生健康委员会医政医管局,由健康报进一步予以宣传。
7.2 乳腺癌单病种MDT规范化示范中心的宣传及推广阶段
⑴ 被评选为示范单位的乳腺癌MDT规范化示范中心,进一步在全国范围内宣传,总结借鉴其先进成功经验,并推广为可复制的乳腺癌MDT模式。
⑵ 中国抗癌协会乳腺癌专业委员会要从高质量推动乳腺癌单病种的医疗服务角度,充分认识开展MDT模式的重要意义。切实加强协会的组织管理能力,由健康报等单位协调相关部门对示范试点进行宣传及推广,加强对收费、医保报销等政策制定、落地执行工作上的支持。
8 制订方法
本标准与规范已在国际实践指南注册与透明化平台(Practice Guideline Registration for Transparency,PREPARE)上注册,注册号为PREPARE-2023CN969。
本标准与规范结合中国的实际情况,采用国际公认的证据评价与推荐意见分级、制定和评价(Grading of Recommendations, Assessment,Development and Evaluation,GRADE)标准和流程制定。主要步骤如下:
⑴ 成立专家工作组:本标准与规范的专家组成员均来自赋能专科建设—共创健康中国多学科专家委员会,工作组所有参与成员均无利益冲突。
⑵ 标准与规范文献检索方法:文献检索主要来自外文数据库(PubMed、Embase和Cochrane Library)和中文数据库(中国知网、万方和中国生物医学文献数据库),检索关键词包括Multi-Disciplinary Treatment(MDT)、breast cancer、clinical decision making、乳腺癌规范诊疗及全程管理。
⑶ 证据质量评价:本标准与规范采用证据评价与推荐意见分级系统-GRADE,对证据质量进行评价,形成证据等级[13]。遵循GRADE系统来评价证据,考虑证据中的偏倚风险、不一致性、间接性、不精确性和发表偏倚;证据质量分为高、中、低和极低4个级别,专家的推荐强度分为强推荐和弱推荐。证据质量分级和推荐强度分级见表1。

9《乳腺癌多学科诊疗标准与规范(2023年版)》的具体要求
9.1 乳腺癌MDT组织建设及运营机制的基本要求
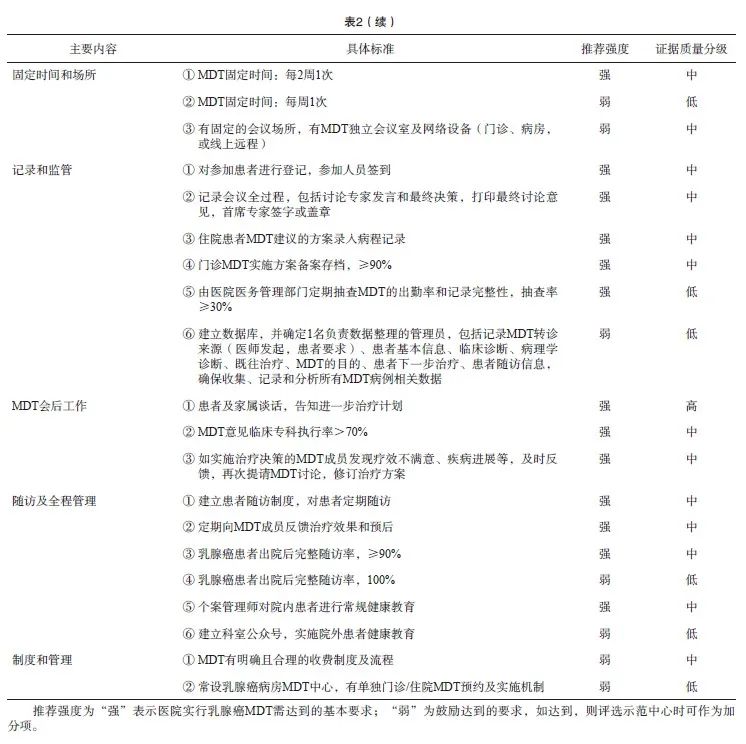
MDT主要为乳腺癌患者提供全程的医疗决策和健康管理方案,最终改善患者生存预后和生活质量[14]。同时,希望通过MDT促进不同学科、不同医院之间学习交流,帮助提高专业水平,改善区域间医疗水平不均衡的局面。与传统的多学科会诊相比,MDT除规范化诊疗外,MDT团队的建设和管理在临床实践中尤为重要[15],因此,参加乳腺癌MDT的医院需要达到基本要求(表2)。
⑴ 按照学科划分:MDT需包括核心科室(乳腺外科、肿瘤内科、放疗科、病理科、影像科、护理部等)和支持科室(整形科、药剂科、信息科、心理科等) [16]。
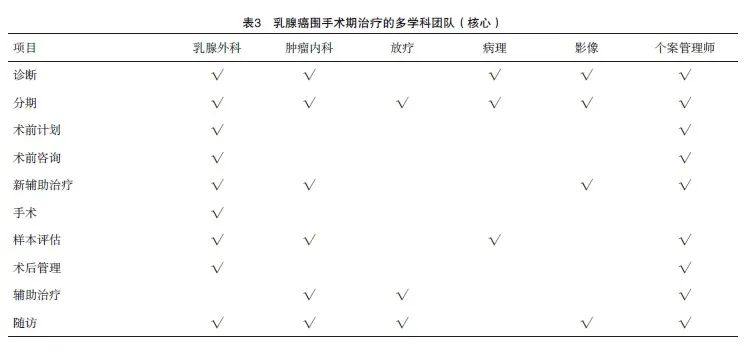
⑵ 按照职能划分:需包含领导者(牵头人、会议主席)、讨论专家和秘书(表3)。
① MDT牵头人需负责团队管理,如制定工作目标、管理制度、诊疗规范等;② MDT会议主席需要负责MDT会议的组织和运行,最终促进以循证医学证据和以患者为中心的MDT决策产生;③ 讨论专家通常需要副高级职称以上医师(或高年资主治医师暂行替代),具有团队精神,善于合作,同时有较充足的时间,可保证参会率;④ MDT秘书主要负责安排会议,收集患者资料、准备必要的设备设施、进行会议记录等。建议对成员进行合作培训,特别是在沟通技巧方面,以确保患者获得全面和一致的决策信息[17]。

9.2 初诊(早期)乳腺癌患者MDT标准与规范
MDT模式可贯穿于乳腺癌治疗各个阶段[18-19],包括:
① 初诊阶段:早期乳腺癌患者术前合理治疗方案选择(如新辅助治疗决策),手术治疗选择,以及术后辅助治疗方案优化MDT模式;② 复诊阶段:发现复发转移或初诊晚期乳腺癌解救治疗的MDT模式。
中国现已开展包括乳腺筛查在内的多个国家重大公共卫生服务项目,如城市癌症早诊早治项目、全国农村妇女“两癌筛查”项目等[20]。目前初诊乳腺癌患者早期患者占比高,通常早期乳腺癌患者预后较好。MDT可将诊治时间缩短[21],为初诊早期乳腺癌患者提供更完整、全面的诊治方案,为患者带来更多临床治愈机会。
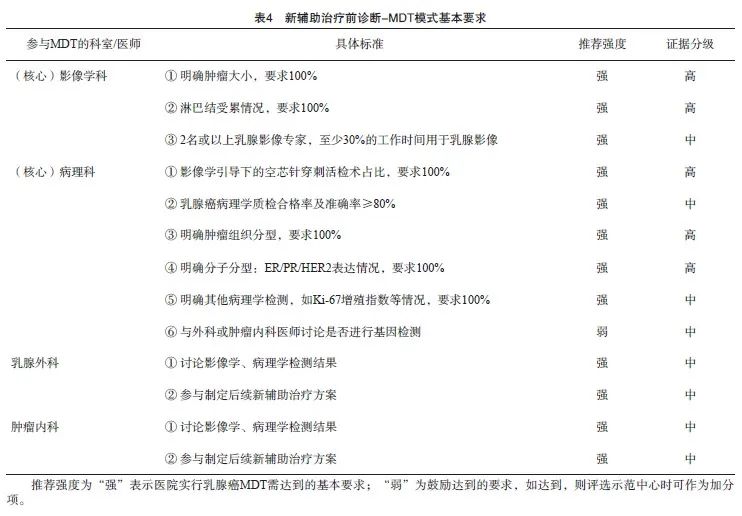
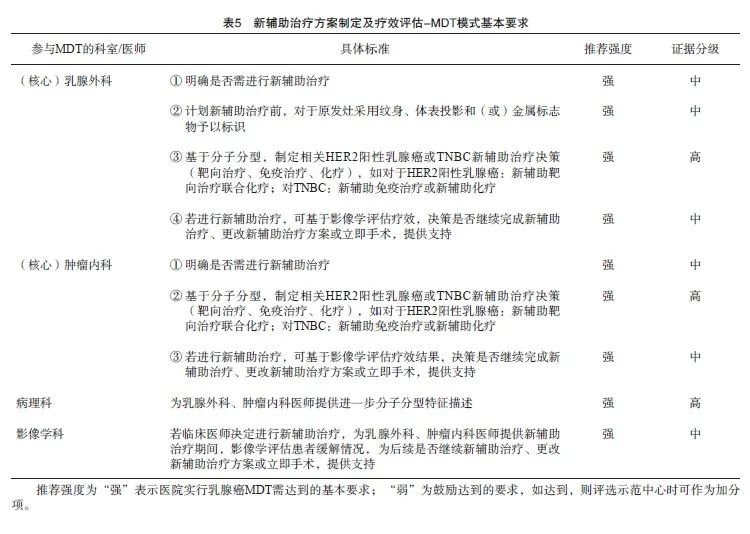
9.2.1 初诊阶段-早期乳腺癌新辅助治疗的MDT模式
早期乳腺癌的治疗目标是提高治愈率,系统治疗是改善预后的关键[22-23]。
目前除激素受体(hormone receptor,HR)阳性早期乳腺癌患者,术前新辅助治疗方案仍在探索;人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性早期乳腺癌及三阴性乳腺癌(triple-negative breast cancer,TNBC)术前新辅助治疗已在临床应用较为广泛[24]。新辅助治疗改善局部区域治疗:提供手术机会、降期保乳保腋窝;提供药敏信息,指导辅助治疗,进一步改善预后[25]。
新辅助治疗的病理学评估规范:对于需要进行新辅助治疗的乳腺癌患者要求在治疗开始前完成原发灶的空芯针穿刺活检和免疫组织化学分型,对于临床可疑淋巴结阳性者需进
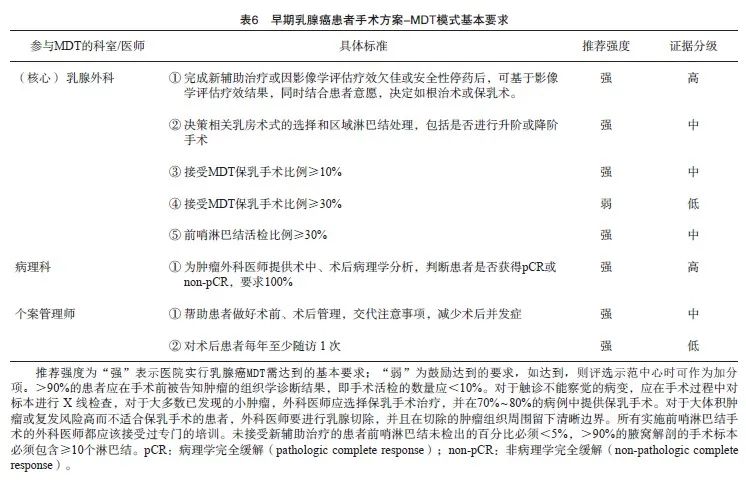
9.2.2 初诊阶段-早期乳腺癌患者手术方案的MDT模式
完成新辅助治疗或新辅助治疗期间因疗效或安全性停药后,在多学科协作背景下,乳腺癌外科治疗在“至简至臻”中逐步演变,出现很多里程碑式的进展,其中乳腺癌手术包括乳房术式的选择和区域淋巴结处理两大部分(表6)。手术方式的选择应按以下评估标准实施:① 明确乳腺癌的临床分期;② 综合权衡患者的医疗条件;③ 具体因人而异选择手术方式。研究[27]表明,早期乳腺癌接受分级护理下保乳手术可以有效地缩短术后恢复过程,改善心理和生活质量。
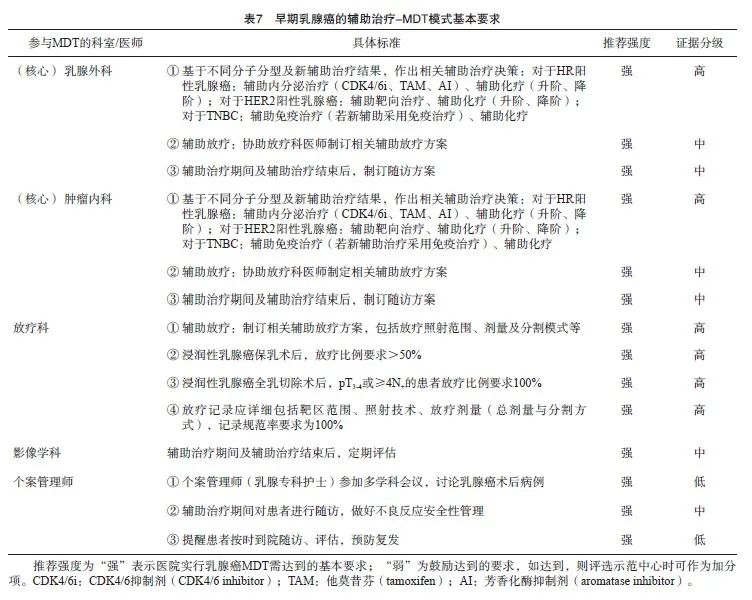
9.2.3 初诊阶段-早期乳腺癌辅助治疗的MDT 模式
MDT讨论对于乳腺癌术后辅助治疗方案的决策尤其重要[28],可使乳腺癌患者术后的辅助治疗方案更加规范化与个体化, 最佳辅助治疗的选择可以进一步降低复发或向其他部位转移的概率,是延长患者生存的关键。
目前初诊早期患者辅助治疗方案,主要基于不同分子分型及新辅助治疗结果,参考相关指南(可指定)意见作出相关辅助治疗决策,包括辅助化疗、辅助内分泌治疗、辅助靶向治疗及辅助免疫治疗。患者年龄(≥70岁)、肿瘤大小、淋巴结转移数、ER/PR/HER2表达情况、Ki-67增殖指数、基因检测、患者耐受性及特殊病理学类型等均是影响治疗计划的因素[25]。
对于直接手术的患者,伴有多发淋巴结转移等高危因素的,辅助治疗需要延长治疗或使用靶向治疗联合化疗(如HER2阳性的高危复发患者,推荐曲妥珠单抗与帕妥珠单抗双靶向治疗联合辅助化疗)以尽可能改善患者的生存情况[29]。乳腺癌术后辅助化疗若无特殊情况,建议完成足疗程治疗(辅助或辅助强化治疗根据方案不同,一般4~8个周期)[29],以减少复发,更多达到治愈(表7)。
9.3 复诊(复发转移性/初诊晚期)乳腺癌患者MDT标准与规范
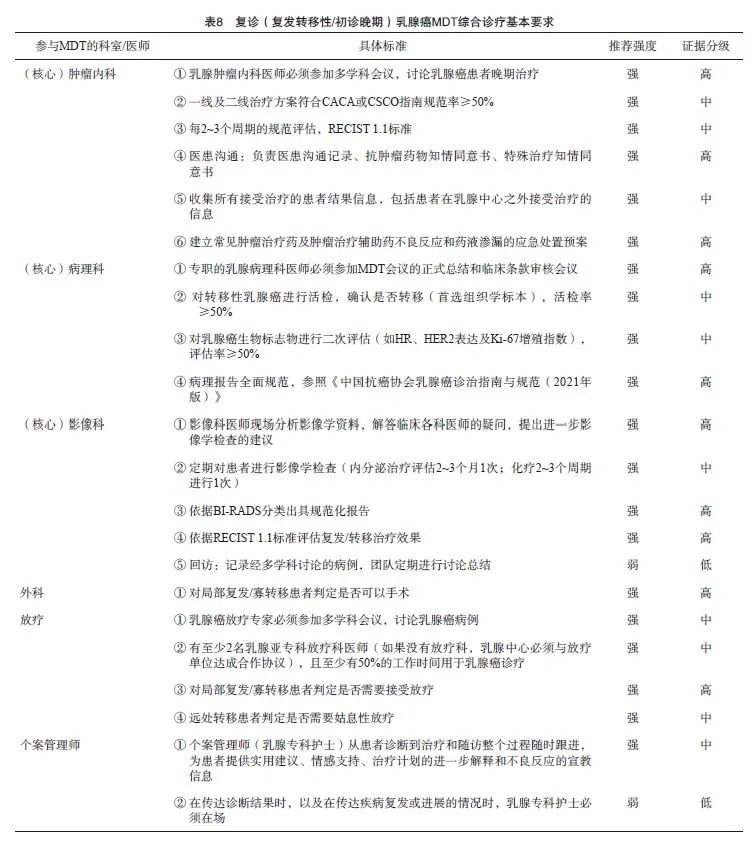
复发/转移性乳腺癌治疗是一个复杂的过程,治疗期间必须考虑各种因素。对于晚期乳腺癌,机体状态和转移部位是主要考虑因素[30]。病理科医师提供的病理学信息在复发/转移的情况下也起着关键作用[31],建议结合临床实际,通过病理学活检明确疾病类型、分子分型、肿瘤标志物表达状态及靶向基因改变情况,以精准指导一线及后线药物选择(表8)。
乳腺癌的影像学检查贯穿MDT的疾病全过程,建议无论治疗决策如何,都应按计划的周期通过临床和影像学检查(包括CT、骨扫描或PET/CT)评估转移性疾病患者的治疗反应,反应评估间隔还应基于疾病进展速度、转移部位/范围、治疗模式进行调整,可相应缩短或延长[32]。
放疗除应用于浸润性乳腺癌术后治疗,还可应用于综合治疗,例如:① 局部晚期不可手术乳腺癌患者;② 局部区域性复发患者;③ 远处转移患者的姑息性放疗,如骨转移患者的止痛、预防病理性骨折及脊髓压迫,脑转移患者降低颅内高压、缓解转移灶引起的神经症状等,可显著改善患者在带瘤生存期内的生存质量,并延长部分患者的生存时间[33]。对于部分局部转移或 “寡转移”(通常定义为影像学检查可见5个或更少的转移灶)患者中,转移灶定向疗法联合手术和(或)影像引导的放射治疗(image-guided radiation therapy,IGRT)可改善结局,甚至可能治愈[34]。
一般治疗原则:医师在选择治疗方案时应考虑多方面因素,如无病间隔、肿瘤负荷(转移部位和数量)、HR和HER2状态、既往治疗(疗效、不良反应、耐受性等)、年龄和合并症等,同时,应结合患者疾病严重程度及患者经济和心理情况进行调整。① 相对局限的局部复发晚期乳腺癌应尽可能选择局部根治性治疗,包括乳房切除术、根治性切除加放疗等、根治性切除加局部强化放疗;② 对于不可切除的局部复发/转移性乳腺癌,全身治疗是首选,全身治疗后可采取局部治疗以缓解症状和治疗并发症[32-33]。
由于晚期一线接受治疗患者人数最多,而且在很大程度上决定后续治疗选择,因此晚期一线治疗的选择最好接受MDT讨论。HR阳性 /HER2阴性晚期乳腺癌一线治疗仍以内分泌治疗为主,部分内分泌治疗耐药或肿瘤进展较快的患者可选择化疗±靶向治疗,随着更多的靶向治疗药物获批及价格可及,CDK4/6i已成为晚期一线标准治疗方案。基于CLEOPATRA和PUFFIN研究[35-36],HP双靶已成为国际和国内HER2阳性晚期乳腺癌一线首选治疗方案,而基于EMILIA研究[37],T-DM1成为二线推荐治疗方案。大分子单抗类药物均一致显示出无进展生存期(progression-free survival,PFS)及总生存(overall survival,OS)的双重获益,酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)类药物更多显示PFS获益[38]。对于脑转移的患者,TKI类药物和抗体药物偶联物(antibody-drug conjugate,ADC)可优先选择。HER2靶向治疗研究时间最久,也是第一个可改变乳腺癌患者预后的治疗靶点。相信随着更多抗HER2药物纳入医保,未来中国晚期乳腺癌患者可以得到更规范的治疗,生存获益也会进一步提高。晚期TNBC一线治疗目前仍以化疗为主,免疫检查点抑制剂联合化疗,或多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]抑制剂均初步显示出良好的疗效,更多ADC药物的出现或可解决TNBC高度异质性的问题,未来或许改变TNBC的治疗格局。
复发/转移性乳腺癌应该在保证生活质量的前提下,缓解症状、延长患者的OS。个案管理师可以通过精心照护,促进患者整体康复,还能明显改善患者社会心理功能及躯体症状[39- 40],进一步促进患者积极参与治疗,提高患者治疗依从性。

9.4 以患者为中心的MDT规范化标准流程
目前乳腺癌治疗,已从单一诊疗模式向MDT模式转变,MDT参与可提供更好诊治,使患者获得更好预后(图1)。乳腺癌MDT中心通常需要从检查项目、分期标准、诊疗标准、治疗方案、预后指标到随访要求,建立完整的诊疗规范体系。主要流程包括预约、准备、病情汇报、影像分析、专家讨论、决定方案、患者及家属会谈、讨论记录、方案实施、监测评估、方案修订、随访跟踪等(图2)。
未来MDT模式更注重患者的就医感受。2023年国家卫生健康委和中医药管理局下发的《关于开展改善就医感受提升患者体验主题活动的通知》中提到,要以切实改善人民群众看病就医感受为目标,全面梳理医疗服务流程,充分运用新手段、新技术、新模式,将“以患者为中心”贯穿于医疗服务各环节。创新服务模式,鼓励医疗机构扩展MDT覆盖的专科和病种,有条件的医疗机构可设立门诊MDT岗;同时鼓励拓展日间医疗服务范围并完善相关制度。兼顾疗效与便捷性的日间诊疗/一体化灵活诊疗中心将成为肿瘤治疗的新趋势,或可为患者提供更便捷、经济、安全的诊疗途径。患者经MDT评估并制订治疗方案后,直接到日间诊疗中心接受治疗,无需长时间住院。随着新型皮下剂型药物的出现,结合日间诊疗模式可显著减轻患者住院时间/经济负担,提高患者及陪护人员的生活质量;同时日间诊疗中心可对患者进行输注后观察、随访信息录入和院外教育,助力患者全程管理。
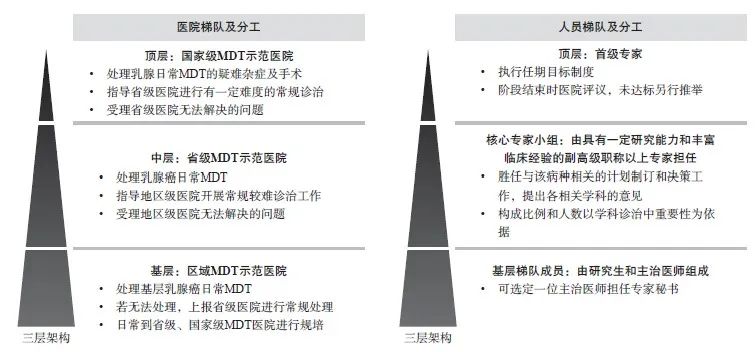
图1 MDT模式治疗乳腺癌的医院及人员组织架构
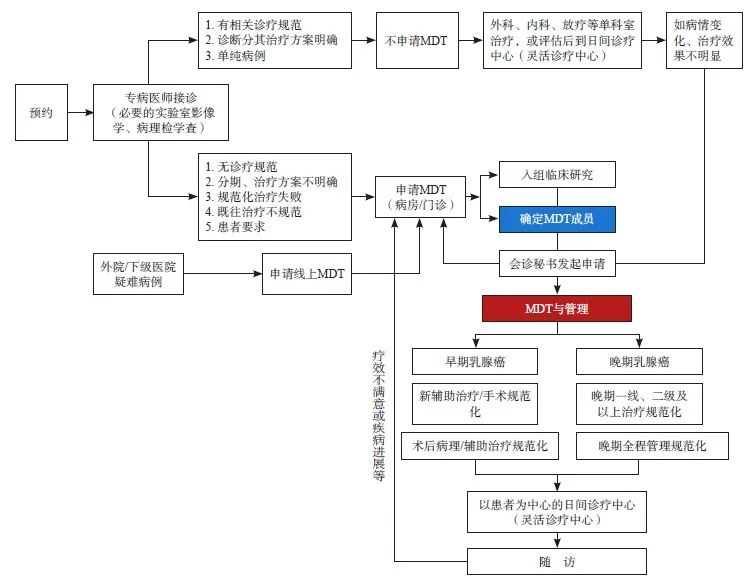
图2 以患者为中心的MDT规范化标准流程图
9.5 乳腺癌MDT高质量发展的其他要求及建议
MDT模式有助于优化乳腺癌临床诊治,提高早期乳腺癌检出率,并提高乳腺癌患者生存率,改善患者的预后[41]。MDT也可推进临床研究的开展,为各学科创建沟通交流及资源共享的有益平台,建立跨学科数据库,推动转化医学研究。鼓励医院管理部门对MDT予以协助和支持,提供足够的资金和资源,并进行年度评估,帮助对相关问题督促整改。建议整合专科护士构建患者全生命周期随访体系[42],同时建议建立健全日间诊疗服务,兼顾效率医疗和人文关怀,真正帮助患者实现肿瘤慢病化、全程化管理,为患者提供更有温度的医疗服务。在日间政策的引导下,处于各个发展阶段的医院可以顺势而为,如以皮下制剂为抓手,实现肿瘤治疗模式的创新,打造效率与人文并行的日间医疗。
MDT示范项目也有一定的综合考核指标(表9)。本次乳腺癌单病种的MDT标准与规范,旨在鼓励优秀的示范中心发挥模范作用,也会通过一些综合指标来完善考核整个MDT示范项目,给患者带来更多获益,同时提升医院疾病诊疗能力,最终助力实现健康中国2030计划。
利益冲突声明:所有作者均声明不存在利益冲突。

[参考文献]
[1] 国家卫生计生委办公厅,国家中医药管理局办公室. 关于加强肿瘤规范化诊疗管理工作的通知[J]. 中华人民共和国国家卫生和计划生育委员会公报, 2016, 3: 3-5.
The General Office of the Health and Family Planning Commission of the People’s Republic of China, Office of the State Administration of Traditional Chinese Medicine of the People’s Republic of China. Notice on strengthening the standardized diagnosis and treatment management of tumors[J]. Gazette of the Health and Family Planning Commission of the People's Republic of China, 2016, 3: 3-5.
[2] 中华人民共和国国务院印发.“健康中国2030”规划纲要[J]. 中华人民共和国国务院公报, 2016, 32: 5-20.
Issued by the State Council of the People's Republic of China. The Outline of the Healthy China 2030 Plan [J]. Gazette of the State Council of the People’s Republic of China, 2016, 32: 5-20.
[3] 中华人民共和国国务院. 国务院关于实施健康中国行动的意见[N]. 人民日报, 2019-07-16.007.
The State Council of the People’s Republic of China. Opinions of the State Council on Implementing the Healthy China Action[N]. People’s Daily, 2019-07-16.007.
[4] 马晓璐. 健康中国行动(2019—2030年)[J]. 标准生活, 2019(8): 34-41.
MA X L. Healthy China action (2019-2030)[J]. Stand Living, 2019(8): 34-41.
[5] WHITEHOUSE M. A policy framework for commissioning cancer services[J]. BMJ, 1995, 310(6992): 1425-1426.
[6] KESSON E M, ALLARDICE G M, GEORGE W D, et al. Effects of multidisciplinary team working on breast cancer survival: retrospective, comparative, interventional cohort study of 13 722 women[J]. BMJ, 2012, 344: e2718.
[7] MORRIS E, HAWARD R A, GILTHORPE M S, et al. The impact of the Calman-Hine report on the processes and outcomes of care for Yorkshire’s breast cancer patients[J]. Ann Oncol, 2008, 19(2): 284-291.
[8] 国家肿瘤质控中心乳腺癌专家委员会. 中国乳腺癌规范诊疗质量控制指标(2022版)[J]. 中华肿瘤杂志, 2022, 44(3): 203-208.
National Cancer Quality Control Center breast cancer Expert Committee. Quality control index for standardized diagnosis and treatment of breast cancer in China (2022 edition)[J]. Chin J Oncol, 2022, 44(3): 203-208.
[9] LEI S, ZHENG R, ZHANG S, et al. Global patterns of breast cancer incidence and mortality: a population-based cancer registry data analysis from 2000 to 2020[J]. Cancer Commun (Lond), 2021, 41(11): 1183-1194.
[10] SAINI K S, TAYLOR C, RAMIREZ A J, et al. Role of the multidisciplinary team in breast cancer management: results from a large international survey involving 39 countries[J]. Ann Oncol, 2012, 23(4): 853-859.
[11] 关于印发第一批肿瘤(消化系统)多学科诊疗试点医院名单的通知(2018)[EB/OL]. [2023-09-30]. http://www.nhc.gov.cn/yzygj/s3593g/201812/eb2e49cbe504464790d922a3f8e7a1d2.shtml. Notice on issuing the first batch of pilot hospitals for multidisciplinary diagnosis and treatment of cancer (digestive system) (2018)[EB/OL]. [2023-09-30]. http://www.nhc.gov.cn/yzygj/s3593g/201812/eb2e49cbe504464790d922a3f8e7a1d2.shtml.
[12]TAYLOR C, RAMIREZ A. Defining the characteristics of effective MDT working in cancer care[J]. BMJ Support Palliat Care, 2011, 1: A23-A23.
[13]GUYATT H G, OXMAN D A, VIST E G, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations[J]. BMJ, 2008, 336(7650): 924-826.
[14]FRIEDMAN E L, CHAWLA N, MORRIS P T, et al. Assessing the development of multidisciplinary care: experience of the national cancer institute community cancer centers program[J]. J Oncol Pract, 2015, 11(1): e36-e43.
[15]EL SAGHIR N S, KEATING N L, CARLSON R W, et al. Tumor boards: optimizing the structure and improving efficiency of multidisciplinary management of patients with cancer worldwide[J]. Am Soc Clin Oncol Educ Book, 2014: e461-e466.
[16]KOČO L, SIEBERS C C N, SCHLOOZ M, et al. Mapping current organizational structure and improvement points of breast cancer multidisciplinary team meetings-an interview study[J]. J Multidiscip Healthc, 2022, 15: 2421-2430.
[17]WALRAVEN J E W, VAN DER HEL O L, VAN DER HOEVEN J J M, et al. Factors influencing the quality and functioning of oncological multidisciplinary team meetings: results of a systematic review[J]. BMC Health Serv Res, 2022, 22(1): 829.
[18]LU J, JIANG Y, QIAN M, et al. The improved effects of a multidisciplinary team on the survival of breast cancer patients: experiences from China[J]. Int J Environ Res Public Health, 2019, 17(1): E277.
[19]CHAN W F, CHEUNG P S, EPSTEIN R J, et al. Multidisciplinary approach to the management of breast cancer in Hong Kong [J]. World J Surg, 2006, 30(12): 2095-2100.
[20]赫 捷, 陈万青, 李 霓, 等. 中国女性乳腺癌筛查与早诊早治指南(2021, 北京)[J]. 中国肿瘤, 2021, 30(3): 161-191.
HE J, CHEN W Q, LI N, et al. China guideline for the screening and early detection of female breast cancer (2021, Beijing)[J]. China Cancer, 2021, 30(3): 161-191.
[21]唐振宁, 刘奇伦. 多学科协作模式在乳腺癌诊治中的应用[J]. 中华乳腺病杂志(电子版), 2016, 10(3)177-179
TANG Z N, LIU Q L. Application of multidisciplinary cooperation model in diagnosis and treatment of breast cancer[J]. Chin J Breast Dis Electron Version, 2016, 10(3)177-179
[22]SCHARL A, KÜHN T, PAPATHEMELIS T, et al. The right treatment for the right patient-personalised treatment of breast cancer[J]. Geburtshilfe Frauenheilkd, 2015, 75(7): 683-691.
[23]CHENG Y C, UENO N T. Improvement of survival and prospect of cure in patients with metastatic breast cancer[J]. Breast Cancer, 2012, 19(3): 191-199.
[24]ORTMANN O, BLOHMER J U, SIBERT N T, et al. Current clinical practice and outcome of neoadjuvant chemotherapy for early breast cancer: analysis of individual data from 94 638 patients treated in 55 breast cancer centers[J]. J Cancer Res Clin Oncol, 2023, 149(3): 1195-1209.
[25]中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10): 954-1040.
The Society of Breast Cancer China Anti-Cancer Association. Guidelines for breast cancer diagnosis and treatment by China Anti-Cancer Association (2021 edition)[J]. China Oncol, 2021, 31(10): 954-1040.
[26]《中国乳腺癌新辅助治疗专家共识(2022年版)》专家组. 中国乳腺癌新辅助治疗专家共识(2022年版)[J]. 中国癌症杂志, 2022, 32(1): 80-89.
Expert Group of Expert Consensus on Neoadjuvant Treatment of Breast Cancer in China (2022 edition). Expert consensus on neoadjuvant treatment of breast cancer in China (2022 edition)[J]. China Oncol, 2022, 32(1): 80-89.
[27]REN T T, WU J L, QIAN L, et al. Comparison of efficacy and psychology of breast-conserving surgery and modified radical mastectomy on patients with early breast cancer under graded nursing[J]. Comput Math Methods Med, 2022, 2022: 4491573.
[28]HARRISON J D, CHOY E T, SPILLANE A, et al. Australian breast cancer specialists' involvement in multidisciplinary treatment planning meetings[J]. Breast, 2008, 17(4): 335-340.
[29]TOI M, TAKADA M. Comments to the Chinese Society of Clinical Oncology (CSCO) breast cancer guidelines 2022[J]. Transl Breast Cancer Res, 2022, 3: 21.
[30]MCDONALD E S, CLARK A S, TCHOU J, et al. Clinical diagnosis and management of breast cancer[J]. J Nucl Med, 2016, 57(Suppl 1): 9S-16S.
[31]BLACKWOOD O, DEB R. Multidisciplinary team approach in breast cancer care: benefits and challenges[J]. Indian J Pathol Microbiol, 2020, 63(Supplement): S105-S112.
[32]XU B H, HU X C, JIANG Z F, et al. National consensus in China on diagnosis and treatment of patients with advanced breast cancer[J]. Ann Transl Med, 2015, 3(17): 242.
[33]邵志敏, 沈镇宙, 徐兵河. 乳腺肿瘤学[M]. 上海: 复旦大学出版社, 2023.
SHAO Z M, SHEN Z Z, XU B H. Tumor of the breast[M]. Shanghai: Fudan University Press, 2023.
[34]KENT C L, MCDUFF S G R, SALAMA J K. Oligometastatic breast cancer: where are we now and where are we headed? A narrative review[J]. Ann Palliat Med, 2021, 10(5): 5954-5968.
[35]SWAIN S M, MILES D, KIM S B, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study[J]. Lancet Oncol, 2020, 21(4): 519-530.
[36] XU B H, LI W, ZHANG Q Y, et al. Pertuzumab, trastuzumab, and docetaxel for Chinese patients with previously untreated HER2-positive locally recurrent or metastatic breast cancer (PUFFIN): a phase Ⅲ, randomized, double-blind, placebocontrolled study[J]. Breast Cancer Res Treat, 2020, 182(3): 689-697.
[37] DIÉRAS V, MILES D, VERMA S, et al. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2017, 18(6): 732-742.
[38] XU B, YAN M, MA F, et al. LBA19 Pyrotinib or placebo in combination with trastuzumab and docetaxel for HER2-positive metastatic breast cancer (PHILA): a randomized phase Ⅲ trial[J]. Ann Oncol, 2022, 33: S1387.
[39] BLEICH C, BÜSCHER C, MELCHIOR H, et al. Effectiveness of case management as a cross-sectoral healthcare provision for women with breast cancer[J]. Psychooncology, 2017, 26(3): 354-360.
[40] WANG N N, CHEN J, CHEN W J, et al. The effectiveness of case management for cancer patients: an umbrella review[J]. BMC Health Serv Res, 2022, 22(1): 1247.
[41] BLACKWOOD O, DEB R. Multidisciplinary team approach in breast cancer care: benefits and challenges[J]. Indian J Pathol Microbiol, 2020, 63(5): 105.
[42] AMIR Z, SCULLY J, BORRILL C. The professional role of breast cancer nurses in multi-disciplinary breast cancer care teams[J]. Eur J Oncol Nurs, 2004, 8(4): 306-314.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#乳腺癌# #综合治疗# #全程管理# #多学科团队诊疗#
33