论文解读| Ramesh K. Narayanan教授团队构建核黄素转运蛋白缺陷病的秀丽隐杆线虫模型
2024-11-14 Genes and Diseases Genes and Diseases 发表于江苏省
核黄素转运蛋白缺陷(RTD)是儿童期神经退行性疾病。悉尼大学团队构建线虫模型,发现其再现 RTD 患者突触传递缺陷、运动功能障碍等特征,为研究发病机制和治疗策略提供重要动物模型。
核黄素转运蛋白缺陷(Riboflavin transporter deficiency,RTD),一种起病于儿童期的神经退行性疾病,其特征是感觉与运动神经元的退化,引发共济失调、肌肉无力、视神经萎缩乃至呼吸衰竭。该病由SLC52A2和SLC52A3基因突变引起,这些基因编码的核黄素转运蛋RFVT2和RFVT3参与核黄素的细胞摄取。核黄素是 flavin adenine dinucleotide 和 flavin mononucleotide的前体,对线粒体生物能量学以及氨基酸和脂肪酸代谢至关重要。尽管体外细胞模型增进了我们对RTD的理解,但它们缺乏完整的神经系统,无法模拟长轴突和支持细胞。因此,发展体内模型对于深入理解RTD的病理机制至关重要。
澳大利亚悉尼大学的Ramesh K. Narayanan教授团队在本刊发表了题为“C. elegans model of riboflavin transporter deficiency (RTD) disorder reveals deficits in synaptic transmission and movement”的研究快讯,利用秀丽隐杆线虫(C. elegans)模型揭示了RTD导致突触传递和运动能力缺陷的分子机制。
1、研究方法:
研究团队利用 CRISPR-Cas9 技术构建了携带人SLC52A2基因p.Y305C突变的 C. elegans rft-1Y290C 模型。随后,通过一系列行为学、生理学和分子生物学实验,评估了该线虫模型的功能和行为特征。
2、研究结果
与对照组相比,rft-1Y290C线虫平均体宽显著减少,表明其生长发育受到影响(图1B)。rft-1Y290C线虫对乙酰胆碱酯酶抑制剂aldicarb的敏感性降低,暗示其突触传递功能受损 (图1C)。而其对乙酰胆碱受体拮抗剂levamisole的敏感性没有改变,提示突触传递缺陷主要是由神经元缺陷而非肌肉缺陷引起(图1D)。rft-1Y290C线虫的线粒体数量和ATP水平与对照组相比没有变化(图1E、F)。与对照组相比,rft-1Y290C线虫的运动能力有轻微但显著的降低(图1G),排便周期长度缩短,提示其运动功能受损,肠道运动功能异常(图1H)。
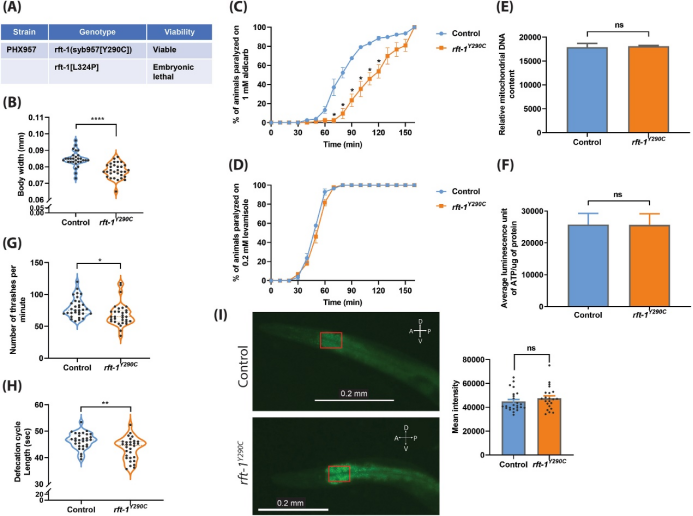
图1. 秀丽隐杆线虫作为研究RTD功能和行为的模型。
3、研究结论
该研究表明,C. elegans rft-1Y290C模型再现了RTD 患者的一些临床特征,例如突触传递缺陷和运动功能障碍。该模型为研究 RTD 的发病机制和开发新型治疗策略提供了重要的动物模型。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304223003537
引用这篇文章:
Narayanan RK, Perez-Siles G, Marzec KA, et al. C. elegans model of riboflavin transporter deficiency (RTD) disorder reveals deficits in synaptic transmission and movement. Genes Dis. 2024;11(4):101071.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#秀丽隐杆线虫# #核黄素转运蛋白缺陷#
45