Haematologica:揭示CD9对儿童B细胞前体急性淋巴细胞白血病(BCP-ALL)的新功能
2024-08-22 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
研究揭示CD9在儿童B细胞前体急性淋巴细胞白血病(BCP-ALL)中的新功能,特别是在调节糖皮质激素(GC)敏感性方面的关键作用。
急性淋巴细胞白血病(ALL)是儿童最常见的血液恶性肿瘤,约占儿童癌症的四分之一。尽管在多数发达国家ALL生存率已超过85%,但耐药性的出现使复发患儿的预后仍然不容乐观。糖皮质激素(GCs)是儿童ALL缓解诱导的核心药物,包括泼尼松(Pred)和地塞米松(Dex)。虽然临床前研究已报道多种ALL对GCs耐药的机制,但进一步探索GC耐药的新机制仍然紧迫。
近日,Kam Tong Leung 团队在 Haematologica 上发表题为 CD9 shapes glucocorticoid sensitivity in pediatric B-cell precursor acute lymphoblastic leukemia 的文章,揭示CD9在儿童B细胞前体急性淋巴细胞白血病(BCP-ALL)中的新功能,特别是在调节糖皮质激素(GC)敏感性方面的关键作用。通过一系列体外实验、临床分析和机制探索,该研究不仅确立了CD9作为预测GC治疗反应的有价值生物标志物,还为克服GC耐药性提供了新的见解和潜在的治疗策略。

研究首先通过体外药物敏感性分析揭示了CD9表达与糖皮质激素敏感性之间的密切关系。发现CD9高表达(CD9high)的细胞系对糖皮质激素(泼尼松和地塞米松)高度敏感,而CD9低表达(CD9low)的细胞系则表现出耐药。这一结果在18个诊断为BCP-ALL的患者原代细胞中得到进一步验证,其中CD9+淋巴母细胞对泼尼松和地塞米松的敏感性显著高于CD9-病例。
为了验证这一发现的临床相关性,研究团队对182名接受7天泼尼松预处理并随后进行多药化疗的儿童BCP-ALL患者进行了回顾性分析。结果显示,CD9阴性与泼尼松反应不佳显著相关。具体而言,19.4%的CD9-患者表现出较差的泼尼松反应,而CD9+患者中这一比例仅为6.2%(P=0.02)。值得注意的是,泼尼松反应不佳且为CD9-表型的患者中,年龄较大、男性、白细胞计数较高以及BCR-ABL1易位的比例显著增加。多变量分析进一步确认,CD9阴性是泼尼松反应不佳的独立预测因素。
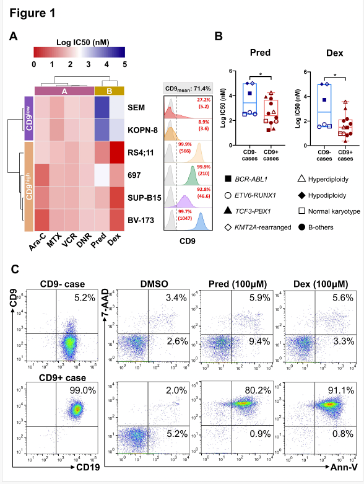
CD9低表达的BCP-ALL细胞对糖皮质激素表现出更强的耐药性
为了从功能水平验证CD9与GC敏感性的关联,Kam团队采用了功能获得和功能丧失的方法。在CD9low细胞中过表达CD9显著提高了对泼尼松和地塞米松的敏感性,而在CD9high细胞中敲除CD9显著降低了对这些药物的敏感性。这些发现强调了CD9在调节BCP-ALL细胞对糖皮质激素敏感性中的重要作用,表明CD9表达可作为预测患者对糖皮质激素治疗反应的有价值生物标志物。
进一步探索CD9调节GC敏感性的机制时,研究人员发现尽管CD9与糖皮质激素受体(NR3C1)存在物理相互作用,但CD9并不影响NR3C1的表达、磷酸化或细胞核转位。CD9high和CD9low细胞系中NR3C1蛋白均有广泛表达,且在患者样本中CD9+和CD9-之间的NR3C1蛋白表达也无显著差异。此外,NR3C1 mRNA表达在CD9+和CD9-病例之间无差异,且不与CD9 mRNA水平相关。GC诱导的NR3C1磷酸化在CD9low和CD9high细胞中均能正常进行,NR3C1在GC刺激下的细胞质-细胞核转位在对照和CD9过表达细胞中均表现良好。这意味着CD9与NR3C1相互作用,但不影响其基本功能动态,表明CD9可能通过其他机制影响GC敏感性。
为进一步识别与GC敏感性相关的下游基因特征,研究团队进行了RNA测序。结果显示,CD9high细胞中差异表达基因(DEGs)数量更多(110 vs. 82)。尤其是三个已知的GC响应基因(ZBTB16、TSC22D3和BCL2L11),这些基因在CD9high细胞中的诱导程度显著更高。这意味着CD9增强了GC响应基因的转录,尽管NR3C1的核转位正常,CD9high细胞表现出更强的GC诱导基因转录活性。
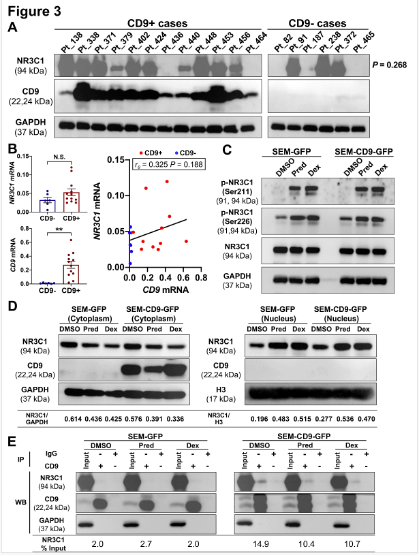
尽管CD9与糖皮质激素受体NR3C1有结合作用,但这种结合并不影响NR3C1的表达、磷酸化过程或其向细胞核的转位
考虑到之前研究表明MAPK通路的持续激活与糖皮质激素耐药性相关,Kam团队进一步探索了MEK抑制剂trametinib与GCs在CD9+和CD9- BCP-ALL细胞中的协同作用。他们在体外细胞实验和动物模型中发现,trametinib在CD9low细胞中与GCs表现出强协同作用(联合治疗显著减少了白血病负荷),而在CD9high细胞中却表现为拮抗作用。进一步研究发现,CD9high细胞可能通过STAT通路的补偿性激活逃避这种联合治疗,这一发现表明加入JAK抑制剂如Ruxolitinib可能对CD9high病例具有潜在益处。
总的来说,该研究揭示了CD9对儿童急性淋巴细胞白血病(BCP-ALL)的新功能,并提供了克服GC耐药性的新见解。具体而言:
-
CD9在调节糖皮质激素敏感性中的作用:研究发现CD9在调节BCP-ALL细胞对糖皮质激素的敏感性中起重要作用。CD9高表达与GC高敏感性相关,而CD9低表达则与GC耐药性相关。
-
CD9调节GC敏感性的分子机制:尽管CD9与糖皮质激素受体(NR3C1)存在物理相互作用,但研究发现CD9并不直接影响NR3C1的表达、磷酸化或细胞核转位。相反,CD9通过增强GC响应基因的转录来调节GC敏感性。这一发现为理解CD9如何影响GC敏感性提供了新的视角。
-
CD9表达与MEK抑制剂Trametinib的协同作用:研究结果显示,CD9表达水平影响MEK抑制剂Trametinib与糖皮质激素的协同效果。在CD9低表达细胞中,Trametinib与GCs表现出强协同作用,而在CD9高表达细胞中则表现为拮抗作用。这一发现为基于CD9表达水平设计个性化治疗方案提供了新思路。
-
潜在的治疗策略:研究发现CD9高表达细胞可能通过STAT通路的补偿性激活逃避Trametinib和GCs的联合治疗,提示加入JAK抑制剂如Ruxolitinib可能对CD9高表达病例具有潜在益处。
这些研究成果不仅深化了我们对BCP-ALL分子机制的理解,也为个性化治疗方案的设计提供了理论基础。通过在治疗方案中结合MEK抑制剂和JAK抑制剂,可能提高对GCs耐药的BCP-ALL患者的治疗效果。这些发现为克服儿童急性淋巴细胞白血病治疗中的GC耐药性提供了新的见解,具有重要的临床应用前景。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#急性淋巴细胞白血病# #CD9#
76