【柳叶刀血液学】综述:加速和优化CAR-T细胞制备,为患者提供更好的产品
13小时前 聊聊血液 聊聊血液 发表于上海
本文重点关注加速CAR-T细胞制备所需的进展(包括床旁手段),重点是提高治疗效果和快速周转时间及简化质控程序,以充分发挥CAR-T细胞治疗的临床潜力。
加速CAR-T细胞制备
自体CAR-T 细胞治疗改变了 B 细胞白血病和淋巴瘤的治疗,也越来越多地在其他血液肿瘤、实体瘤和自身免疫性疾病中进行探索。然而扩展至新适应症将给现有 CAR-T 细胞制备设施带来沉重负担,以满足不断增加的全球需求,后勤障碍可能限制其更广泛的应用。由于临床预后可能在很大程度上受到自体材料和制备过程的影响,因此改善产品表型的策略至关重要。简短的制造工艺的优势在于可以更快地将产品带给患者,同时避免与长期体外制备相关的高度分化和CAR-T 细胞表型耗竭。
历史上CAR-T细胞的制备策略依赖于调整培养基成分和选择分化程度较低的细胞亚型,但自2020年以来,该领域已转向减少扩增(reduced-expansion)的方案、非活化(no-activation)的方案和床旁(point-of-care)制备。这些方法具有快速周转的优点,同时保持较少分化和耗竭的表型,从而导致了超快速的制备方法,甚至包括使用体内制备来消除体外操作。
《The Lancet Haematology》近日在线发表综述,重点关注加速CAR-T细胞制备所需的进展(包括床旁手段),重点是提高治疗效果和快速周转时间及简化质控程序,以充分发挥CAR-T细胞治疗的临床潜力。

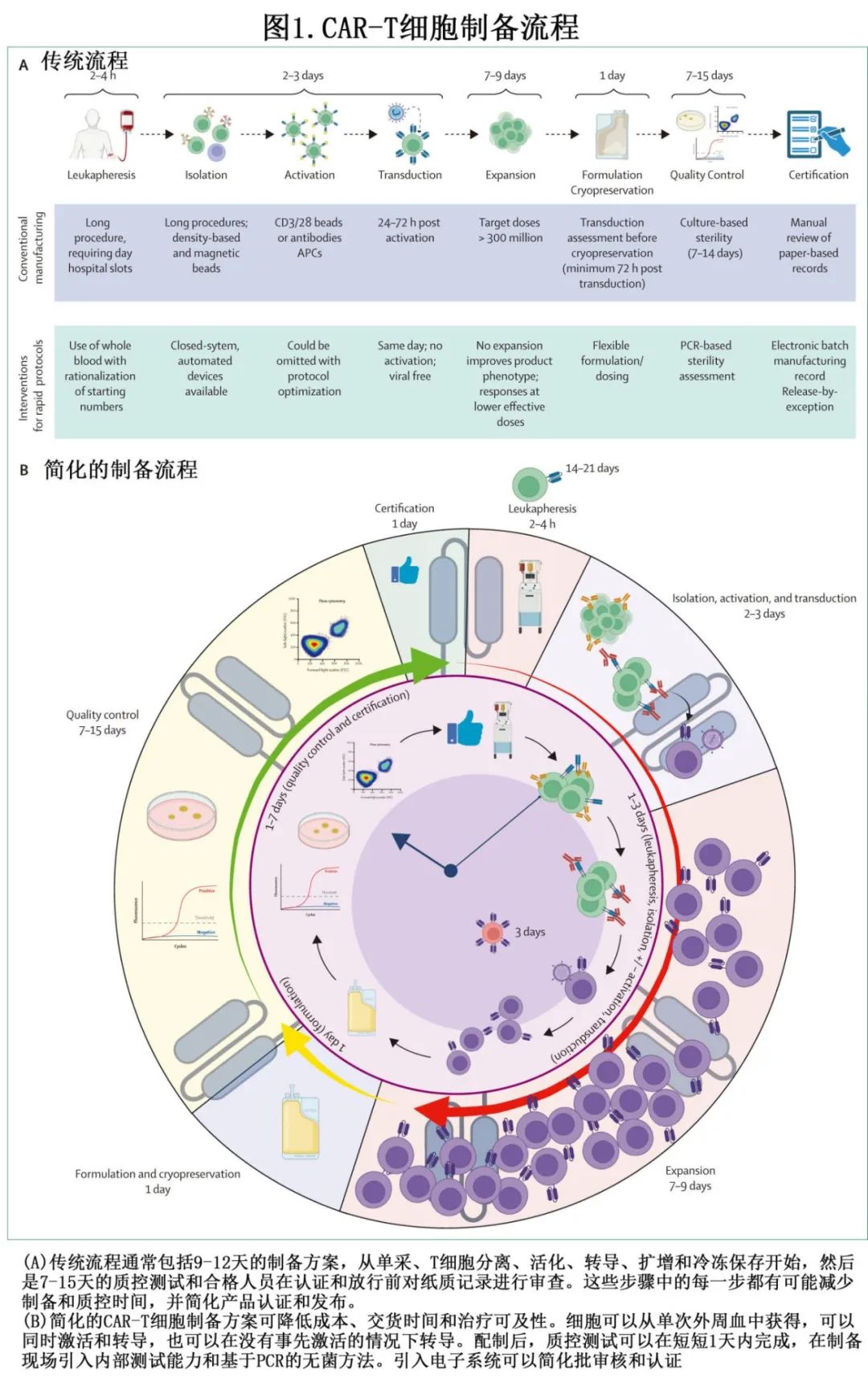
CAR-T 细胞制备工艺通常需要3-6周(图1)。该过程从患者白细胞单采开始,作为起始物料的来源,即CD4+ 辅助T细胞和CD8+细胞毒 T 细胞。后续实验室工作流程包括细胞选择以实现 T 细胞富集;T细胞活化;诱导 CAR 表达的工程步骤;1-3周的体外细胞扩增;随后进行最终配制、冷冻保存、质控分析和转移至临床中心。目前 FDA 批准的 CAR-T 细胞疗法的制备工艺大体相似。当前 CAR-T 细胞产品制备方案的问题之一在于平均静脉-静脉时间为3-6周,而部分患者的疾病进展使其无法安全进行 CAR-T 细胞治疗;据报告接受白细胞单采的 LBCL 患者中33%未输注 CAR-T 细胞。对于接受 CAR-T 细胞治疗的患者,另一个问题在于相当大比例的患者无应答或复发,尽管基础疾病是主要原因,但 CAR-T 细胞产品本身也具有相当大的作用。体内植入、扩增和持久性差通常与临床反应欠佳相关,并且通常可归因于患者的白细胞单采质量差及制备方案(优先考虑T细胞扩增而非健康度)。
良好的 CAR-T 细胞产品(即更可能产生临床应答的产品)包含哪些因素并不明确,但对临床试验给药产品的回顾性分析表明,尽管患者和 CAR 因素(例如年龄、基础疾病、既往治疗或 CAR 设计)导致产品存在差异,但 CAR-T 细胞产品表型似乎在临床疗效、毒性和体内 CAR-T 细胞持久性中发挥关键作用。CAR-T细胞效价测定(即测量产品在体内性能的预测工具)可能会补充产品表型数据,以增强对输注前良好产品组成因素的理解。该综述讨论了快速 CAR-T 细胞制备的当前和未来创新(图1),以提高产品质量、改善意向治疗和改善患者预后的潜力;重点关注可以加速和简化的制备步骤,以提高细胞治疗的可及性。关于非病毒基因递送和现货型异基因CAR-T可参考Chen S, van den Brink MRM. Allogeneic “off-the-shelf” CAR T cells: challenges and advances. Best Pract Res Clin Haematol 2024;37: 101566和Balke-Want H, Keerthi V, Cadinanos-Garai A, et al. Non-viral chimeric antigen receptor (CAR) T cells going viral. Immunooncol Technol 2023; 18: 100375。
采集患者起始材料
大多数 CAR-T 细胞生产商使用通过未刺激的白细胞单采获得自体患者材料,并采用针对生产商规定的 CD3 T 细胞靶标的标准门诊方案。有限的自体白细胞单采能力是阻碍 CAR-T 疗法可用性的重要瓶颈,该操作为资源密集型(例如工作人员、床位、机器空间和实验室处理)、昂贵和侵入性,通常需要中心静脉通路。此外约有74%的患者在进行白细胞单采时花费的时间长于所需的时间,超过成功制备 CAR-T 细胞所需的时间。在一刀切“one-size-fits-all”单采的基础上,O’Reilly等设计了一种算法,根据白细胞单采前的血液结果(包括淋巴细胞计数),可患者特异性地预测白细胞单采所需的时间。该算法的目的是在可行的情况下缩短白细胞单采的持续时间,以促进更好地使用单采单位资源和增加容量(即在一天内提供更多的单采槽)。
随着 T 细胞活化和扩增技术的改进,完全无需进行白细胞单采,并使用外周血作为 CAR-T 细胞制备的起始材料。在健康供者中,单次抽血(最低50 mL)可获得成功的 CAR-T 细胞制备。尽管该结果需要使用患者(尤其是重度经治患者)的血液进行验证以确认可行性,但或可将 CAR-T 细胞的可及性转化至扩大的患者人群。
活化前的细胞选择
由于 T 细胞质量和产量差导致的制备失败并不罕见。建议在制备前对不需要的或免疫抑制性细胞亚群(即血小板、红细胞、单核细胞、恶性B细胞、髓源性抑制细胞和调节性T细胞)进行靶细胞预选(Target cell preselection)或消耗,以提高CAR-T细胞的功能和效力。
CD4+和CD8+ CAR-T细胞群对于扩增和发挥功能都至关重要,大多数市售产品都为CD4+ 和CD8+ 细胞的混合物,且患者之间各不相同;但lisocabtagene maraleucel除外,基于临床前研究显示出优越的功能,其以固定的 CD4-CD8 比例给药,通过制备和输注单独的CD4+和CD8+ CAR-T细胞产品实现,但对制备成本和复杂性有明确的影响。
越来越多的证据支持患者白细胞单采中早期 T 细胞的存在与 CAR-T 细胞产品临床应答及持续性之间具有相关性。分化程度较低的 T 细胞(图2;即幼稚 T 细胞 [TN]、干细胞记忆 T 细胞 [TSCM] 和中央记忆 T 细胞 [TCM])比其效应对应物(即效应记忆 T 细胞 [TEM]、效应 T 细胞 [TE]、和效应记忆 CD45RA 再表达 T 细胞 [TEMRA])具有更高的扩增和细胞因子分泌潜力。
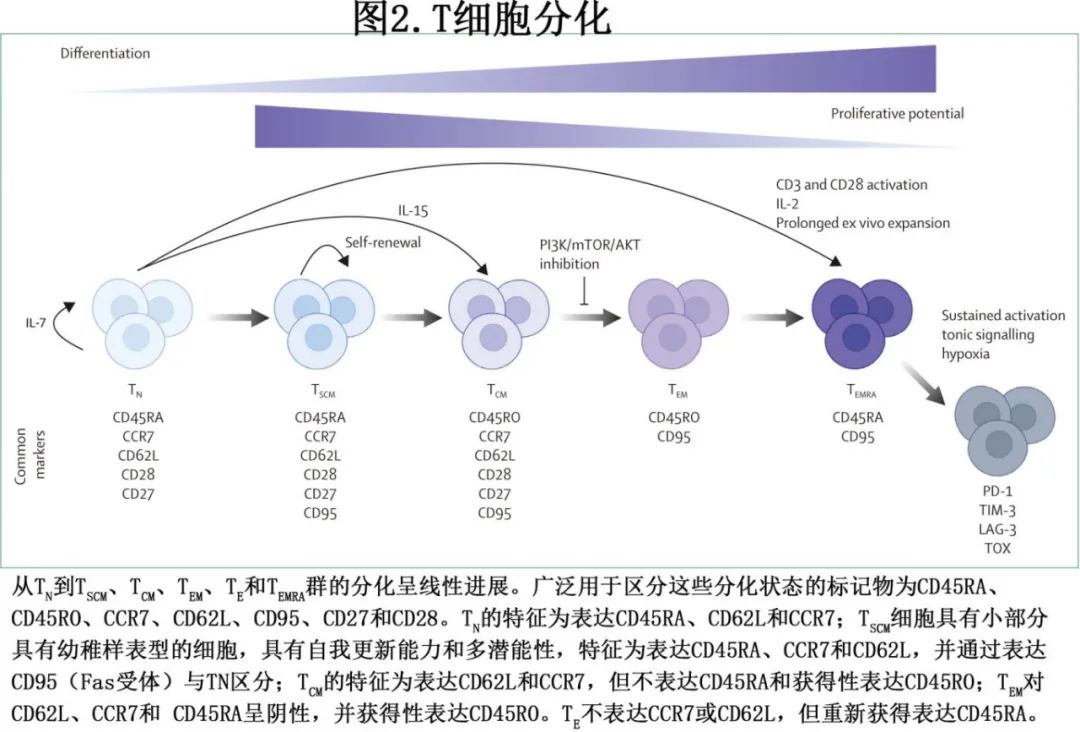
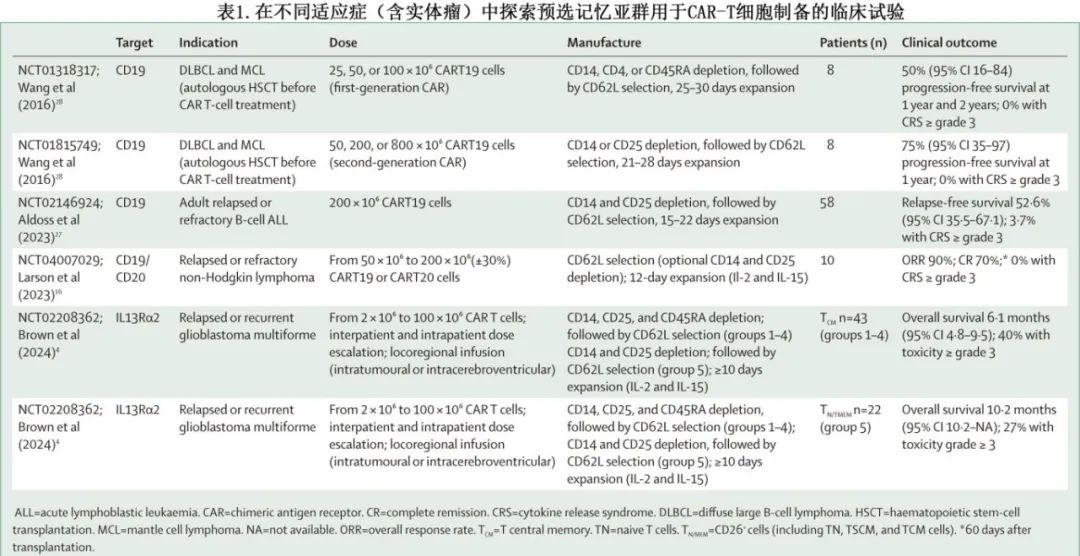
回顾性分析表明,TSCM群体在持久抗肿瘤反应中起着重要作用,并且由TSCM选择的起始材料制备的CAR-T细胞产品在临床前模型中显示出较低剂量下的抗肿瘤活性,并且在临床中具有更好的体内扩增和安全性。而由富集 TCM T 细胞的起始材料 (CD45RA-CD62L+) 制备的 CAR-T 细胞产品显示出低毒性,但未显示出更好的 CAR-T 细胞植入或持久性,需要进一步评价。目前有多项临床试验评估预选分化程度较低的 T 细胞用于 CAR-T 细胞制备的效果(表1)。尽管预选的潜在优势已在前面列出,但缺点可能包括成本高、体外细胞处理增加和T 细胞群频率低(重度经治患者中尤其稀少,制备商可能难以达到目标 CAR-T 细胞剂量)。
体外细胞活化和培养
目前通过 CD3 和 CD28 途径和促增殖细胞因子(例如IL-2)长期培养实现体外 T 细胞活化,其主要问题在于早期记忆 T 细胞表型的丧失以及 T 细胞代谢的改变和体内功能受损。T 细胞活化后,效应 T 细胞利用有氧糖酵解,记忆 T 细胞利用线粒体生物合成和脂肪酸代谢,可通过选择 CAR-T 细胞内结构域进一步增强(例如CD28ζ内结构域 CAR表现出糖酵解和效应特征,而41BBζ内结构域 CAR使用脂肪酸代谢并显示记忆表型)。
除了诱导过度分化,长期体外制备的另一个问题在于诱导 CAR-T 细胞耗竭,表现为免疫检查点(如PD-1、LAG-3、TIGIT和TIM-3)上调,可对 CAR-T 细胞功能产生负面影响,通常发生在重度经治患者。机制包括耗竭相关基因(如 TCF7 和RUNX1)中 DNA 甲基化改变和强直性 CAR 信号转导(即无靶抗原情况下的信号转导)。
调整培养基组成可改善 CAR-T 细胞的表型,即IL-7和 IL-15 广泛优于IL-2,以防止分化。补充 IL-21 也可增强分化程度较低的 T 细胞表型的富集和扩增,促进体内疗效的提高。
为了使 CAR-T 细胞产物向记忆表型倾斜并避免 T 细胞耗竭,一些研究小组在 CAR-T 细胞制备过程中使用 T 细胞信号通路小分子抑制剂(例如PI3K-AKT)。有研究证实,AKT 抑制可使富集 TSCM或富集TCM的 CAR-T 细胞产品在白血病临床前模型中具有优越的抗肿瘤活性,且目前伦敦大学学院的数个 CAR-T 细胞制备工艺中已使用药品生产质量管理规范级别的 AKT 抑制 (NCT04795882)。有研究小组表明,酪氨酸激酶抑制剂达沙替尼可以可逆性抑制近端 CAR 信号激酶,并阻止或逆转强直性信号下的 CAR-T 细胞耗竭;达沙替尼目前正在 CAR-T 细胞临床试验中作为制备改良进行测试。
其他研究小组利用 CAR T 细胞,改造为分泌免疫刺激细胞因子,以增强产品效力。在临床前模型中,工程化 IL-18 在体内具有优越的抗肿瘤活性和 CAR-T 细胞增殖。在CD19-CAR–IL-18首次用于B 细胞恶性肿瘤成人患者(包括对早期 CAR-T 细胞治疗无应答的患者)的人体研究 (NCT04684563) 中,仅在3天内便制备CAR-T 细胞,并以3-30×106个细胞的剂量给药;11例患者中3个月总缓解率为82%,完全缓解率为55%。与之类似,在某文章的预印本中,已探索分泌 IL-15 以改善 CAR 的持续性,初步临床报告表明,分泌 IL-15 的抗 GCP3 的 CAR-T 细胞在低剂量(3×107细胞/m²)下在肝细胞癌患者中显示扩增和临床应答增加。
减少扩增或非扩增快速制备方案
鉴于长期培养对T 细胞表型和功能的负面影响,以及使患者更容易获得 CAR-T 细胞产品的需求,缩短或完全省略 T 细胞扩增的快速制备方案是临床研究的优先手段。Ghassemi等的早期临床前工作表明,将体外培养时间从9天缩短到3-5天,可显著改善 CAR-T 细胞记忆表型和体外功能。在免疫缺陷 B 细胞白血病异异基因移植小鼠模型中,与9天内制备的产品相比,在较低剂量下,第3天收获的非扩增制备的 CAR-T 细胞产品可产生持久的抗肿瘤反应,且 CAR-T 细胞扩增和体内持久性更佳。
在临床中,目前正在研究多种减少扩增或不扩增 CAR-T 细胞制备方案(表2),主要为B 细胞肿瘤。其中部分工作是在商业 CAR-T 细胞,其中制造修改是专有的,向公众提供的工艺改进细节很少。例如,凯特宣布 FDA 已批准 axicabtagene ciloleucel 的5天制备方案,将静脉-静脉给药时间缩短至14天;快速制备的产品与 axicabtagene ciloleucel 具有临床可比性,且在供应美国市场的商业生产工厂实施了缩短工艺。
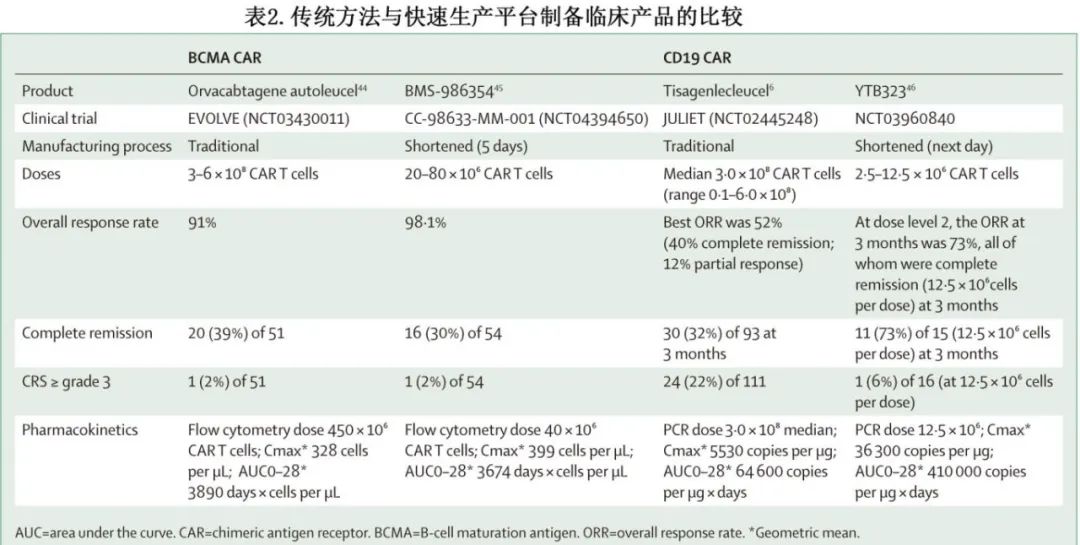
BMS还开发了BCMA CAR-T 细胞产品 BMS-986354 的5-6天 NEX-T 快速制备工艺,含有与 orvacabtagene autoleucel 相同的全人源 CAR 结构。一项 I 期临床试验比较了剂量为20–80x106 CAR-T 细胞的 BMS-986354 与剂量为50-600x106 CAR-T 细胞的orvacabtagene autoleucel(NCT04394650)。药代动力学分析显示,尽管 BMS-986354 的给药剂量是 orvacabtagene autoleucel 的1/11,但两种产品的峰浓度 (Cmax) 和28天扩增(0–28天曲线下面积)相当,表明 NEX-T 产品在体内具有高度增殖。定性分析显示,BMS-986354产物富集TN、TSCM和 TCM 表型,并且在检测抗原特异性TNFα、INFγ和 IL-2 分泌的效价测定中表现优于 orvacabtagene autoleucel。NEX-T制备工艺也用于BMS-986353,后者是一种 CD19 CAR-T 细胞产品,与lisocabtagene maraleuce具有相同的 CD19CAR 结构。BMS-986353正处于早期临床试验阶段,包括复发性或难治性 B 细胞淋巴瘤 (NCT04231747) 和自身免疫性疾病 (NCT05869955) 。
通过引入进一步的步骤变更,目前正在开发次日(next-day)CAR-T 细胞制备方案,早期临床数据表明,与常规制备产品相比,较低剂量下具有良好的安全性特征和增强的疗效。例如Gracell Therapeutics设计了22–36 hF-CAR制备工艺,即 T 细胞富集和活化;在添加 IL-2 的培养基中进行慢病毒转导;在非扩增步骤的情况下进行采集、纯化和冷冻保存。CD19 靶向 F-CAR-T 细胞与抗原表达靶标的临床前分析显示,共培养9天后,体外增殖和细胞毒性增强,细胞周期相关基因表达增加,凋亡相关基因表达减少,表型分化或耗竭减少。在体内,F-CAR T细胞在免疫缺陷 B 细胞白血病异基因移植小鼠模型中显示肿瘤控制改善。
在一项 I 期临床试验 (NCT03825718) 中,25例 B 细胞急性淋巴细胞性白血病儿童和成人患者(20例年龄大于14岁,5例年龄小于14岁)成功制备并输注 F-CAR-T 细胞,剂量为3.0–15.6 ×104 CAR-T细胞/kg。F-CAR-T细胞广泛安全,24%的患者报告3级细胞因子释放综合征,28%的患者报告4-5级神经毒性。25例患者中23例 (92%) 达到可测量残留病阴性完全缓解。23例患者中20例 (87%) 在 F-CAR-T 细胞治疗后3个月内接受异基因干细胞移植,20例患者中的15例 (75%) 在中位734天时无疾病。23例患者中有3例 (13%) 未接受异基因干细胞移植,这3例患者中有2例在F-CAR-T 细胞治疗后10个月仍处于完全缓解状态。
诺华也开发了 T-Charge 快速制备平台,该平台能够在48h内富集、活化、转导和配制 T 细胞。尽管具体制备细节是专有的且仍未披露,但在该平台上制备的 CAR-T 细胞产品的临床试验正在 I 期临床试验中进行测试。YTB323是一种 CD19 靶向产品,与 tisagenlecleucel 具有相同的 CAR 转基因,目前正在复发性或难治性 LBCL 患者的 I 期试验 (NCT03960840) 中进行评估,剂量比 tisagenlecleucel 低10-50倍。在剂量水平2下,YTB323显示出优越的总缓解率 (73%),而之前在 JULIET tisagenlecleucel 研究中最佳总缓解率为52%。尽管到目前为止仅评价了少量患者,但这些结果表明快速制备 CAR-T 细胞可能对临床结局产生重大影响。
同样,PHE885(一种T-Charge 制备的靶向 BCMA 的 CAR-T 细胞产品)正在多发性骨髓瘤 (NCT04318327) 中以2.5–20 ×106 CAR-T细胞的剂量进行评估。由于快速制备,46例患者中仅13例 (28%) 需要桥接治疗。所有剂量水平的总缓解率为98%(42/43),其中10×106 CAR-T细胞剂量的完全缓解率为42%(18/43)。
正在评估的其他快速制备平台包括超快制备平台 (ultrafast production platform,UF-CAR),其设计用于在 24h 内制备CAR-T 细胞产品,以及 Kyverna Therapeutics 开发的用于自身免疫性疾病的 Ingenui-T 平台。尚未报告 UF-CAR 的1期试验,但临床前工作表明,与传统制备产品相比,超快 BCMA CAR 在免疫缺陷鼠骨髓瘤模型中具有更好的疾病控制。
Ingenui-T可在 72h 内单次抽取约 200 mL 外周血制备CAR-T 细胞,100mL血液可制备约40×106 CAR-T 细胞剂量。数据表明,与常规制备产品相比,Ingenui-T可保留早期记忆表型,并提供更强效和持久的溶细胞活性。
多个临床前和临床报告证实,对于减少扩增或非扩增制备方案,可制备高效价和高扩增产品,其在低于传统方案的剂量下仍有效。但需要注意,如果对现有 CAR-T 细胞疗法实施快速制备,考虑到上述效应,应重新评价剂量,其与毒性和疗效相关。
非活化快速制备方案
在常规 CAR-T 细胞制备方案中,T细胞活化是逆转录病毒转导和提高静止 T 细胞慢病毒转导效率的必要步骤。然而T细胞活化可触发分化和扩增,并最终导致不佳的 CAR-T 细胞产物表型和功能。为了避免这种结果,临床前研究已经测试了通过细微方案调整实现的非活化(No-activation)制备方案,如优化培养容器表面积体积比,添加核苷,阻断与抵抗病毒感染相关的酶以促进稳定的转基因表达(尽管没有 T 细胞活化)。在免疫缺陷 B 细胞白血病异异基因移植小鼠模型中对非活化 CAR-T 细胞进行临床前试验,可在第17天实现持久疾病控制。从广义上讲,这些数据表明,非活化 CAR-T 细胞制备可改善 CAR-T 细胞表型和功能,防止终末分化和复制性衰老。然而这些方案在临床制备环境中的可行性仍有待评价。
放行检测、效价和认证
尽管缩短的 CAR-T 细胞制备方案已经明显使患者更早期使用 CAR-T 细胞治疗,并且可能使用更好的产品,但 CAR-T 细胞产品放行质控的开发速度还不够快,包括产品鉴别、纯度、安全性和效价的时间依赖性检测仍会导致延迟(图3)。
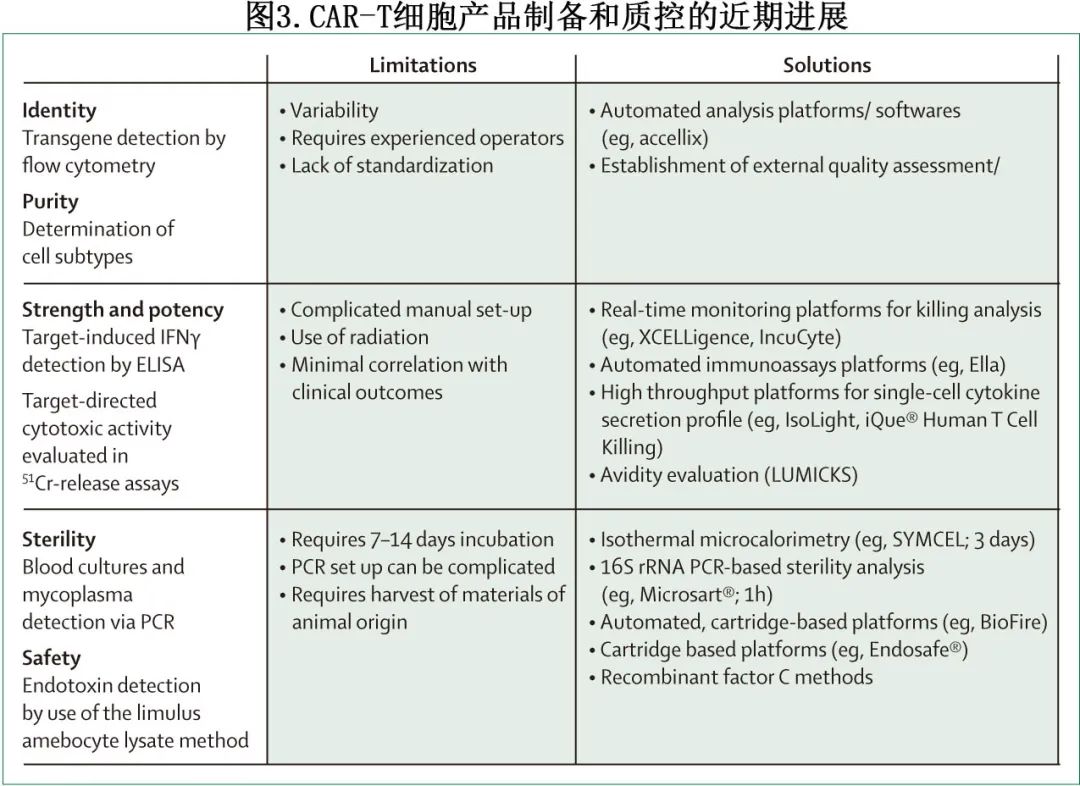
重要的是,随着需要在基因转移步骤后短时间内配制产品的快速方案的出现,并且通常是新鲜输注,安全性评估也成为重要问题。必须证明最终制剂中不存在残留病毒载体,并且必须制定方案以确保在较短的制备时间范围内充分去除任何工艺相关杂质。此外,由于非整合序列和假转导的共同影响,在基因转移后早期完成评估 CAR-T 细胞表达和病毒拷贝数的基本分析具有挑战性。
当前基于培养的细菌和真菌检测方法要求从制备工艺的最后一个开放步骤开始孵育7-14天,这意味着产品在制备结束后约2周内不能放行,需等待安全性检测结果。使用基于检测盒的自动化仪器进行基于 PCR 的细菌污染检测是基于培养方法的更快、更可靠的替代方法。用于快速微生物检测的机器学习工具与 16S 和 18S 扩增子的长读取测序可以检测细菌污染,检测限为10菌落形成单位/mL。证明与药典方法具有相似的性能并围绕无菌保证(sterility assurance)调整监管框架,对于实现快速检测方法的广泛应用至关重要。
当转基因表达在细胞表面达到稳定水平时, 可对CAR-T 细胞数量进行精确定量(多通过流式细胞术),并应尽量避免过早评价,因结果可能被假转导所混淆。为避免延迟,部分快速制备方案在冻存后进行 CAR 表达评估,方法是将产品样品在培养物中保持约3天,以进行质控。
CAR-T 细胞效价测定是产品放行监管机构的强制要求,通常涉及靶标导向细胞毒性的终点评估或INFγ分泌。捕获扩展动力学数据的分析(例如实时荧光或基于阻抗的分析)可能提供更多信息。其他参数,如 CAR 亲合力(即 CAR 与靶标之间的免疫突触强度)和多功能性(即单细胞、多重细胞因子分泌)可能构成重要的效力变量,但需要进一步验证。在实体瘤中效价检测可能更加复杂,其决定因素为临床疗效可能包括难以测量的因素,如 CAR-T 细胞迁移和肿瘤微环境的影响。
CAR-T细胞产品认证和放行主要是手动过程,可通过电子系统加速,可提高质量并减少错误,但这些系统需要稳健的数据安全,符合监管要求,并具有灵活性以允许过程调整。
近患者(Near-patient)制备和新鲜输注
集中制备的后勤问题较为复杂,是 CAR-T 细胞治疗中值得注意的问题。床旁(Point-of-care) CAR-T 细胞的制备可使 CAR-T 细胞治疗更快地应用于患者,据报道,非冻存产品的静脉-静脉时间为7-14天。在由 Lentigen 申办的两项研究中,CD19CAR-T细胞产品在两个不同的研究中心根据12天 CliniMACS Prodigy 方案制备(后缩短至8天),新鲜给予 B 细胞非霍奇金淋巴瘤成人患者(18岁以上)和 B 细胞急性淋巴母细胞白血病儿童和年轻成人患者(3个月至25岁);中位静脉-静脉给药时间为13天,大多数入组患者可接受治疗,毒性和缓解率与 CD19CAR-T 细胞文献中观察到的相似。
Shah 等报告了一项在复发性或难治性患者中评估双靶点 CD19 和 CD20 CAR-T 细胞 (LV20.19) 治疗B 细胞非霍奇金淋巴瘤和慢性淋巴细胞白血病的1期床旁研究的结果。基于CliniMACS Prodigy制备时间为14天,26例患者中22例 (85%) 达到目标剂量,14例患者接受新鲜产品(静脉-静脉时间15天),7例接受冻存给药。在制备第8天进行过程中质量检测(例如无菌性、CAR表达或效价),并在制备第10天开始患者清淋化疗。与冻存产品相比,非冻存产品与显著更高的CAR-T细胞扩增峰值相关,且毒性无差异。在所有剂量浓度下,第28天时22例可评价患者中的18例 (82%)达到总缓解;尽管无统计学差异,但接受新鲜产品 (14/15[93%]) 与冷冻保存产品 (4/7[57%]) 治疗的患者相比总缓解率有所改善。然而部分患者由于临床并发症(如发热或感染)必须给予冷冻保存剂量;因此可能存在被外在因素所混淆的临床反应和 T 细胞扩增差异。另一项 I/II 期研究已启动,以在复发性或难治性套细胞淋巴瘤患者中检测调整的制备工艺(缩短至8天)(NCT04186520)。
该方案的后续发展产生了两项非随机、多中心 II 期试验,一项在美国 (Daly-2-USA),另一项在欧盟 (Daly-2-EU),在复发性或难治性弥漫性大 B 细胞淋巴瘤患者中比较LV20.19(zamtocabtagene autoleucel) 与标准治疗。在这些试验中,CAR-T细胞产品是新鲜给药,制备时间为12天,静脉-静脉时间为14天。
GLPG5101制备的用于 B 细胞肿瘤的床旁 CD19CAR-T 细胞产品的 Atalanta-1 1/2 期试验中,静脉-静脉时间为7天,表明非冻存 CAR-T 细胞产品可保留记忆表型。产品在体内耐受、扩展和持续良好,总缓解率为85%(13例患者中的11例),完全缓解率为69%(9例患者)。
床旁制备的其他案例包括ARI-001(第二代 CD19 CAR),其于2021年获得西班牙药品和医疗器械管理局的医院豁免批准。同样,在加拿大,CLIC-01(在3个不同学术中心制备的第二代 CD19 靶向CAR)已作为新产品成功检测并在2个医院中心分销 (NCT03765177)。
所有这些案例都强调了自动化制造平台的重要性,以标准化多个地点的操作,并减少动手操作时间。尽管大多数床旁研究使用CliniMACS Prodigy 平台,但为了提高和标准化制备能力,正在出现更多的解决方案,例如Lonza Cocoon。自动化的进展见综述(Dias J, Garcia J, Agliardi G, Roddie C. CAR-T cell manufacturing landscape-lessons from the past decade and considerations for early clinical development. Mol Ther Methods Clin Dev 2024; 32: 101250)。
随着床旁检测策略越来越广泛采用,实施机制以确保在多个不同研究中心制备的产品具有相似性至关重要。在这种情况下,质控的标准化至关重要,建议对分析检测的研究中心间性能进行连续评价;可能包括集中分发放行检测试剂盒和手册,但这些建议仍有待探索和报告。
虽然床旁制备可以加快患者获得 CAR-T 细胞产品的速度,但在更广泛的应用中仍存在许多障碍,例如需要熟练的即时劳动力、监测多个研究中心的制备活动以及定义床旁产品的质量保证(QA)、认证和发布的监管框架。可能的解决方案包括采用全自动平台,对临床医生和科学家进行床旁检测制备方面更专业的培训,并尽早与监管机构合作,以促进所需的技术变革,同时全程保持产品质量。克服这些障碍需要重大投资、政府层面的支持和监管监督的转变。
体内制备
体内靶细胞的选择性基因递送和遗传修饰的进展,为将 CAR-T 细胞制备带出实验室和带给患者创造了一个巨大的机会,即体内 CAR-T 细胞制备。一些研究组已经开发了编码 CD19CAR 的慢病毒载体,旨在特异性地靶向CD8α链。将靶向慢病毒载体直接注射到荷瘤人源化小鼠中,诱导CD8+ T细胞中 CAR 表达、强效的肿瘤导向细胞毒性,以及外周血、脾脏和骨髓中的扩增,症状与细胞因子释放综合征发作时观察到的症状一致。在专门靶向体内CD4+ T细胞的慢病毒载体中也观察到类似结果。Interius BioTherapeutics开发了INT2104,一种基于慢病毒的靶向CD7+ 细胞的递送系统,用于体内制备 CAR-T 细胞和 CAR NK细胞,在人源化小鼠模型和非人灵长类动物中的研究显示出促进 B 细胞再生障碍的疗效;最近在澳大利亚也批准了一项1期试验 (NCT06539338)。此处的安全性考虑包括非靶旁观者(bystander)细胞的体内基因传递风险,疗效考虑则在于宿主免疫细胞快速清除病毒的风险,尤其是在未进行清淋的患者中。载 mRNA 或载 pDNA 的脂质纳米颗粒可通过抗 CD3 抗体的修饰在体内定向作用于 T 细胞,并且可能是体内 CAR-T 细胞制备更安全的替代品,具有明显的多重编辑机会。携带 CAR 编码 mRNA 的脂质纳米颗粒的体内给药已在小鼠模型中进行试验,单次给药后显示肿瘤快速清除,CAR持续表达。
Hamilton等开发了膜源性包膜递送载体 (EDVs),包含慢病毒编码的转基因单独或与 Cas9 核糖核酸酶蛋白复合物结合的货物。EDV设计为表达靶向CD3、CD4和 CD28 的单链抗体片段(以实现高度特异性、联合 T 细胞靶向和活化能力),以及 VSVG 病毒包膜蛋白的突变形式。在人源化小鼠模型中,该工程 EDV 方法可在体内有效靶向编辑 T 细胞。核糖核蛋白编辑复合物的瞬时存在有望降低体内脱靶(off-target)基因编辑的风险。
体内 CAR-T 细胞制备是一个显著的潜在突破,可转化用于患者。为了进一步推进这一机会,科学工作者必须与监管机构合作,开始为这一颠覆性技术定义新的质量检测标准和适当的监管框架。
结论
通过操控细胞因子、T细胞信号传导的小分子抑制、缩短制备时间和剔除 T 细胞活化步骤,可能实现更高质量、更健康的 CAR-T 细胞产品。同时也正在评价加快 CAR-T 细胞产品制备、质量保证检测和放行的策略,与近患者的制备方法一起,或可克服 CAR-T 细胞交付的部分财务和后勤障碍,使该疗法可用于所有合格患者。
最后,如果可以解决安全性问题,则通过使用高度创新的体内递送系统消除体外细胞制备的需求,从而彻底改变 CAR-T 细胞制备领域。需要对这些方法进行系统的内部和串联评价,以确定未来 CAR-T 细胞产品制备的最佳路径和平台。
参考文献
Agliardi, G., Dias, J., Rampotas, A., Garcia, J., & Roddie, C. (2024). Accelerating and optimising CAR T-cell manufacture to deliver better patient products. The Lancet Haematology.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#CAR-T细胞# #快速制备方案#
3