中国青年学者一作,最新Nature系列综述:递送技术增强原位癌症疫苗!已回国效力,加盟中科大!
2024-07-06 BioMed科技 BioMed科技 发表于上海
为了增强肿瘤抗原的释放,作者讨论了化疗药物、纳米增敏剂和生物分子的递送。
原位癌症疫苗接种
成功的癌症免疫疗法需要激活癌症-细胞周期。该循环包括从癌症细胞释放肿瘤抗原、抗原呈递细胞(APC)如树突状细胞的抗原处理和呈递、肿瘤特异性细胞和体液免疫反应的产生以及肿瘤细胞的裂解,这增加了肿瘤抗原的释放并放大了该循环。然而,在大多数肿瘤中,癌症-免疫循环通常是缺乏的,这导致肿瘤细胞逃避免疫监测,并导致免疫疗法失败(免疫逃避)。原位癌症疫苗接种旨在通过使用改善肿瘤抗原释放(主要通过诱导肿瘤细胞死亡)、改善树突细胞对抗原的处理和呈递并因此产生肿瘤特异性T细胞反应的药物来恢复癌症-免疫循环。这些药剂被直接注射到肿瘤或其微环境中。成功激活癌症-免疫循环也可以诱导远端效应,由此,未经治疗的肿瘤的缩小与局部治疗区域内的肿瘤缩小同时发生。
具体而言,原位癌症疫苗接种是指利用肿瘤部位可用的肿瘤抗原诱导肿瘤特异性适应性免疫反应的任何方法。这些方法在治疗许多实体瘤方面前景广阔,许多候选药物正在进行临床前或临床评估,一些产品已经获得批准。然而,在开发有效的原位癌症疫苗方面仍然存在挑战。例如,肿瘤抗原从肿瘤细胞的不充分释放限制了免疫细胞对抗原的摄取;抗原呈递细胞的抗原处理不足限制了抗原特异性T细胞反应的产生;肿瘤的抑制性免疫微环境导致效应细胞的衰竭和死亡。
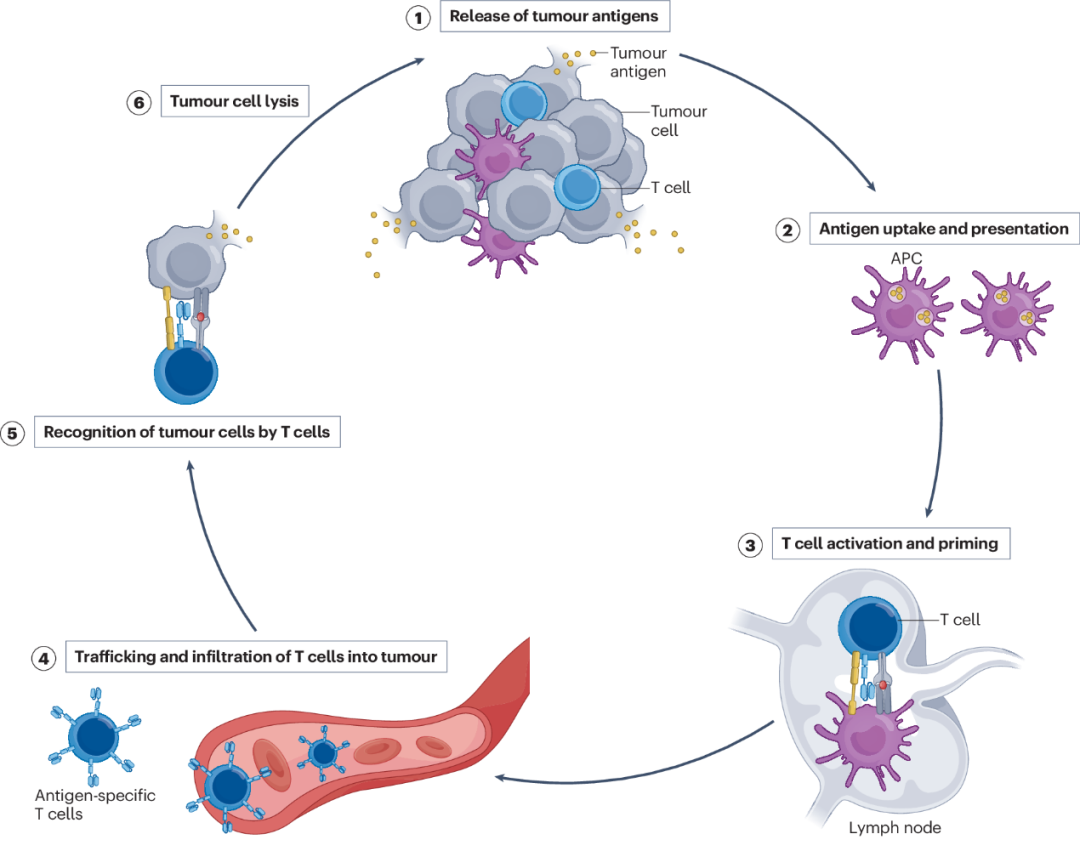
癌症-免疫周期
最新综述
合理设计的递送技术,如脂质纳米颗粒、水凝胶、支架和聚合物纳米颗粒,特别适合于通过将治疗剂靶向递送到肿瘤细胞、免疫细胞或细胞外基质来克服这些挑战。在这篇综述中,宾夕法尼亚大学Michael J. Mitchell等人讨论了有可能减少原位癌症疫苗各种临床障碍的递送技术。为了增强肿瘤抗原的释放,作者讨论了化疗药物、纳米增敏剂和生物分子的递送。为了增强肿瘤抗原的处理和呈递,作者专注于讨论PRR激动剂、病毒和细菌衍生材料的递送,以及激活免疫原性细胞死亡(ICD)或内源性逆转录病毒基因的试剂的递送。对于克服免疫抑制肿瘤微环境的方法,作者讨论了免疫检查点抑制剂、细胞因子和试剂的递送,以耗尽抑制性免疫细胞。最后,作者介绍了有前景的临床研究,并对这一新兴领域的未来提供了展望。相关综述以“Enhancing in situ cancer vaccines using delivery technologies”为题发表在Nature Reviews Drug Discovery。第一作者为Ningqiang Gong, Mohamad-Gabriel Alameh。

【文章要点】
一、增强肿瘤抗原释放
肿瘤抗原被限制在完整的癌症细胞的细胞膜内,因此诱导肿瘤细胞溶解和死亡是释放肿瘤抗原的有效策略。几种细胞死亡途径,如凋亡、坏死、自噬、焦亡和铁死亡,均可诱导含有肿瘤抗原的胞质成分泄漏到细胞外空间。这些细胞死亡可由化疗药物、物理方法(如X射线辐射、冷冻消融、微波消融以及光热和光动力学治疗方式)和生物分子(如溶瘤病毒或溶细胞肽)诱导。然而,这些诱导肿瘤细胞裂解的方法有几个局限性。例如,化疗药物不仅对肿瘤细胞有毒,对正常细胞也有毒,其在正常组织和细胞中的非特异性生物分布可诱导严重的不良反应。基于物理方法的治疗也因缺乏肿瘤特异性而受到限制。例如,高剂量的X射线照射诱导肿瘤细胞死亡和相邻正常细胞的大量杀伤。生物分子如溶瘤病毒受到活病毒的潜在安全风险和病毒特异性免疫反应对治疗结果的影响的限制。在本节中,作者讨论了递送技术如何解决这些问题,并通过原位癌症疫苗改善肿瘤抗原的释放(图1)。
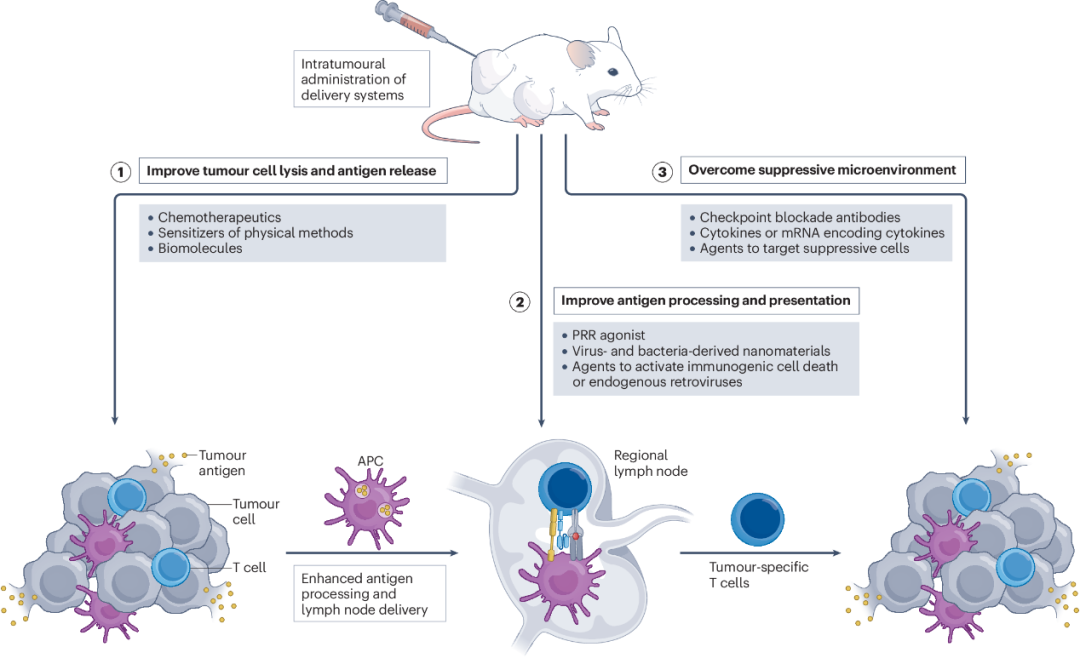
图1 利用递送技术改善原位疫苗接种效果
二、增强抗原处理过程
尽管递送技术可以增强癌症原位疫苗接种并改善肿瘤抗原的释放,但原发性肿瘤破坏后产生的抗肿瘤免疫力相对较弱。APC介导的肿瘤抗原处理和呈递可以通过激活PRRs如TLRs、RIG-I样受体、NOD样受体(NLRs)和C型凝集素受体来改善。PRR激活导致细胞内信号转导途径的刺激和炎症基因的表达增加,以改善抗原处理。在原位疫苗接种过程中,有两种主要策略可以增强先天免疫系统的激活。首先,可以使用PRRs的激动剂直接激活先天免疫。其次,可以使用靶向内在应激途径的试剂间接激活先天免疫,以诱导肿瘤细胞释放DAMP。肿瘤抗原释放的改善与树突细胞(特别是常规的1型树突细胞)的活化相结合,导致树突细胞运输到淋巴结并产生肿瘤特异性T细胞。在本节中,作者讨论了使用递送技术通过直接和间接的PRR激活来改善树突状细胞的抗原处理和呈递(图2)。
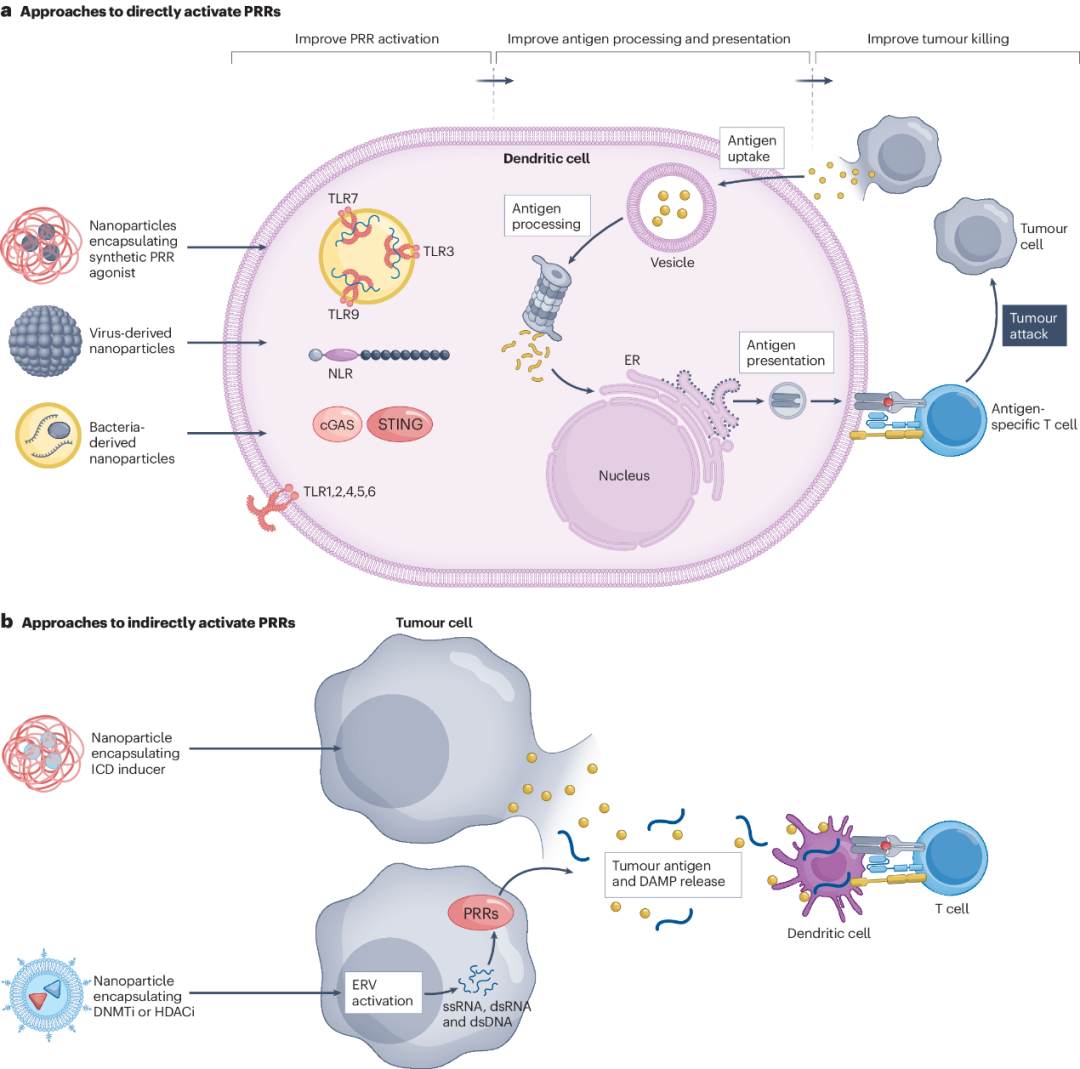
图2 改善肿瘤抗原处理和呈递的递送技术
三、克服免疫抑制性肿瘤微环境
产生针对肿瘤的抗原特异性免疫反应是成功的原位癌症疫苗的目标之一。理想情况下,产生的抗原特异性T细胞不仅应杀死治疗肿瘤中的癌症细胞,还应根除远处病灶中的肿瘤细胞。实体瘤具有高度免疫抑制的微环境,具有各种免疫检查点的激活行为以及丰富的免疫抑制细胞和细胞因子。抗原特异性T细胞在这种微环境中可能会耗尽、失活和/或死亡,因此肿瘤无法被免疫细胞消除。在此,作者讨论了靶向免疫检查点、细胞因子和抑制性免疫细胞的药物递送技术的使用,以改进原位癌症疫苗接种(图3)。
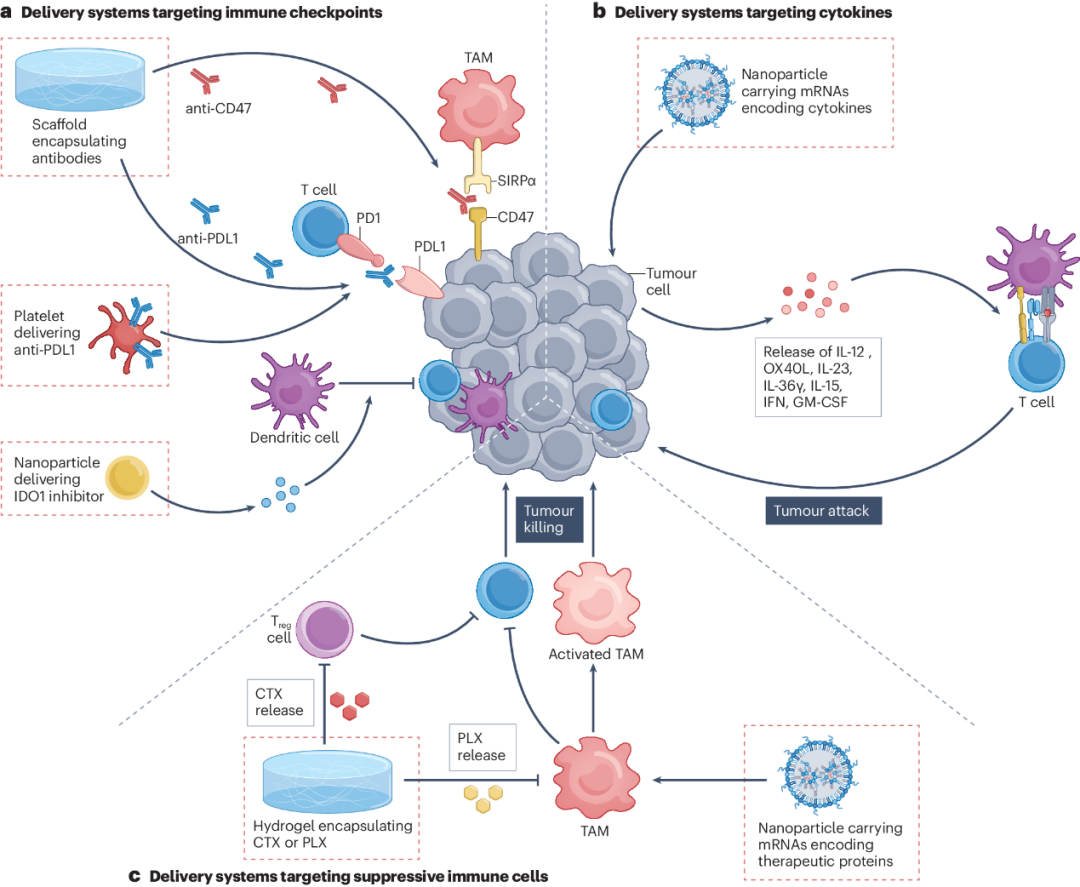
图3 递送技术克服免疫微环境的抑制性
四、临床研究
许多药物递送系统正在进行原位癌症疫苗应用的临床评估(图4)。例如,为了提高肿瘤抗原的释放,设计了一种制剂INT230-6,该制剂由细胞毒性药物顺铂和长春碱与细胞渗透促进剂8-((2-羟基苯甲酰基)氨基)辛酸酯(IT-006)组合而成。这种增强子极大地改善了亲水性化疗药物通过基于脂质的细胞膜的转运,从而改善了化疗对肿瘤细胞的裂解和杀伤。作为另一种改善抗原释放的方法,基于氧化铪纳米颗粒的放射增敏剂Hensify与放射疗法相结合在欧盟被批准用于治疗局部晚期软组织肉瘤。在电离辐射激活后,Hensify产生局部高能沉积物,并增加肿瘤细胞杀伤和肿瘤特异性免疫反应。为了改善抗原处理和呈递,一种名为Hiltonol的聚赖氨酸稳定的聚(I:C)正在多项临床研究中进行测试。这些研究包括将Hiltonol与放射疗法联合用于治疗复发性B细胞和T细胞淋巴瘤,以及将其与抗PD1或抗PDL1抗体联合用于治疗头颈癌症、肉瘤和皮肤癌。类似地,与阳离子载体聚乙烯亚胺(BO-112)联合放疗和抗PD1抗体配制的聚(I:C)用于治疗转移性非小细胞肺癌癌症、软组织肉瘤和黑色素瘤的临床评价。而为了通过克服抑制性免疫微环境来改善原位疫苗接种,正在进行编码细胞因子的信使核糖核酸递送系统的临床试验。递送编码IL-12的mRNA的LNP(MEDI1191)已与抗PDL1抗体durvalumab联合进行了试验。
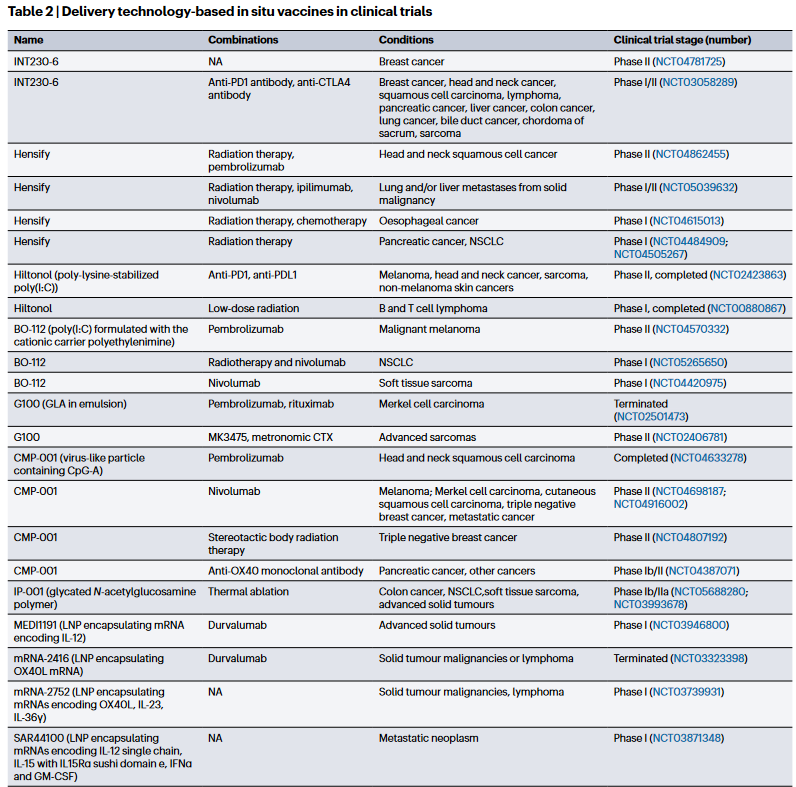
图4 各类临床研究
【结论与展望】
总之,递送技术越来越多地被用于增强原位疫苗,在增强抗原释放、抗原处理和对抗抑制性肿瘤微环境以增强抗肿瘤免疫反应方面显示出有效性。这些令人鼓舞的免疫调节递送技术有望在基础免疫学研究和原位疫苗接种的临床环境中得到更广泛的应用。随着不断的改进,这些递送系统可以显著提高现有的基于原位疫苗的癌症治疗的有效性,并有助于创建更先进的癌症免疫疗法。
原文链接:
https://www.nature.com/articles/s41573-024-00974-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#抗原呈递细胞# #肿瘤抗原释放# #癌症-免疫循环# #原位癌症疫苗接种#
36