Science Immunology:发烧是把“双刃剑”,增强免疫,但会促进癌症!国自然第一大热点,就这么开展
2024-10-26 梅斯学术 MedSci原创 发表于上海
范德堡大学研究发现发烧对免疫细胞是双刃剑,39°C 发烧增加 CD4 T 细胞功能但致 TH1 细胞线粒体应激等,可能促进癌症发展,表明发烧影响复杂,有待进一步研究。
几乎每个人都有过发烧的经历。不过,大多数人会认为:当体温升高的时候,是免疫系统正在与病原体战斗,帮助机体战胜病原体;而成功退烧是免疫系统打赢了这一战役,甚至退完烧都感觉身体免疫力都增强了不少呢!
但近日,范德堡大学研究人员在Science Immunology发表了研究成果,表明发烧时的体温对免疫细胞的影响并不全都是正面的,它也可能会背刺我们,是一把“双刃剑”!
具体来说,该研究发现,中度发烧(39°C)可增加小鼠CD4 T细胞的新陈代谢、增殖和炎症效应活性,同时降低调节性T细胞的抑制能力。但暴露于高温下的T辅助细胞1(TH1)选择性产生线粒体应激和DNA损伤,激活Trp53和干扰素基因的刺激因子通路。

一、研究内容与思路
1、在发烧时,CD4 T细胞功能有利于炎症状态
在恒温37°C或生理发热范围39°C的温度下对可分化的CD4 T细胞进行培养3-4天,检测发现:与37°C培养相比,39°C培养条件下,CD4 T细胞亚群均表现出更高的增殖率,小鼠TH1细胞和人类TH0和TH1细胞中IFN-γ的比例更高,TH17细胞分泌的IL-17A更多;而在39°C下培养的iTregs抑制CD8 T细胞增殖的效果较差。此外,在39°C培养后,T细胞受刺激后TCR信号传导成分SLP-76的磷酸化程度更高。
接下来,作者测试了受温度刺激的体外CD4 T细胞对小鼠的影响。研究发现,CD4 T细胞移入体内4天后,39°C下培养T细胞的小鼠脾脏和肠系膜淋巴结(mLNs)比例增加,Ki67、IFN-γ表达增加。以上结果表明:在温度刺激下,CD4 T亚群增殖和炎症能力增强,且在体内保留了这些表型。
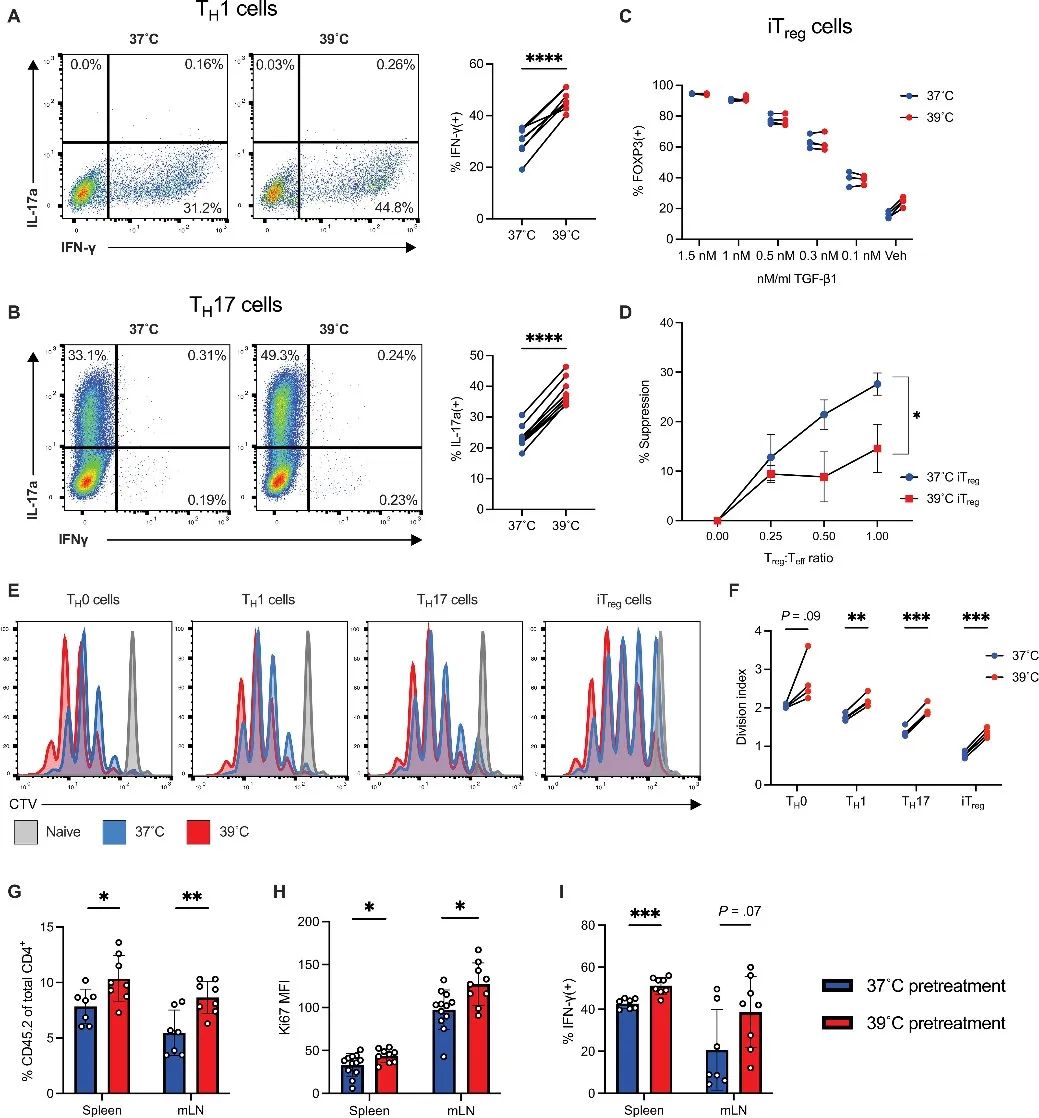
研究思路1:人体存在多种免疫细胞,其中最重要的便是T细胞,T细胞中发挥正向作用的往往是CD4 T细胞。对此,作者开展了体外实验和体内实验来探讨在常温跟发烧情况对CD4 T亚群细胞的影响,表明:在发烧情况下,CD4 T亚群增殖和炎症能力增强,从而起到杀灭病原体作用。
2、热量选择性影响CD4 T细胞亚群代谢
作者检测了在T细胞功能及代谢中起重要作用的Akt-mTORC1通路,发现与37°C培养相比,39°C培养条件下Akt、S6、4EBP1和mTORC1磷酸化程度升高。然而,Glut1和细胞外酸化(ECAR)水平仅在39°C培养的TH17和iTreg亚群中显著增强,且在体内4天后仍保持,仅TH1细胞糖酵解基础速率增加。这些结果表明,代谢发生了持久性变化。
呼吸也会因发烧温度而发生亚群特异性变化。与37°C培养相比,39°C培养条件下TH1细胞的最大耗氧率(OCR)和备用呼吸能力(SRC)呈下降趋势,且TH1细胞出现线粒体功能障碍的频率更高,这是在其他CD4T细胞亚群中观察不到的。
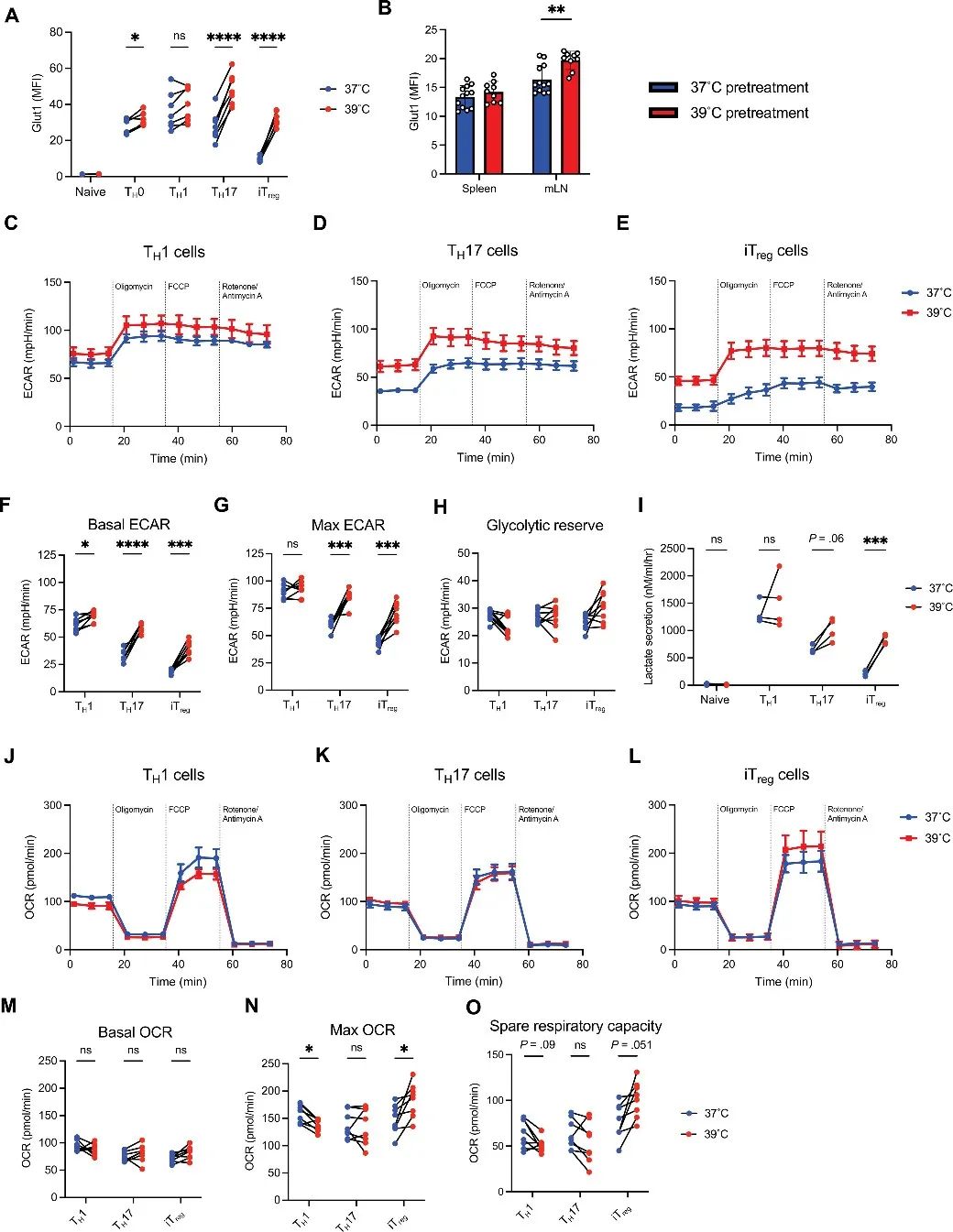
研究思路2:鉴于新陈代谢与T细胞功能之间的联系。作者从代谢角度入手发现,发烧的时候会导致代谢增加,那么对于CD4 T亚群细胞存在什么影响呢?该研究发现,仅有TH1细胞代谢增加且线粒体功能出现障碍,其他CD4 T细胞亚群均无影响。
3、热量选择性诱导TH1细胞线粒体应激
作者接下来研究了CD4 T细胞在39°C时的线粒体含量和生理学。电子显微镜(EM)成像显示,TH1细胞中的线粒体表现出更大的异质性,一些细胞在发烧时线粒体密度增加嵴形成,而另一些细胞则表现出线粒体浓缩,线粒体质量增加;线粒体活性氧(mitoROS)水平显著增加。此外,在39°C时,CD4 T细胞所有亚群中的线粒体和细胞质ROS表达显著增加。与其他表型一样,在体外特定温度条件下刺激后,线粒体质量和细胞质ROS的增加甚至在体内转移4天后仍持续存在。因此,发烧范围内的温度会导致线粒体功能障碍以及持续的炎症和代谢活跃的T细胞表型。
在39°C时,TH0、TH1和TH2细胞亚群的活力显著下降甚至死亡,而TH17和iTreg亚群不受影响。
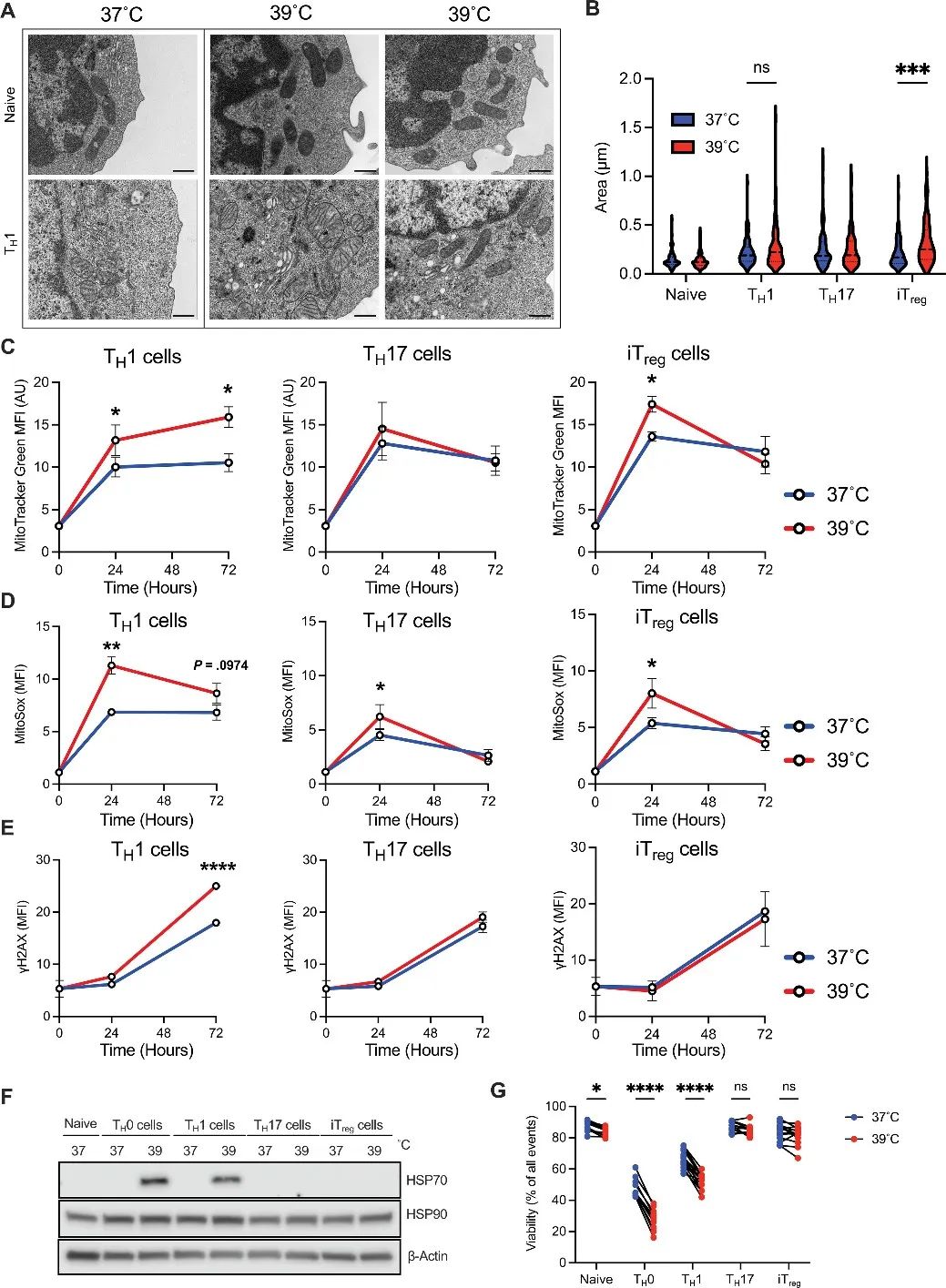
研究思路3:上述研究发现,TH1线粒体功能出现障碍。因此,作者从线粒体入手,探讨发烧对于CD4T细胞亚群线粒体功能及形态的影响。
4、MitoROS诱导的DNA损伤激活了TH1细胞中的p53
作者使用定制的引导RNA(gRNA)库在TH1细胞中进行体外CRISPR筛选,发现在39℃下,T细胞中p53通路表达增加,实验验证发现在TH0和TH1细胞中p53-Ser15的磷酸化的磷酸化和p53靶标p21表达增加。
作者开展了动物实验,敲低了Trp53基因,提取T细胞进行实验,结果发现p53缺陷部分恢复了TH0和TH1细胞的活力,而其他CD4T细胞亚群不受影响,此外,Trp53基因敲除细胞具有更强的效应细胞因子表达。
接下来,作者测试了在39℃下,ROS的增加是否会导致TH1细胞中p53的激活和细胞死亡。用N-乙酰半胱氨酸(NAC)抑制细胞ROS后发现TH0和TH1细胞的活性得到部分恢复,HSP70和p53靶标p21的表达以及p53-Ser15的磷酸化减少,Glut1表达增加。
在37°或39°C下对WT和Trp53敲低TH1细胞进行了深度全外显子组测序,发现在39°C下培养的Trp53敲低TH1细胞双链DNA断裂和错误修复的突变插入显著增加,而p53依赖性凋亡或DNA修复可以缓解这种情况。
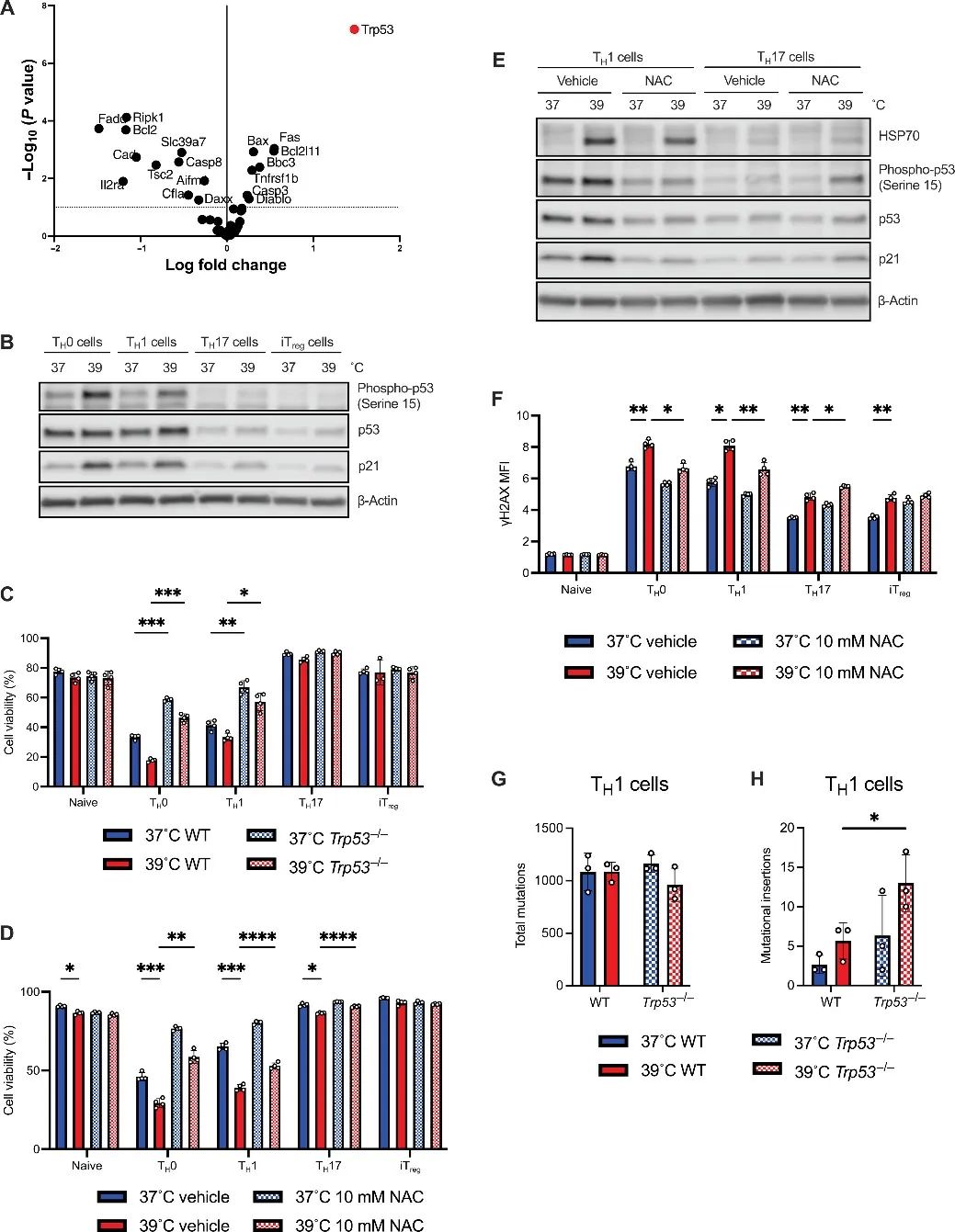
研究思路4:发烧使得CD4T细胞出现改变,尤其是TH1细胞。那这一改变是否是从基因层面出发的呢?对此,作者进行了测序验证,探讨是什么基因发生了变化导致TH1细胞出现一系列改变。
5、STING在发热温度下促进细胞死亡并增强TH1细胞的效应功能
环状鸟苷酸单磷酸-腺苷酸合成酶(cGAS)-干扰素基因刺激因子(STING)通路可感知细胞质DNA,并参与TH1分化。作者实验发现人类CD4 T细胞表达STING1和CGAS,TH0和TH1细胞中的表达水平高于TH17细胞,且在39℃下这种情况更明显。
接下来,作者研究了39°C时TH1细胞中cGAS-STING的激活情况:cGAS和磷酸化STING的表达显著增加。cGAS或STING缺陷可以挽救39°C下TH1细胞的死亡,抑制TH1细胞分泌细胞因子。由于STING通路可以调节ROS和DNA损伤反应,作者接下来测试了其在热诱导的ROS和DNA损伤中的作用。实验发现在39°C时,STING缺陷降低了TH1细胞的mtROS分泌,减少了DNA损伤。
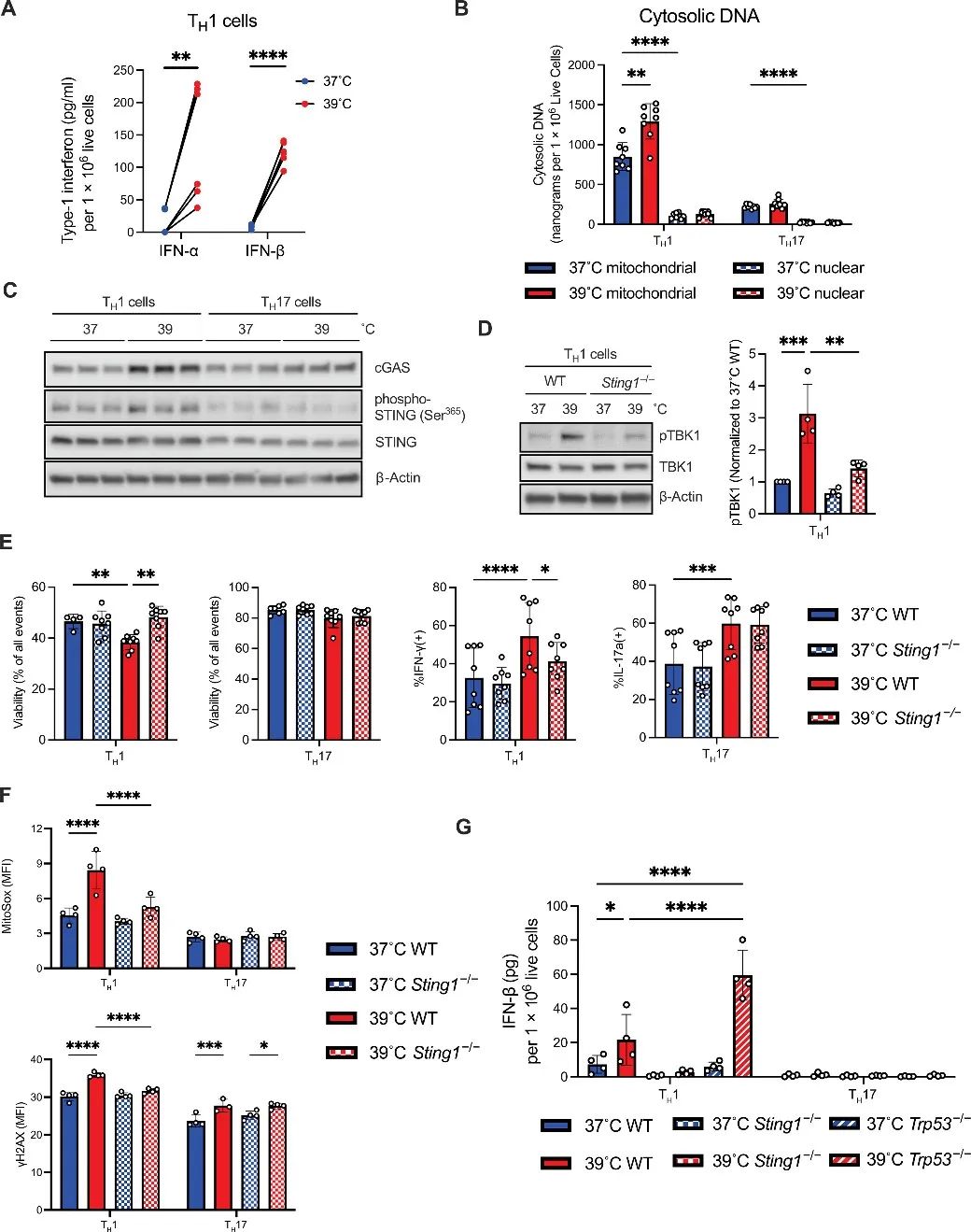
研究思路5:上一部分发现TH1细胞的DNA受损,作者顺着DNA角度入手,探讨了参与DNA过程的cGAS-STING信号通路在这一过程中扮演的角色。
6、体内Trp53和线粒体应激TH1样CD4 T细胞群
因为发热是发炎组织的主要特征,作者构建了炎症性肠炎(IBD)和类风湿关节炎(RA)来对体外实验结果进行进一步验证。实验发现Trp53的缺失增加了脾脏和mLNs中T细胞的适应性和丰度。
接下来进行了直接竞争实验,将等量的野生型WT和Trp53基因敲除T细胞混合后,移植到Rag1基因敲除小鼠体内诱发IBD。对照组小鼠则是移植天然T调节细胞(nT调节细胞)。结果在IBD中,Trp53基因敲除T细胞的数量超过了WT细胞,脾脏中Trp53基因敲除IFN-γ+ CD4 T细胞数量显著增加。
作者对克罗恩患者和类风湿关节炎患者的样本进行了单细胞RNA测序(scRNA-seq),作者从克罗恩患者的数据集中识别出四个重要的CD4 T细胞群,表达最高的是IFN-γ+TH1细胞。而在类风湿关节炎患者的数据集中,患者的T细胞对热和IFN-γ升高反应更强。这两组细胞表现出糖酵解、热反应的高基因表达特征,以及DNA损伤反应和STING通路活性的最高基因特征。
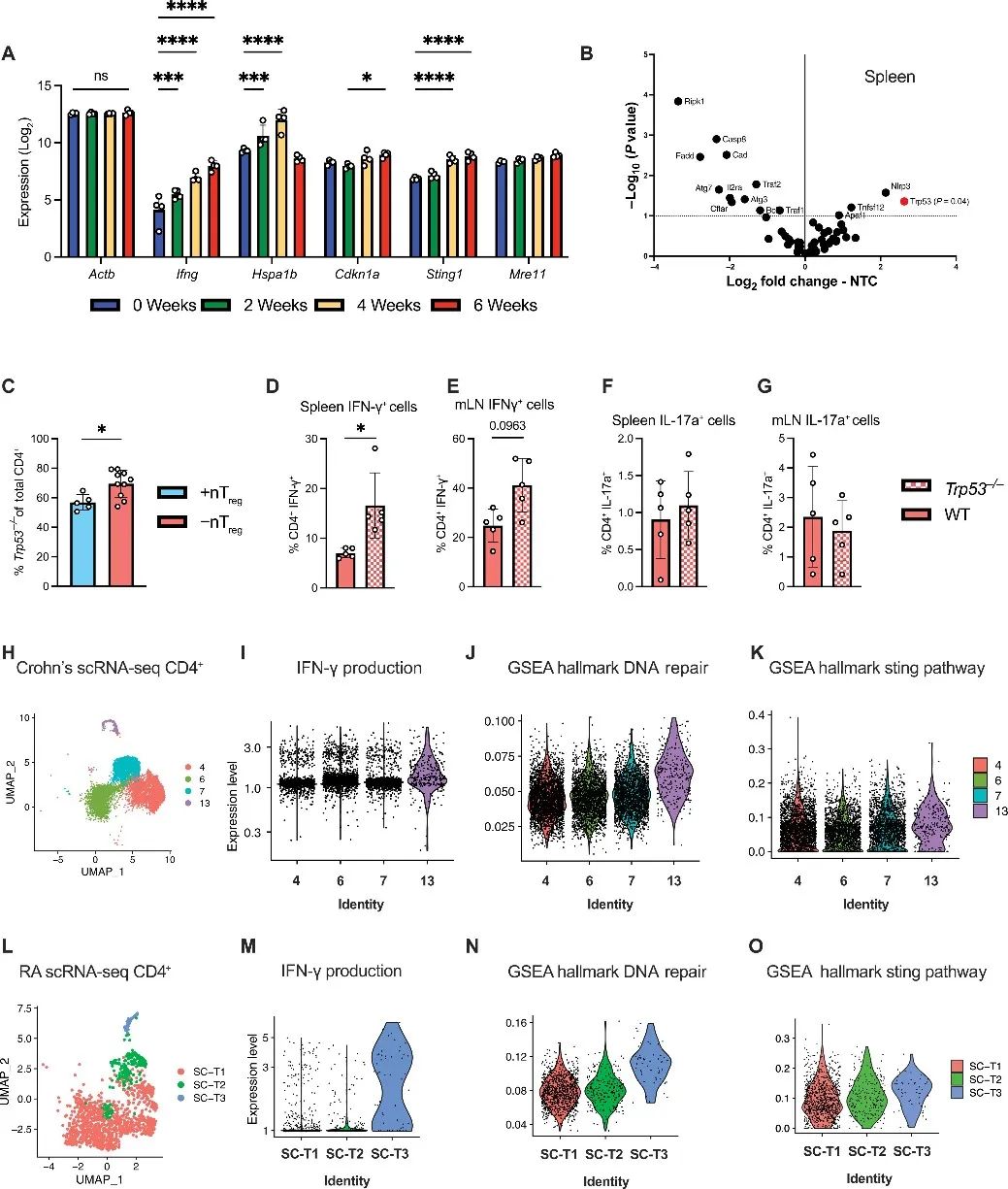
研究思路6:体外实验发现,发烧会影响CD4T细胞,使得其分泌更多细胞因子来发挥免疫抵抗作用,但与此同时也会导致细胞内部功能受损,p53表达增加,有癌变风险。对此,作者获得了IBD和RA患者的样本,进行了测序,将目光聚集到CD4T细胞亚群中,发现TH1细胞,尤其是分泌IFN-γ的TH1细胞表达最多,且细胞表型与体外实验所得结果一致。
7、TH1细胞对热诱导的ETC1功能障碍敏感
为了了解细胞应激和ROS增强的起源,作者研究了T细胞线粒体电子传递。之前研究表明电子传递链1(ETC1)可能对热敏感。作者研究发现在39°C时,TH1细胞每单位线粒体的ETC1功能降低。对IBD或RA患者的scRNA-seq数据分析发现在产生IFN-γ的T细胞群中,ETC1的基因表达选择性增加。
接下来,作者检测了ETC1对线粒体ROS的影响。实验发现,ETC1在39°C时通过受损或低效的正向电子传递产生更多的mitoROS。
对体外培养的TH1或TH17细胞进行ETC1抑制剂处理,发现相比于TH17细胞,TH1细胞活性降低但ROS生成增加,尤其是在39℃下。CRISPR筛选发现在TH1细胞中,针对ETC1成分的引导物比在TH17细胞中耗竭的程度更高。综上所述,ETC1对温度敏感,且会加剧TH1细胞对热应激的脆弱性。
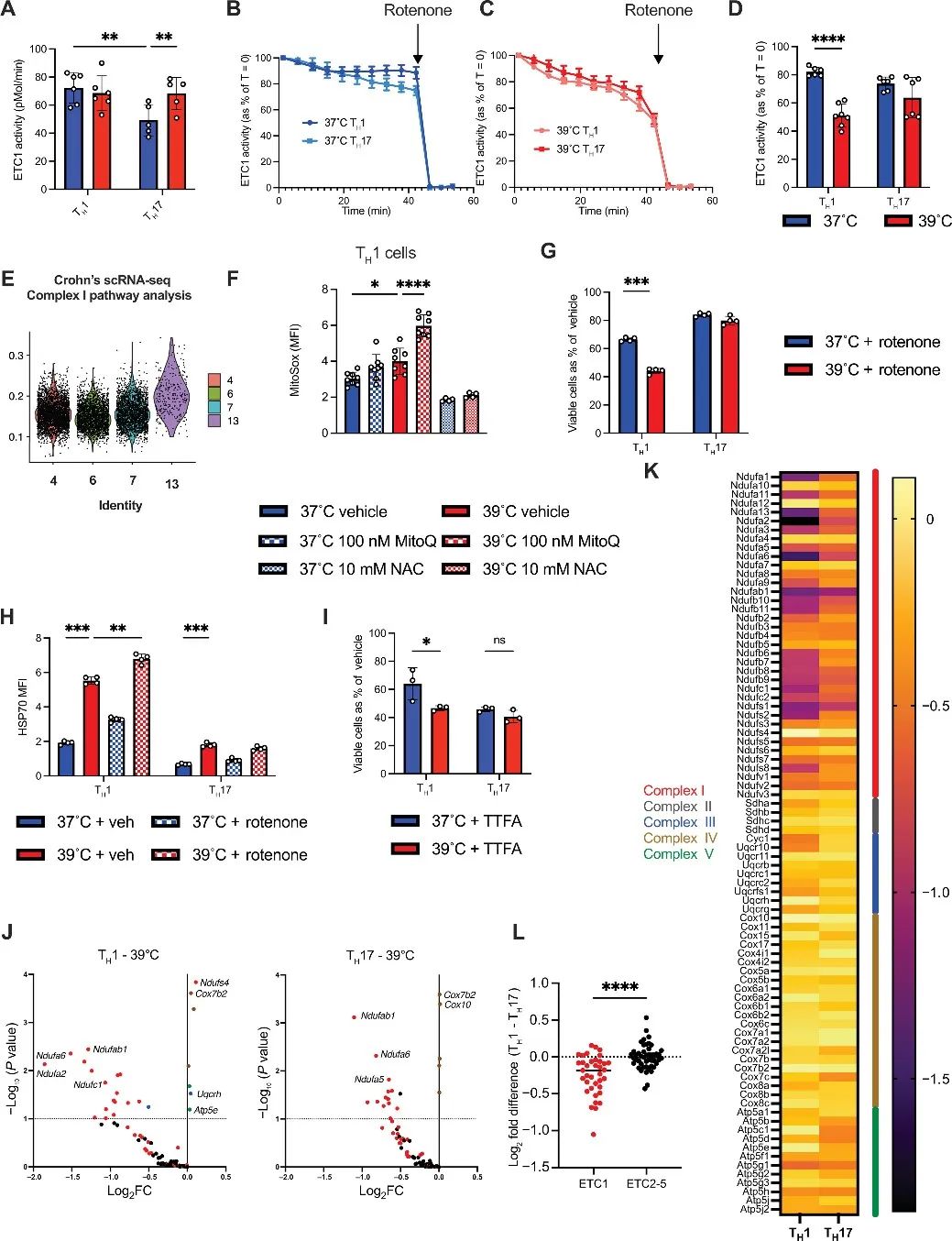
研究思路7:从机制上来说,之前已经明确了发烧会导致TH1细胞线粒体受损,ROS增多,DNA受损,且已经明确了DNA受损的根源,但线粒体受损的根源依旧有待探讨。于是,作者从T细胞线粒体电子传递角度挖掘。
二、小结
综上所述,发热会使得CD4 T细胞激活分泌细胞因子,产生免疫抵抗力,这解释了为什么发烧好了之后你觉得自己的抵抗力增强了。
但与此同时,发热会迅速破坏线粒体中的ETC1,ETC1的损伤导致线粒体功能障碍,ROS增加,继而启动了导致DNA损伤的信号机制,并激活了肿瘤抑制蛋白p53,而p53可触发细胞死亡(损伤无法修复时诱导细胞死亡)。而TH1细胞较其他T细胞亚型对ETC1损伤更敏感。这就是为什么一些慢性炎症(慢性炎症通常伴随着组织温度持续升高)会促进癌症发生发展。
这一研究表明“发烧是一把双刃剑”,会使得细胞感知温度并作出反应。但组织内的温度各不相同且一直在变化,并不清楚它到底有什么作用,有待进一步挖掘研究。
参考文献:
[1] Heintzman DR, Sinard RC, Fisher EL, et al. Subset-specific mitochondrial stress and DNA damage shape T cell responses to fever and inflammation.Sci Immunol. 2024;9(99):eadp3475. doi:10.1126/sciimmunol.adp3475
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#发烧# #Th1细胞# #CD4 T细胞#
16