STTT:钟南山院士团队创新疗法:诱导化疗联合“双艾”组合为广泛期小细胞肺癌患者带来显著生存获益
2025-02-20 肿瘤医学论坛 肿瘤医学论坛 发表于陕西省
研究首次提出在未经治疗的ES-SCLC患者中,通过诱导化疗缩小肿瘤后再联合卡瑞利珠单抗和阿帕替尼,兼顾了疗效和安全性,为ES-SCLC的治疗提供了新的思路和希望。
2025年2月18日,广州医科大学附属第一医院钟南山院士团队在《Signal Transduction and Targeted Therapy》上发表了一项创新性的多中心临床研究,探索诱导化疗联合卡瑞利珠单抗和阿帕替尼治疗广泛期小细胞肺癌(ES-SCLC)的疗效和安全性。
研究首次提出在未经治疗的ES-SCLC患者中,通过诱导化疗缩小肿瘤后再联合卡瑞利珠单抗(PD-1抑制剂)和阿帕替尼(VEGFR抑制剂),兼顾了疗效和安全性,为ES-SCLC的治疗提供了新的思路和希望。

图1 文章封面截图
研究背景
小细胞肺癌(SCLC)是一种侵袭性强且进展迅速的肺癌亚型,约占所有肺癌诊断的15%。其预后极差,中位总生存期(OS)仅为7个月。在诊断时,约70%的SCLC患者已处于广泛期(ES-SCLC)。近年来,免疫检查点抑制剂(ICIs)联合化疗已成为ES-SCLC的标准一线治疗方案,但生存获益有限,中位OS仅延长2.0至4.7个月。因此,迫切需要新的治疗策略来改善ES-SCLC患者的预后。
研究发现,SCLC的肿瘤微环境高度异质且免疫抑制性强,CD8+ T细胞浸润不足是SCLC对ICIs反应有限的关键原因。此外,SCLC的侵袭性生长与血管内皮生长因子(VEGF)过表达相关,靶向VEGF通路可能增加CD8+ T细胞浸润并减少新生血管生成,从而增强抗肿瘤反应。ICIs 与抗 VEGFR 药物联合使用通过增加肿瘤微环境中的 T 细胞浸润具有协同效应。
近年来的多项研究显示,抗血管生成药物(如阿帕替尼)可通过改善肿瘤微环境增强免疫治疗效果。然而,大多数SCLC患者病灶靠近大血管,抗血管生成药物的使用存在较高的出血风险,限制了其在ES-SCLC患者中的应用。本研究首次探索了“诱导化疗+卡瑞利珠单抗+阿帕替尼+化疗”的四联方案,旨在通过诱导化疗缩小肿瘤,降低出血风险,同时增强免疫治疗和抗血管生成药物的协同抗肿瘤效果。
研究设计
本研究是一项多中心、单臂临床试验(ClinicalTrials.gov NCT05001412),纳入40名未经治疗的ES-SCLC患者。患者接受2个周期的依托泊苷(100 mg/m2,静脉注射,第1至3天)和卡铂(AUC 5 mg/mL/min,静脉注射,第1天)(EC)诱导化疗,随后接受2-4个周期的卡瑞利珠单抗(200 mg,静脉注射,第1天)、阿帕替尼(250 mg,口服,每天)联合依托泊苷(100 mg/m2,IV ,第1至3天)和卡铂 (AUC 5 mg/mL/min,IV,第1天)治疗,之后进行卡瑞利珠单抗(200 mg,静脉注射,第1天)和阿帕替尼(250 mg,口服,每天)的维持治疗,直至疾病进展、无法耐受毒性、死亡、撤回同意或长达24 个月。
研究的主要终点为安全性,次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)、中位至缓解时间(TTR)、无进展生存期(PFS)和总生存期(OS)。同时,通过靶向测序和全转录组测序探索潜在生物标志物。
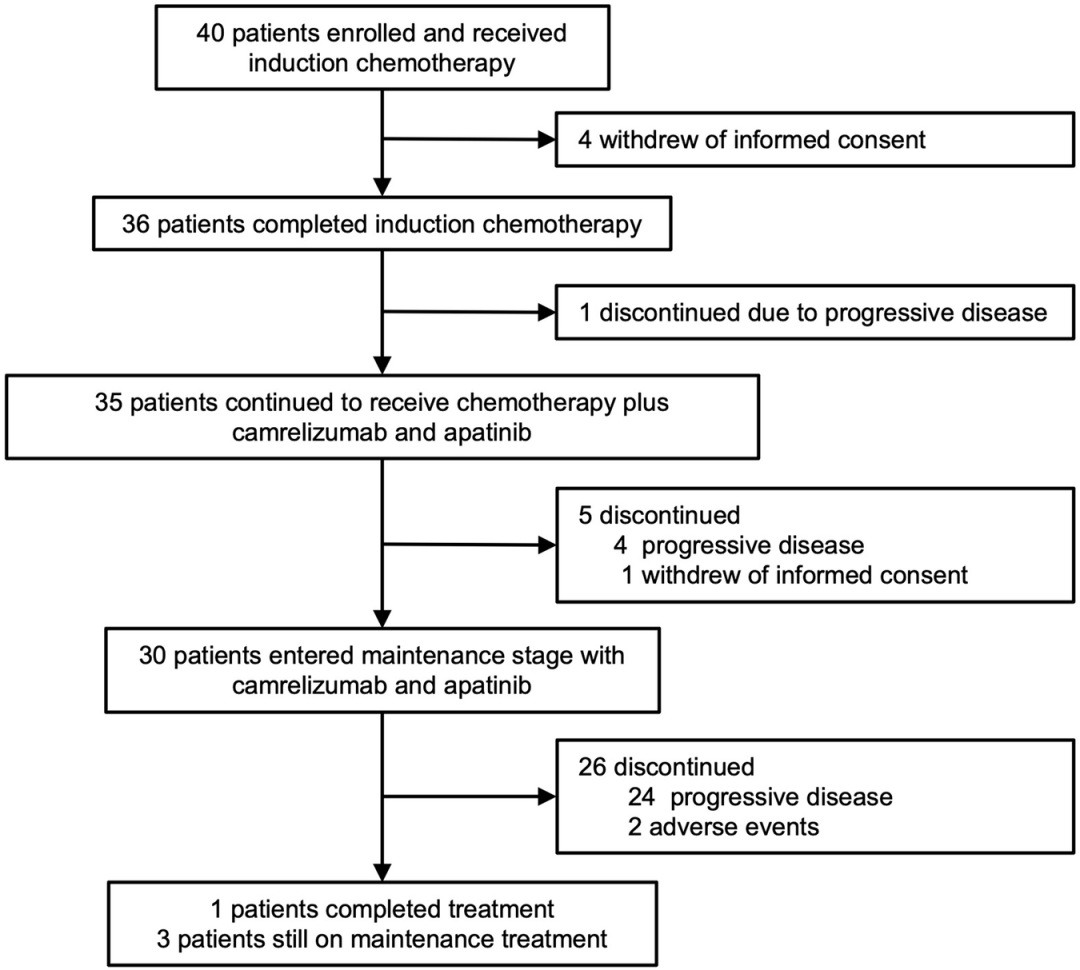
图2 研究概述
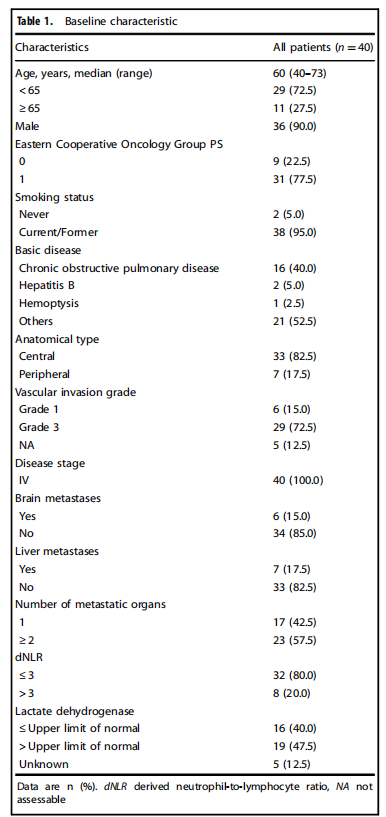
2021年1月21日至2022年8月20日期间,共纳入40例患者。所有患者均接受了诱导EC治疗,其中36例患者可评估肿瘤缓解情况。患者的中位年龄为60岁,90%为男性,所有患者均为Ⅳ期疾病,82.5%为中央型小细胞肺癌,77.5%的ECOG PS为1。
表1 患者基线特征
试验结果
安全性分析
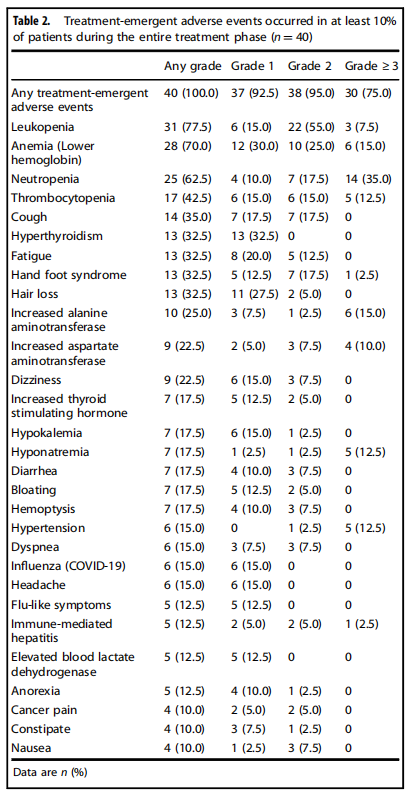
在整个治疗阶段,所有患者均出现治疗相关不良事件(TEAEs),其中75%为3级及以上事件,但未发生治疗相关死亡。最常见的3级及以上TEAEs包括中性粒细胞减少、贫血和丙氨酸氨基转移酶升高。免疫相关不良事件(irAEs)发生率为85.7%,其中25.7%为3级及以上事件,主要表现为甲状腺功能亢进和丙氨酸氨基转移酶升高和促甲状腺激素增加。尽管不良事件发生率较高,但大多数事件可通过剂量调整和支持性治疗进行管理,未导致治疗中断。
表2 治疗相关不良事件
疗效分析
在2023年5月30日数据截止时,中位随访时间为20.6个月。36 例患者中有3名(8.3%)仍在接受研究治疗。30 例患者(83.3%)接受了6个周期的EC。卡瑞利珠单抗的中位治疗周期为7.0。阿帕替尼的中位治疗持续时间为5.23个月。
结果显示,该联合治疗方案在疗效和安全性方面均表现出色。在疗效方面,诱导化疗后,患者的客观缓解率(ORR)为66.7%,疾病控制率(DCR)为97.2%;整个治疗结束后,ORR提高至88.9%,DCR维持在97.2%,中位DoR为5.4个月,中位TTR为1.5个月,中位PFS为7.3个月,中位OS为17.3个月,12个月的OS率为63.4%。此外,94.4%的患者靶病灶从基线缩小,最佳缩小中位数为-63.3%。
表3 抗肿瘤反应
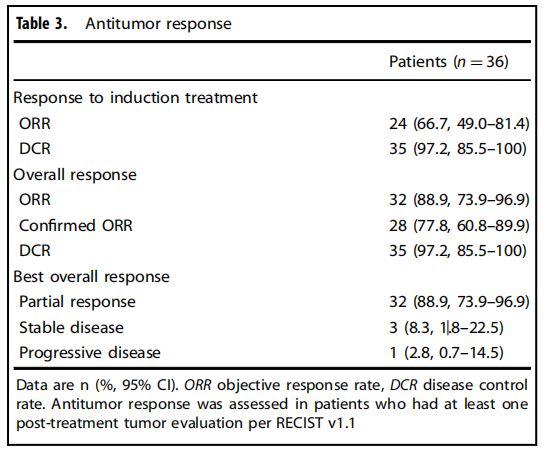
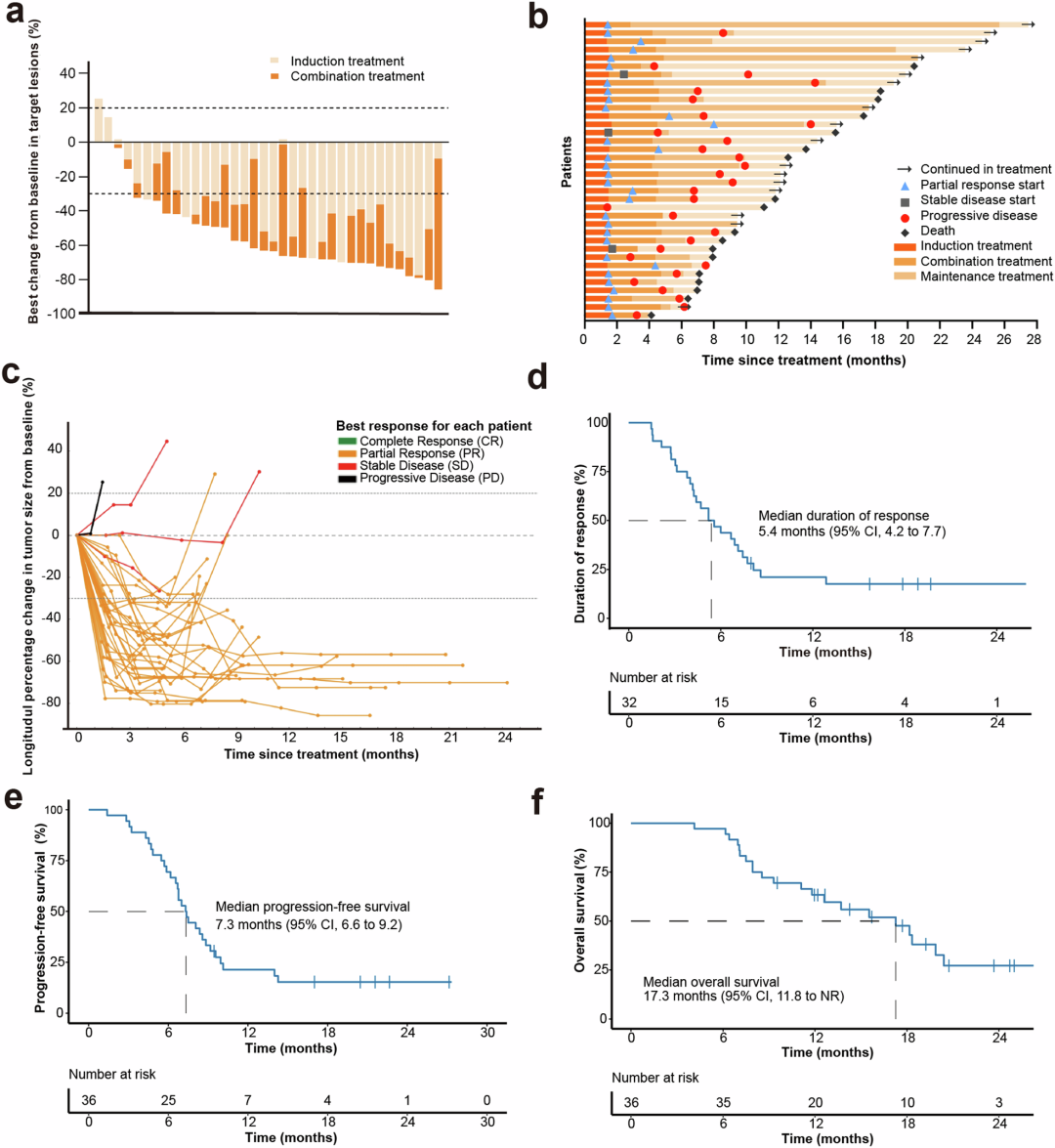
图3 临床结果
生物标志物分析
在生物标志物分析方面,研究通过靶向测序和全转录组测序探索了与治疗反应相关的潜在生物标志物。结果显示,RB1基因突变与更长的PFS相关,而PTPRD和mTOR信号通路基因突变与更短的PFS相关。高肿瘤突变负荷(TMB≥7.0)与更长的PFS相关,而高自然杀伤细胞(NK细胞)和干扰素水平也与更长的PFS相关,高水平的癌症相关成纤维细胞则与更短的PFS相关。这些生物标志物的发现为未来临床试验提供了潜在的预测指标,但需要进一步验证。
试验结论
本研究表明,诱导化疗后联合卡瑞利珠单抗、阿帕替尼和化疗的方案在未经治疗的ES-SCLC患者中具有可接受的安全性和显著的抗肿瘤活性。
尽管生物标志物分析结果仍需进一步验证,但这些发现为未来临床试验提供了重要参考,尤其是在探索免疫治疗联合抗VEGFR治疗在ES-SCLC中的应用。
参考资料:
Liu M, Qiu G, Guan W, et al. Induction chemotherapy followed by camrelizumab plus apatinib and chemotherapy as first-line treatment for extensive-stage small-cell lung cancer: a multicenter, single-arm trial. Signal Transduct Target Ther. 2025;10(1):65. Published 2025 Feb 18. doi:10.1038/s41392-025-02153-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#诱导化疗# #广泛期小细胞肺癌#
12