【衡道丨文献】肺鳞状细胞癌和淋巴上皮癌的临床病理和分子遗传学特点
20小时前 衡道病理 衡道病理 发表于陕西省
《Histopathology》综述阐述肺鳞状细胞癌与淋巴上皮癌的临床病理和分子遗传学特征,包括组织学、免疫组化、细胞学、分子改变及鉴别诊断等方面内容,指出两者在诊断与治疗方面仍存挑战。
2024年1月,瑞士洛桑大学Sabina Berezowska博士为通讯作者,在病理学知名期刊《Histopathology》上发表题为“Pulmonary squamous cell carcinoma and lymphoepithelial carcinoma morphology, molecular characteristics and differential diagnosis”的综述性文章,详尽阐述了这两种肿瘤的临床病理和分子遗传学特点。

简介
肺鳞状细胞癌(SCC)和肺淋巴上皮癌(LEC),均为具有鳞状分化的非小细胞肺癌(NSCLC)。鳞状细胞癌是NSCLC的第二大最常见的组织学类型(仅次于腺癌),约占肺癌的20%。影像学上常表现为中央型肺癌,约三分之一的患者表现为外周型肺癌,常见于老年患者和女性,与纤维化间质性肺疾病有关。LEC是一种低分化的鳞状细胞癌,常见大量淋巴浆细胞浸润,常与EB病毒(EBV)感染相关。LEC是罕见的肿瘤,占NSCLC的不到1%,好发于年轻、不吸烟的亚洲裔患者中,平均年龄为51岁(范围9-74岁)。
SCC和LEC都是根据TNM分类系统进行分期的,它们很少表现为浅表扩散性肿瘤,其侵袭性成分局限于支气管壁。转移最常发生在肺门或纵隔淋巴结,其次是远处转移到骨、脑、肺和胸膜、肝脏和肾上腺。在这篇综述中,作者详细介绍了SCC和LEC的临床病理和分子遗传学特征。
鳞状细胞癌
SCC组织学特征
在2021版WHO分类中。诊断鳞状细胞癌的基本标准为是否存在角化或细胞间桥,以及鳞状细胞分化的免疫组化标志物的表达。SCC细分为角化、非角化和基底样SCC。角化需要与凋亡和坏死区分。偶尔有嗜酸性-橙色细胞浆的细胞,可能代表凋亡或坏死的细胞,需要与真正的角化区分开来。值得注意的是,在一些散在的肿瘤细胞中,存在的细胞内黏蛋白,并不排除鳞状细胞癌。根据WHO的分类,在至少两个高倍视野中,计数超过5个胞浆内粘蛋白液滴,倾向于腺癌或腺鳞癌。
鳞状细胞癌通常呈实性生长,但可能以假腺、筛状或肺泡样生长模式为特征,也可能排列在肺细胞层以下的肺泡壁上,类似于贴壁为主的腺癌。鳞状细胞癌很少表现为局灶性透明的细胞。鳞状细胞癌也可能显示梭形细胞形态,但如果梭形细胞占肿瘤>10%,应归类于多形性癌。
在基底样鳞状细胞癌的亚型中,基底样成分应至少占整个肿瘤的50%。基底样鳞状细胞癌的特征是小到中等大小的细胞,细胞浆少,可见核仁,生长在周围栅栏状的巢状。虽然它们通常缺乏鳞状形态,但可以看到角化珠。它们常表达p40。Ki67/MIB1评估的增殖指数应超过50%。
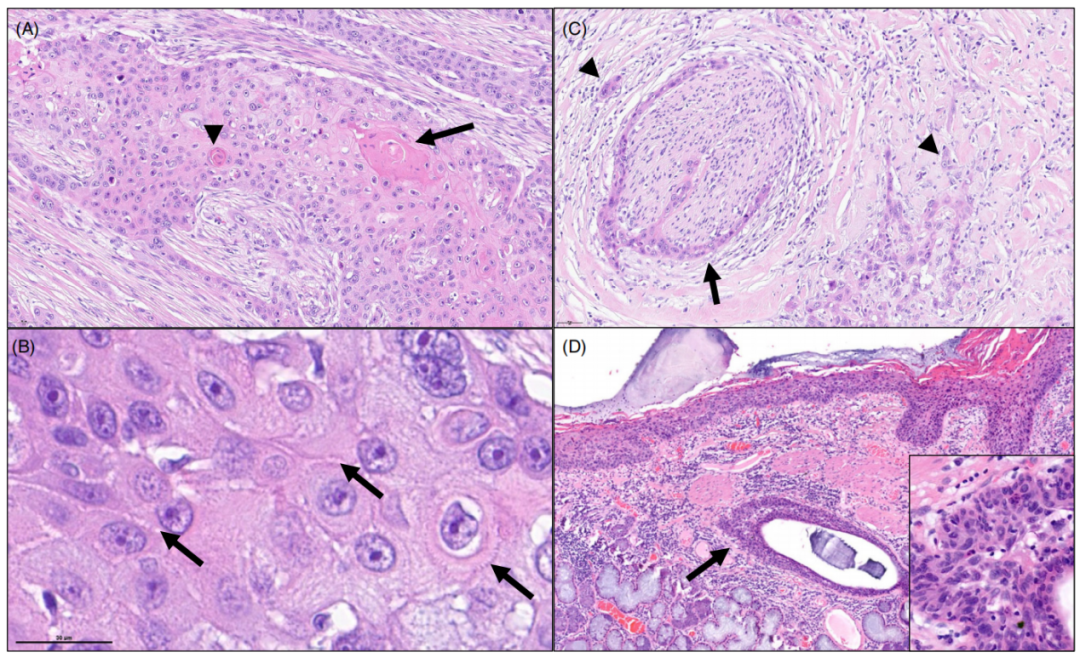
图1. 角化型鳞状细胞癌。(A)角化和角化珠,以及(B)细胞间桥,为鳞状细胞癌的组织形态学显著特点。(C)同一癌的另一个区域,具有高度浸润性的生长模式,伴有肿瘤出芽和神经侵犯。(D)位于主支气管的原位鳞状细胞癌,并延伸至支气管导管的上皮细胞。
免疫组化
免疫组化证实,大多数肿瘤细胞TTF1阴性和p40阳性(至少50%);在实际工作中,首选p40、p63作为鳞状标记物。在小活检和细胞学标本中,免疫组化显示为鳞状免疫表型,HE缺乏鳞状形态,在这种情况下,可应用术语“非小细胞肺癌,倾向鳞状细胞癌”。
CK5/6或34βE12的表达,不足以在形态学上不明确的肿瘤中区分鳞状细胞癌,但有助于区分NSCLC,并将其与小细胞肺癌区分开来。同样,CK7的表达,不能用于排除鳞状细胞癌,因为它在大量鳞状细胞癌中呈阳性表达。
p40的局灶性和散在阳性(< 5%),可能存在于腺癌中,但不能证明其鳞状分化。相比之下,在罕见的肿瘤细胞中存在真正的双系分化和强的TTF1和p40双阳性,通常表现为非角化鳞状细胞癌的形态,可能有角化珠形成。这些肿瘤不应该被诊断为常规鳞状细胞癌,因为在某些病例中,它们具有不同的分子特征和靶向突变(EGFR,KRAS G12C),也不应该被诊断为腺癌,因为它们经常含有FGFR1扩增。因此,在形态学上不明确的情况下,建议同时检测TTF1和p40。值得注意的是,DEK::AFF2融合癌也可共同表达了TTF1和p40。在使用神经内分泌标志物时谨慎,这些标记物在常规鳞状细胞癌中可能是阳性的,本身并不支持神经内分泌癌。
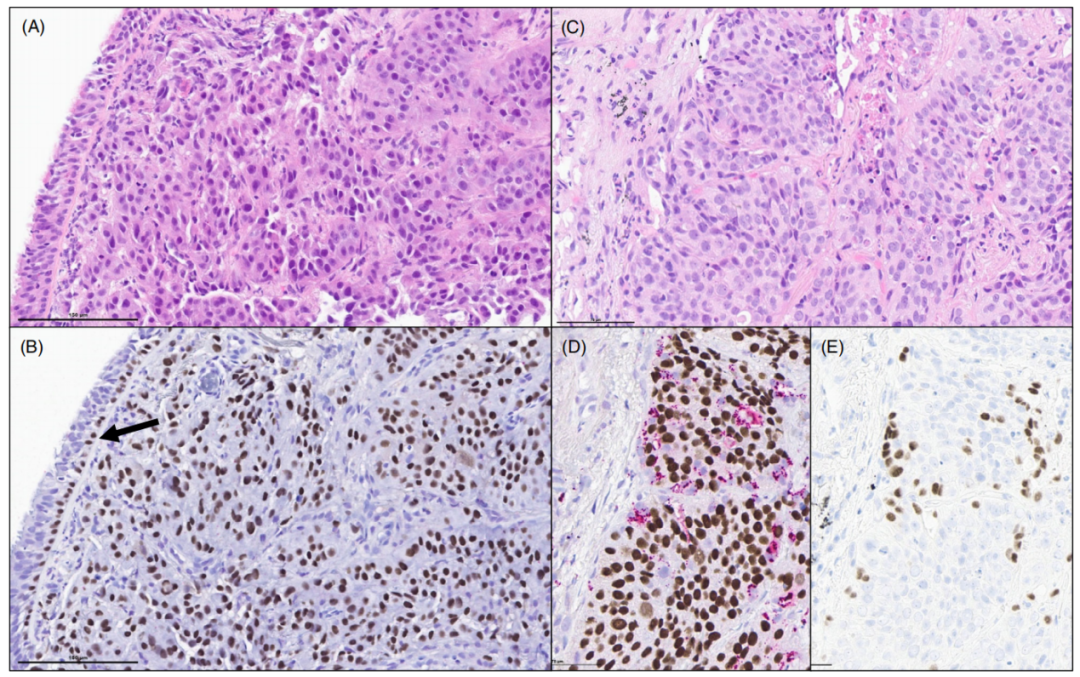
图2.非角化型鳞状细胞癌。(A)非小细胞癌,具有实性生长模式,缺乏角化或细胞间桥。(B)超过50%的肿瘤细胞表达p40,TTF1全阴(未显示),在支气管活检中诊断为“非小细胞癌,倾向于鳞状细胞癌”。支气管上皮上有p40阳性的基底细胞,代表内部阳性对照。(C,D)这种非角化的鳞状细胞癌,在肿瘤细胞中显示出同样强的核p40表达。NapsinA显示肿瘤巢周围的残留肺泡细胞。(E)TTF1突出显示肺泡细胞,不应与肿瘤中的腺癌成分相混淆。
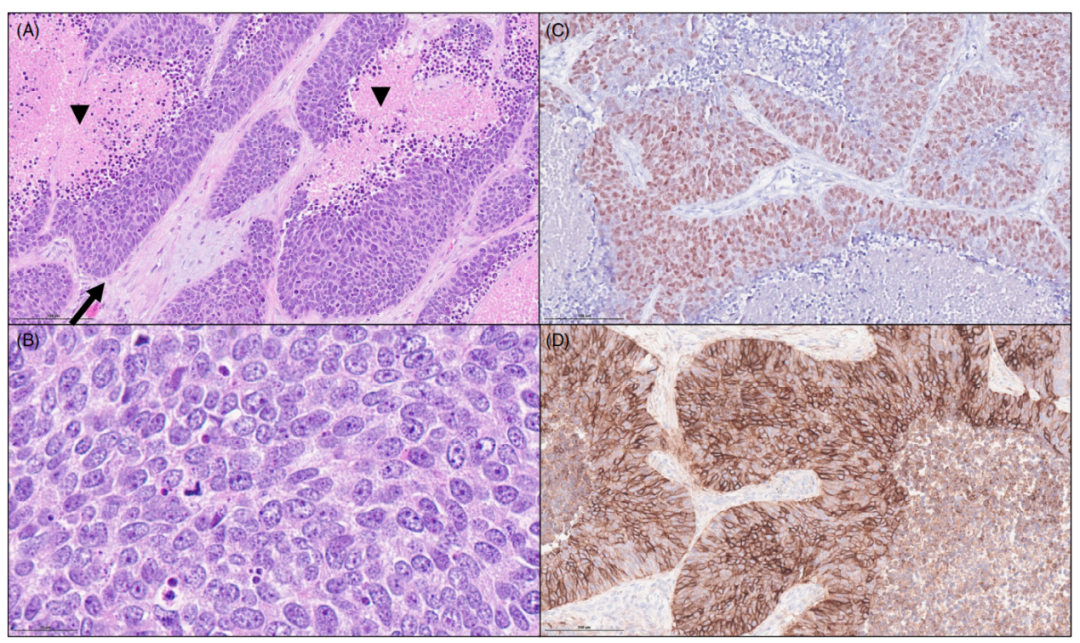
图3. 基底样鳞状细胞癌。(A)肿瘤巢显示周围的栅栏状和广泛的坏死。(B)肿瘤细胞中等大小,有核仁,胞浆少。(C)>50%的肿瘤细胞表达p40。(D)CD56弥漫表达,但是不代表神经内分泌分化。
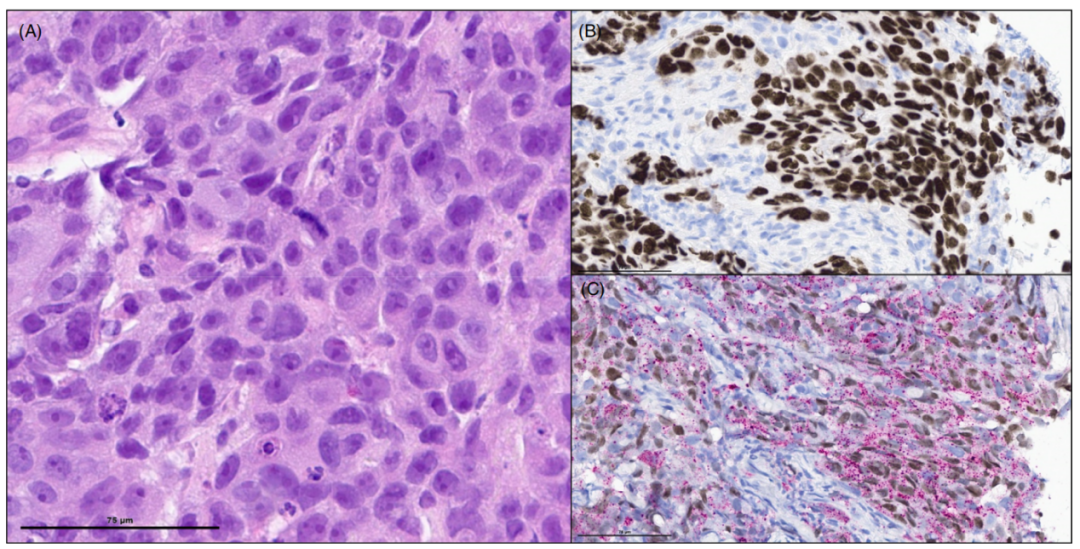
图4. 具有双表型分化的非小细胞癌,显示非角化癌(CA)的实体生长模式,在单个肿瘤细胞中共同表达TTF1 (B)、Napsin A和p40(C)。
分级
目前还没有公认的和普遍认可的肺鳞状细胞癌分级系统。在其它肿瘤中,分级通常至少部分基于分化程度、增殖和结构模式。直到2015年版的WHO肺部肿瘤分类,鳞状细胞癌的分类根据角化程度,分为中分化和低分化。目前正在评估其它组织学标准,以纳入分级系统,如肿瘤出芽和核直径。
SCC的细胞学诊断
WHO肺细胞学报告分类
在最近制定的WHO指南中,肺细胞学报告建议分为五种:“不足诊断、非诊断性标本”、“良性”、“非典型”、“可疑恶性”和“恶性”。对于第一类,每个实验室应选择一个术语,如果材料在定量或定性上不足,则应持续应用它。“良性”类别包括炎症和感染过程和良性肿瘤,诊断应尽可能具有具体性。“非典型”包括主要见于良性病变的特征,可能表明是恶性肿瘤,但在数量或质量上不足以做出精确的诊断。一个挑战是,肺中所有类型的细胞都可以表现出异型性,包括化生鳞状细胞、反应性支气管细胞和组织细胞。可疑恶性肿瘤,当有一些特征提示恶性肿瘤,但数量或质量不足以明确诊断时,即呈现明确怀疑肿瘤。“恶性”类别,说明特定的肿瘤类型,包括有明确发现的病例。
鳞状细胞癌的细胞形态学
PAP染色涂片上的鳞状细胞癌有几种细胞形态学特征。最明显的特征是角化,可见致密的嗜橙色细胞质。细胞间桥,在细胞学上不明显,具体表现为单细胞,小的粘结簇或平坦的细胞片,以及致密和清晰的细胞质。细胞核通常位于中心位置,成角的轮廓和不规则的染色质聚集,在一些病例中,细胞核小而深染。核仁不明显。
SCIS或化生细胞,可在痰液和支气管刷洗中取样,由于细胞形态学特征重叠,无法与侵袭性鳞状细胞癌鉴别。非典型化生细胞和异常增生细胞呈圆形至椭圆形,边界清晰,核质比可变,细胞核深染、不规则。目前在细胞学上,还没有没有明确的标准,来鉴别侵袭性肿瘤,但高细胞数量和肮脏的细胞碎片背景,提示侵袭性过程。一些疾病状况,包括炎症、治疗后改变或感染引起的反应性变化,也需要与鳞状细胞癌相鉴别。
非角化型鳞状细胞癌,通常形成平面或三维结构,伴有不同数量的孤立肿瘤细胞,通常可见致密的细胞质。细胞核通常位于中心位置,圆形或长杆状,多形性,染色质不规则,有时也可见突出的核仁。基底样鳞状细胞癌在细胞学上难以识别,主要表现为粘连的组织碎片,偶尔有栅栏状改变,很少有假菊形团改变。在一些病例中,N/C比较高,胞质边缘较薄,细胞核呈圆形至椭圆形,染色质致密,通常无核仁。核可发生核成型和破碎,非常类似于小细胞癌。必须进行免疫组化染色才能确诊。

图5.不同亚型鳞状细胞癌的细胞学涂片图。(A,B)淋巴结中的角化性鳞状细胞癌,样本由EBUS-TBNA获得。各种形状的细胞,包括“纤维”细胞(箭头),有些细胞表现出典型的致密的嗜橙色细胞浆(箭头)。注意带有中性粒细胞和细胞碎片的肮脏背景。(C,D)支气管抽吸液中的非角化性鳞状细胞癌。未分化的三维细胞簇,具有中等丰富的胞浆和突出的核仁。如果没有免疫染色,诊断为非小细胞癌,NOS。(E,F)淋巴结内基底样鳞状细胞癌,由EBUS-TBNA获得。大片小而一致的细胞,几乎没有可见的细胞质,染色质细颗粒状,非常像小细胞癌。
分子改变及其临床意义
吸烟导致支气管上皮细胞长期暴露于诱变和致癌因素中。随之而来的DNA损伤转化为“烟草烟雾特征”,其特征是GG > TT突变的富集,这在肺鳞状细胞癌以及其他吸烟诱导的癌症中常见,包括头颈部鳞状细胞癌。
最初,专家根据肺鳞状细胞癌中mRNA表达,谱描述了四种亚型,分为原始表达亚型、经典表达亚型、分泌性表达亚型和基础表达亚型。随着现有分子数据的增加,包括DNA甲基化模式和蛋白质基因组学,目前专家已经提出了额外的分子分型模型,强调了多种致瘤机制和免疫微环境的复杂相互作用,并提供了潜在的预后信息。
一些研究揭示的关键分子特征,涉及基因组和染色体不稳定性,与侵袭性肺鳞状细胞癌相关。从功能的角度来看,这些改变,可以根据它们所影响的细胞过程或信号通路进行分组:(i) PI3K和RAS通路,被PIK3CA或PTEN突变或FGFR1或PDGFRA扩增激活;(ii)细胞周期失调是CDKN2A、TP53或RB1功能缺失的结果;(iii)NFE2L2、KEAP1、CUL3突变,损害氧化应激的反应;(iv)SOX2和TP63扩增或NOTCH1突变,促进鳞状分化;(v)表观遗传调控基因KMT2D突变或NSD3扩增,导致表观遗传调控改变。
以下基因在肺鳞状细胞癌中高频率突变:肿瘤抑制基因CDKN2A编码p16INK4A和p16IN4A和ARF细胞周期抑制蛋白,在72%的病例中因突变、启动子甲基化或9p缺失而失活。此外,SOX2和TP63都编码对鳞状细胞分化至关重要的转录因子,位于3号染色体长臂3q26和3q28之间的区域,在25-75%的肺鳞状细胞癌中扩增。
一些在肺腺癌中的药物靶点的突变和融合基因,也可在鳞状细胞癌中检测到,尽管频率较低。包括EGFR、KRAS(特别是G12C突变)、MET(第14外显子突变)、ERBB2、BRAF(V600E突变)和ALK、ROS1、RET和NTRK的融合。
基底样鳞状细胞癌
在超过80%的基底样鳞状细胞癌中,发现了NOTCH通路的抑制,而不是传统肺鳞状细胞癌中常见的NOTCH信号通路的异常激活。通过下调NOTCH2或上调ASCL1,来降低NOTCH通路信号通路,可能有助于基底样SCC的神经内分泌分化。此外,POU2F3变异,可见于22%的基底样鳞状细胞癌中。
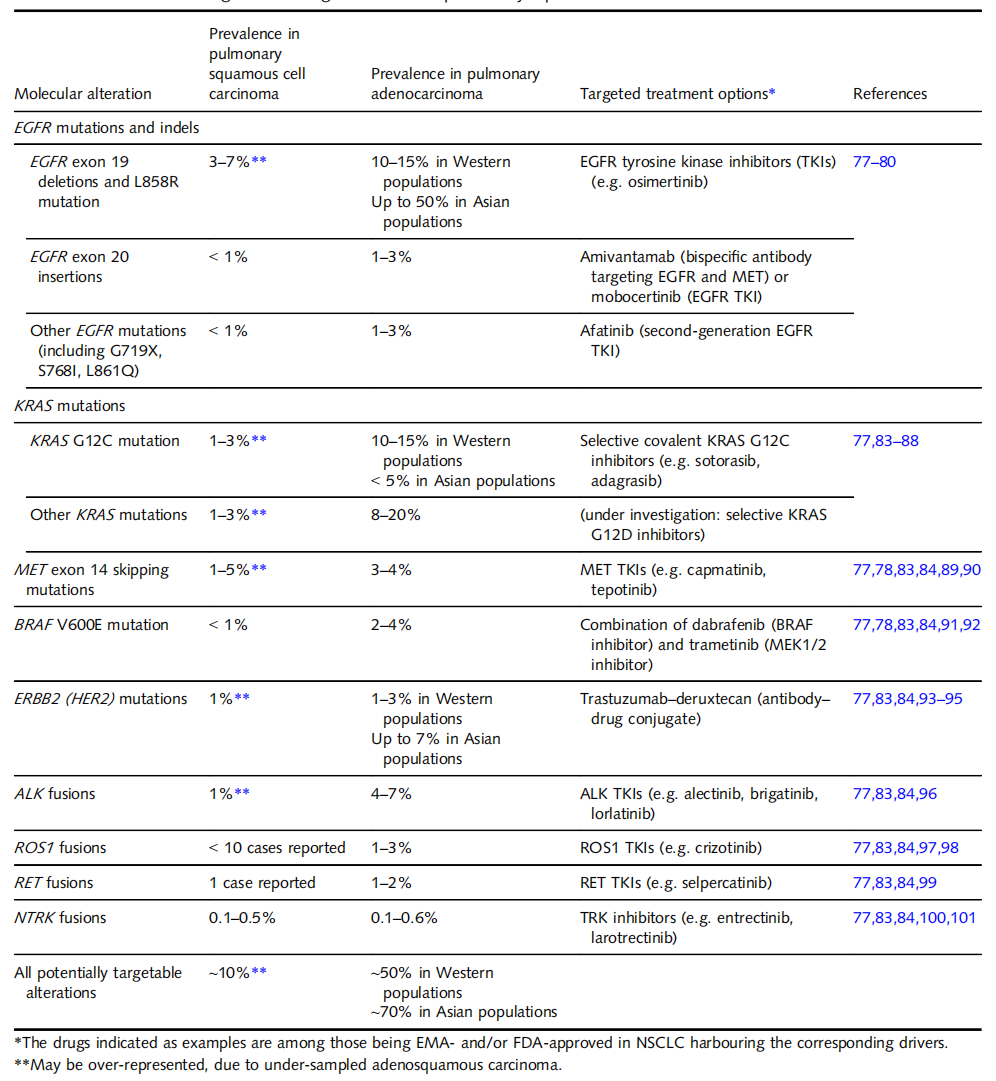
表1. 肺鳞状细胞癌与腺癌中靶向致癌驱动因素
鉴别诊断
与肺外鳞状细胞癌相比,肺鳞状细胞癌没有特异性的形态学或免疫组化特征,因此在实践中,区分原发癌和其他来源的鳞状细胞癌转移的主要方法,是临床病理和影像学表现。PAX8、CD5和CD117(c-Kit)共表达,支持SCC的胸腺起源。
其它来源的癌的转移有时可以模拟非角化的鳞状细胞癌,如尿路上皮癌。包括CK7、CK20、GATA-3、CK14、Desmoglein-3和Uroplakin III在内的免疫组化,可能有助于区分转移性尿路上皮癌和原发性肺癌。CK7、CK20和GATA- 3的表达,提示尿路上皮癌,而CK14的表达,高度提示鳞状细胞癌。
黏液表皮样癌,应与非角化型鳞状细胞癌鉴别,通常为年轻患者。TTF1和Napsin A染色阴性,可产生粘蛋白成分。MAML2重排阳性可以明确诊断。
基底样鳞状细胞癌必须与肺小细胞癌(SCLC)相鉴别。基底样鳞状细胞癌通常不表达更特异的神经内分泌标志物,但CD56可能阳性,这突出了p40在该形态学组中的重要性。
分化差的腺癌,需要与鳞状细胞癌鉴别,呈中等大小的细胞,核仁突出,胞浆致密。由于形态学重叠,建议添加粘蛋白的p40,TTF1相鉴别。腺鳞癌也是鳞状细胞癌的重要鉴别诊断,特别是在小的活检中。腺鳞癌是由不同比例的腺癌和鳞状细胞癌成分的混合物组成,每种成分至少占肿瘤的10%。在这种情况下,应应用粘蛋白染色和TTF1,p40染色来验证诊断。
NUT癌最常见为p40阳性,需要与低分化、非角化鳞状细胞癌和基底样鳞状细胞癌鉴别。它们表现为小到中等大小的单形形态,有明显的核仁和伴有中性粒细胞浸润。突然角化是特征性的,但在不到50%的病例中可见。NUTM1基因重排,可以通过NUT特异性抗体的免疫组化进行评估。
SMARCA4缺陷的未分化肿瘤也与吸烟有关,根据定义,低分化癌通常具有横纹肌样形态,可显示局灶性p40表达,SMARCA4的免疫组化染色将确定诊断。
对于具有基底样特征的鳞状细胞癌和鳞状细胞癌的另一种罕见的鉴别诊断是DEK::AFF2癌,由DEK(外显子7)::AFF2(外显子4、5、6、9)融合定义,该融合可以使用融合特异性抗体检测到。组织学特征是乳头状腔内成分的外生和内生混合模式和具有基底样特征的浸润性病变,缺乏明显的角化(虽然可见局灶性角化珠)。
最后,在角蛋白阴性的肺结节中,应排除转移性恶性黑色素瘤,因为恶性黑色素瘤可能出现各种形态。
淋巴上皮癌
WHO对LEC的基本诊断标准主要是组织形态学,包括非角化鳞状细胞癌组织学,肿瘤细胞呈合胞体样,边界不清。细胞核大,空泡状,有明显的嗜酸性核仁,通常有明显的淋巴浆细胞浸润,位于肿瘤岛之间和内部。可发生局灶性角化、梭形细胞生长和瘤内淀粉样蛋白沉积。
亚洲患者中大约95-100%的肺淋巴上皮癌与EBV相关,而在白人患者中,EBV感染与肺部LEC之间没有关联。因此,EBER原位杂交阳性目前只是一个理想的,而不是一个必要的诊断条件。肺内LEC的细胞形态学特征并没有得到很好的描述和非特异性的。细胞通常形成大簇,具有活跃的有丝分裂活性,并包含大的深染核,通常有突出的核仁,细胞质少,广泛的淋巴细胞浸润。由于组织学和细胞学表现难以区分,临床上排除转移性鼻咽癌(NPC)至关重要。
|
鉴别诊断 |
鉴别线索 |
|
|
鳞状细胞癌 |
腺鳞癌 |
无腺癌成分(注意肿瘤附近的反应性肺细胞) |
|
黏液表皮样癌 |
角化;没有TTF-1阳性的腺体成分;没有MAML2易位 |
|
|
SMARCA4缺陷的未分化肿瘤 |
表达SMARCA4 |
|
|
胸腺鳞状细胞癌 |
PAX8不表达,无CD5和CD117共表达,无胸腺/纵隔肿块 |
|
|
转移性鳞状细胞癌 |
迄今为止没有明确标记物 |
|
|
尿路上皮癌转移 |
临床表现、免疫组化 |
|
|
低分化腺癌 |
p40阳性和TTF1阴性;鳞状分化 |
|
|
基底样鳞状细胞癌 |
小细胞肺癌 |
p40阳性 |
|
大细胞神经内分泌癌 |
p40阳性 |
|
|
淋巴瘤 |
CK阳性 |
|
|
NUT癌 |
NUT阴性 |
|
|
DEK::AFF2融合癌 |
无DEK::AFF2融合 |
|
|
淋巴上皮癌 |
鳞状细胞癌 |
细胞学和组织形态学;淋巴细胞浸润;EBER阳性 |
|
转移性鼻咽癌 |
组织学无法区分 |
|
|
胸腺瘤/胸腺癌 |
PAX8不表达,无CD5和CD117共表达,无胸腺/纵隔肿块 |
|
|
非霍奇金淋巴瘤 |
CK阳性 |
表2. 肺鳞状细胞癌和淋巴上皮癌的鉴别诊断
总结
肺鳞状细胞癌是NSCLC的第二大最常见的组织学类型。在过去的十年中,广泛的研究有助于完善该肿瘤的诊断标准,特别是使用免疫组化来分类形态学上不明确的病变及其分子背景。然而,在诊断和治疗方面仍然存在着挑战。目前的组织形态学挑战,包括如何分级和区分原发性肺肿瘤和转移性鳞状细胞癌于在大多数鳞状细胞癌中缺乏靶向治疗的分子改变,个性化治疗一直滞后。
在LEC的诊断中,模糊的诊断标准具有挑战性,因为不是所有的LEC都与EBV相关,也不是所有与EBV相关的肺癌,都有明显的淋巴浸润,关于LEC的研究正在进行中。
参考文献及书籍:
Berezowska S, Maillard M, Keyter M, Bisig B. Pulmonary squamous cell carcinoma and lymphoepithelial carcinoma - morphology, molecular characteristics and differential diagnosis. Histopathology. 2024 Jan;84(1):32-49. doi: 10.1111/his.15076. Epub 2023 Nov 7. PMID: 37936498.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#肺鳞状细胞癌# #肺淋巴上皮癌#
1