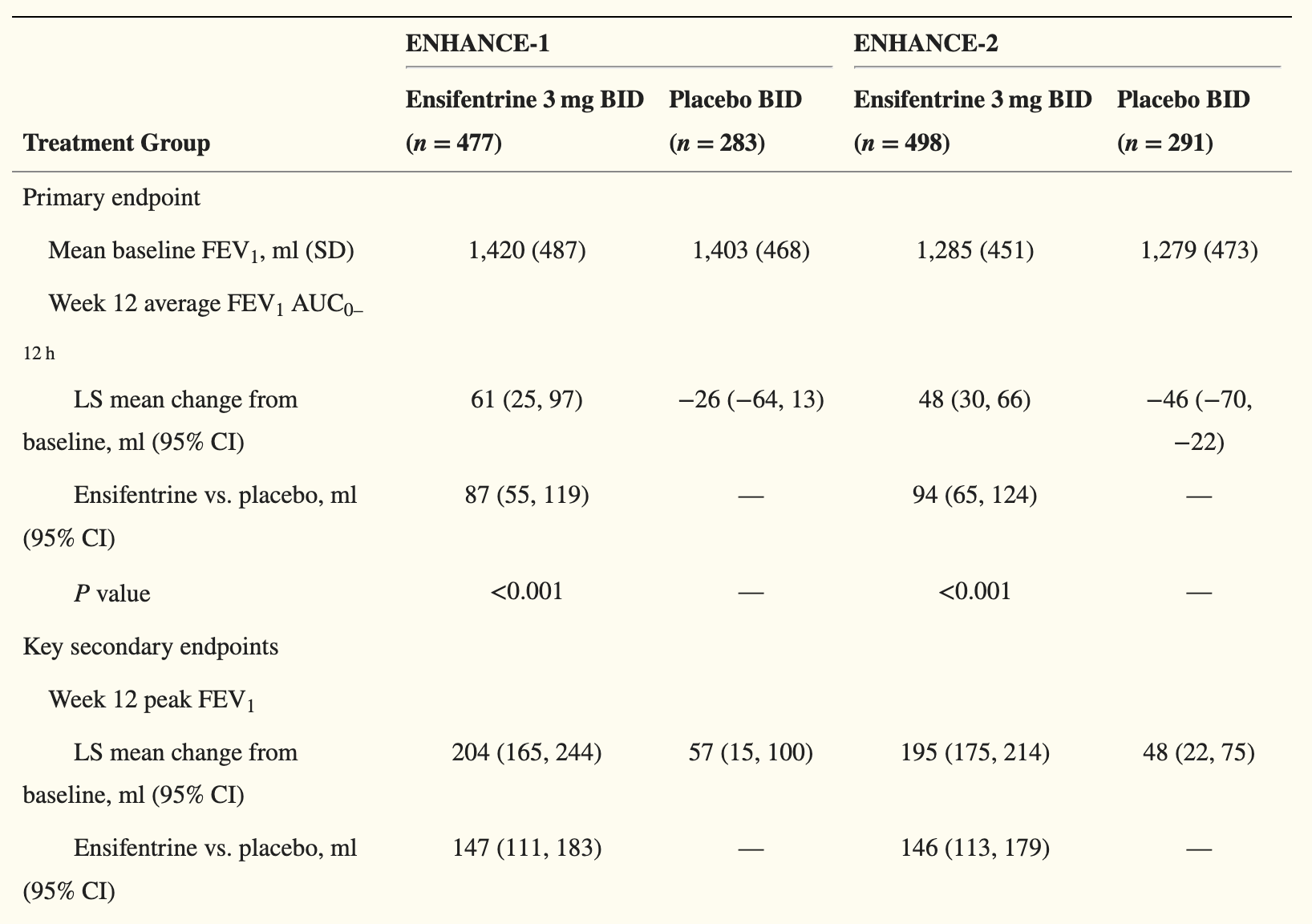
FDA 发布药物相互作用标签指南草案
2024-10-30 识林 识林 发表于上海
FDA 发布指南草案规范人用处方药和生物制品标签中药物相互作用信息,明确应含内容、语言要求、呈现方式等,涉及多方面信息,旨在加强沟通、助力临床决策,同时征求公众对复杂情况记录等的意见。
美国 FDA 于 10 月 21 日发布了《人用处方药和生物制品标签中的药物相互作用信息》的指南草案,描述了在标签的药物相互作用(Drug Interaction,DI)部分应包含和不应包含的内容,以及药物相互作用信息应如何出现在产品标签的其它区域。
FDA 表示,指南的目标是向申请人提供如何在这些产品上编写药物相互作用内容的建议,并“加强对临床上重要的药物相互作用的沟通,并促进医务人员安全有效地使用处方药。”
FDA 指出,“处方药标签必须包含安全有效使用药物所必需的基本信息的摘要,是 FDA 向医务人员传达药物相互作用信息的主要工具。有效传达药物相互作用信息可以为药物的最佳使用和医务人员的临床决策提供信息。”
根据指南草案,申请人必须在“药物相互作用”部分记录观察到或预测的具有临床意义的药物相互作用,包括与非处方药、处方药、药物类别和食物的相互作用,以及对实验室检测的干扰。该部分还必须包含用于预防和管理具有临床意义的药物相互作用的“具体实用性说明”,任何已知药物相互作用机制的描述以及药物相助作用的潜在临床影响。
如果药物相互作用在“禁忌症”或“警告和注意事项”部分,也应将其包括在药物相互作用部分并详细说明。指南指出,“如果相关的药物相互作用信息出现在标签的多个部分,则应使用交叉引用来减少信息冗余。”另外,没有临床显著性的药物相互作用的人用处方药和生物制品应从标签中删除。
在描述临床上显著的药物相互作用时,申请人应使用对医务人员“可理解且具有临床信息”的语言,并让药理学专业知识很少或没有药理学知识的从业人员也能理解。药物相互作用的描述应遵循特定的顺序,从预防或管理说明、已知机制以及药物相互作用的临床影响开始。对于涉及传达不存在临床上显著的药物相互作用的情况,FDA 建议申请人提供说明为什么包含这方面的内容,例如,如果一种药物与特定药物类别中除一种药物外的所有药物都有临床上显著的相互作用。
指南指出,当一种药物干扰实验室结果时,药物相互作用部分应详细说明干扰情况以及“当错误的检测结果会对临床决策产生负面影响时”预防或管理干扰的任何步骤。干扰一项以上实验室检测的药物应在描述该药物对特定实验室检测干扰的小节下记录。
指南指出,“‘药物相互作用’部分的信息通常应以小节形式列出,以增强信息的组织、呈现和可访问性。小节的排序应反映内容的重要性和相对公共卫生的重要性。”
不包含在“药物相互作用部分”的信息类型包括大多数非临床显著的药物相互作用、体外和动物数据、临床药理学部分中重复的药代动力学研究细节、修改剂量或给药的建议、免疫抑制药物对疫苗的免疫反应的降低以及药物不相容性,例如物理或化学反应。
产品处方信息中可能出现药物相互作用信息的其它部分包括黑框警告、剂量和给药、禁忌症、警告和注意事项、临床药理学和患者咨询信息。
FDA 指出,药物相互作用信息也应出现在处方信息的重点部分,并且“必须包括所需信息的简明摘要”,例如临床上重要的药物相互作用和预防或管理的实际说明。
“为尽量减少重点部分中剂量和给药与药物相互作用标题之间药物相互作用信息的冗余和碎片化,应将因药物相互作用引起的剂量修改包含在重点部分的药物相互作用标题下,而不是剂量和给药标题下。”
FDA 指出,有时药物可能具有许多无法总结的临床上重要的药物相互作用。在这些情况下,申请人应包括最关键的药物相互作用并提供声明,以便医务人员知道药物相互作用部分有更多信息。
此外,FDA 还在寻求有关如何记录复杂药物相互作用的意见,并邀请公众对 FDA 网站资源的实用性提供反馈,FDA 网站上可查找到细胞色素 P-450(CYP)酶的临床底物、抑制剂和诱导剂以及转运蛋白的底物和抑制剂。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













药物相互作用标签指南草案
11
#FDA# #药物相互作用#
17