Cancer Cell:上海交通大学赵维莅等团队通过对弥漫性大B细胞淋巴瘤的遗传分型,引导免疫化疗
2023-10-04 iNature iNature 发表于陕西省
该研究报告一项随机II期试验GUIDANCE-01的结果,探讨在新诊断的、中危或高风险弥漫性大B细胞淋巴瘤(DLBCL)的遗传分型指导下,R-CHOP单独或联合靶向药物(R-CHOP-X)。
弥漫性大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤亚型。虽然抗CD20抗体利妥昔单抗、环磷酰胺、阿霉素、vincristine和泼尼松(R-CHOP)免疫化疗可显著改善DLBCL的临床结局,但只有约60%的中危或高危患者在R-CHOP治疗后达到完全缓解(CR)。
2023年9月28日,上海交通大学赵维莅及Xu Peng-Peng共同通讯在Cancer Cell 在线发表题为“Genetic subtype-guided immunochemotherapy in diffuse large B cell lymphoma: The randomized GUIDANCE-01 trial”的研究论文,该研究报告一项随机II期试验GUIDANCE-01的结果,探讨在新诊断的、中危或高风险弥漫性大B细胞淋巴瘤(DLBCL)的遗传分型指导下,R-CHOP单独或联合靶向药物(R-CHOP-X)。
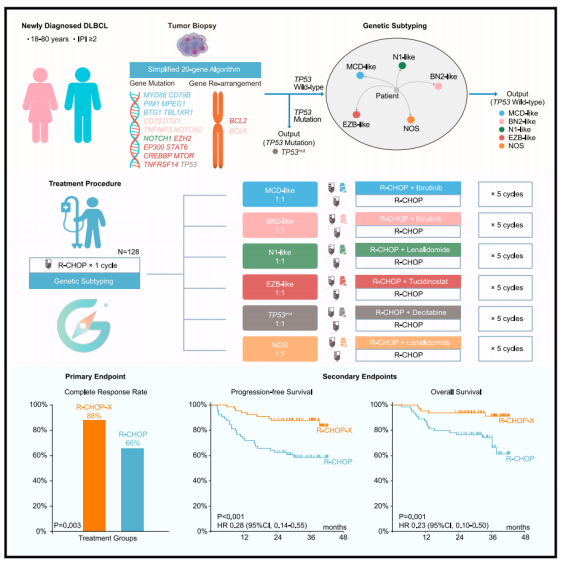
128例患者按1:1的比例随机分为R-CHOP-X组和R-CHOP组。研究达到了主要终点,R-CHOP-X的完全缓解率明显高于R-CHOP(88% to 66%,p = 0.003),总缓解率为92%对73% (p = 0.005)。2年无进展生存率分别为88%和63% (p < 0.001),2年总生存率分别为94%和77% (p = 0.001)。同时,事后RNA测序验证了简化的遗传分型算法和先前建立的淋巴瘤微环境亚型。该研究强调了R-CHOP-X的有效性和安全性,这是一种基于机制的定制治疗,可双重靶向新诊断的DLBCL患者的遗传和微环境改变。

随着新型靶向药物的开发,临床试验的重点是在这些DLBCL患者亚群中联合R-CHOP。在PHOENIX试验中,B细胞受体(BCR)信号通路抑制剂ibrutinib + R-CHOP在60岁以下IPI为2-5.4的非生发中心B细胞(non-GCB)淋巴瘤患者中提供了生存获益。在ROBUST试验中,来那度胺+ R-CHOP改善了IPI为3-5.5的活化B细胞(ABC)淋巴瘤患者的预后。同时,在ECOG-ACRIN E1412试验中,来那度胺+ R-CHOP降低了DLBCL的进展或死亡风险,无论GCB和非GCB亚型最近,在POLARIX试验中,靶向表面抗原CD79b的泊洛妥珠单抗、利妥昔单抗、环磷酰胺、阿霉素和泼尼松延长了所有IPI患者的生存期。这些结果表明,新型靶向药物加免疫化疗是治疗DLBCL的有希望的方法。
分子异质性可能影响DLBCL的临床预后。两项全外显子组测序(WES)研究提出了具有相似遗传特征的遗传亚型,包括MCD/C5集群、BN2/C1集群和EZB/C3集群,而N1、Tp53相关/C2集群和SGK1相关/C4集群等亚型略有不同。最近的研究也证明了通过选定基因的靶向测序简化遗传亚型的可行性。除了肿瘤细胞的遗传改变外,肿瘤微环境在DLBCL进展中起着至关重要的作用。已经定义了四个主要的淋巴瘤微环境(LME)类别,包括生发中心样(GC),其细胞类型常见于生发中心,间充质(MS)表示基质细胞和细胞外基质途径的丰度,炎症(IN)表示炎症细胞和途径的存在,以及由于微环境衍生基因表达总体较低而造成的耗尽(DP)形式。然而,一种基于多种基因亚型选择不同靶向药物的治疗方法尚未被研究。
机理模式图(图源自Cancer Cell)
该研究在一项随机的2期临床试验中检测了遗传亚型引导的靶向药物联合R-CHOP (R-CHOP-X),以评估R-CHOP-X对新诊断的中危或高风险DLBCL患者的疗效和安全性,并探索遗传和LME亚型可能受益于R-CHOP-X。该研究报道了以基因亚型(MCD样、BN2样、N1样、EZB样、TP53mut和NOS)为指导的个体化免疫化疗在新诊断的DLBCL患者中的疗效和安全性。这项随机2期试验显示,R-CHOP-X组的反应率和生存率高于R-CHOP组。同时,R-CHOP-X的安全性是可控的,没有新的临床意义或意想不到的毒性。唯一的方案修改是伊鲁替尼从每天560毫克增加到420毫克,这提高了免疫化疗的强度和依从性。
为了防止靶向测序分析可能造成的治疗延误,ZZ1给予第一周期的R-CHOP以减轻肿瘤负担,然后使用简化的遗传亚型算法来确保第二周期R-CHOP的随机化,从而快速开始治疗并随后入组高危患者。在GUIDE -01试验中,中高风险IPI患者的比例为65%,高于最近新诊断的DLBCL的主要随机试验,如GOYA、PHOENIX、REMoDL-B和ROBUST试验。尽管该试验的设计或功能并不是为了比较患者亚组中的PFS或OS,但探索性亚组分析表明,R-CHOP-X对年龄大于60岁的患者、IPI中高或高风险患者、POLARIX试验中观察到的非GCB亚型患者以及可分类遗传亚型患者有益处。
此外,使用的简化的基因算法可以通过靶向测序和FISH分析输出,而不是WES/WGS,这简化了数据分析的过程,保证了其在临床试验中的应用,以及基于遗传亚型的靶向药物的及时使用。因此,基因亚型引导的靶向药物联合R-CHOP治疗新诊断的DLBCL是有效、安全、临床可行的。随着POLARIX试验令人鼓舞的结果,这种基因亚型指导的靶向药物联合PolaR-CHP (Pola-R-CHP-X)治疗可能进一步改善中危或高危DLBCL患者的临床结果。
淋巴瘤细胞利用遗传和表观遗传机制来逃避DLBCL的微环境限制。地西他滨还通过增强T细胞介导的抗肿瘤反应来调节TP53mut DLBCL的肿瘤微环境IN-和DP-LME患者最初在R-CHOP治疗中表现为预后最差,但R-CHOPX(主要用依鲁替尼和来那度胺治疗)使患者受益。正如预期的那样,IN-LME由CD8+ T细胞、中性粒细胞和巨噬细胞组成,所有这些细胞都可以被伊鲁替尼和来那度胺靶向。与其他LMEs相比,DP-LME的特点是微环境来源的细胞总体较少,但增殖基因特征增加来那度胺通过调节细胞周期蛋白依赖性激酶诱导细胞周期阻滞和抑制恶性B细胞增殖。同时,该研究表明,伊鲁替尼可以抵消DP-LME中BCR信号通路的激活。最后,值得指出的是,NOS患者可以根据LME分类进一步划分,这为缺乏遗传特征的DLBCL亚群提供了靶向药物的替代选择。
原文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00320-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言