肺癌脑转移患者放疗期间cfDNA基因突变检出率如何?脑脊液vs血浆
2024-01-15 苏州绘真医学 苏州绘真医学 发表于陕西省
本研究探索了NSCLC-BM患者RT期间CSF cfDNA的动态变化和外周血T细胞亚群的频率。
在过去的几十年中,开发了针对非小细胞肺癌(NSCLC)脑转移(BM)的放疗(RT)。然而,缺乏治疗反应预测性生物标志物限制了NSCLC-BM的精准治疗。为了寻找RT预测性生物标志物,本研究探索了NSCLC-BM患者中RT对脑脊液(CSF)游离DNA(cfDNA)的影响以及T细胞亚群比例。共纳入 19 例诊断为 NSCLC-BM 的患者。在RT前、RT期间和RT后收集 19 例患者的CSF和 11 例患者的匹配血浆样本。提取CSF和血浆中的cfDNA,通过二代测序(NGS)计算CSF肿瘤突变负荷(cTMB)。使用流式细胞术分析外周血T细胞亚群比例。在有匹配样本的患者中,CSF cfDNA检出率高于血浆cfDNA。RT后CSF cfDNA突变丰度降低。RT前后cTMB没有显著差异。cTMB 降低或检测不到的患者的中位颅内无进展生存期(iPFS)未达到,这些患者的iPFS趋向于长于cTMB稳定或增加的患者(HR 0.28,95% CI 0.07–1.18,P = 0.067)。RT后外周血CD4+ T细胞比例降低。本研究表明,cTMB或可作为NSCLC-BM患者的预后生物标志物。
研究背景
脑转移(BM)在晚期非小细胞肺癌(NSCLC)常见且致命。约10%的BM发生于新诊断的NSCLC患者,25%-40%发生于根治性治疗后。尽管靶向治疗、免疫治疗和放疗(RT)在过去十年中取得了快速进展,但NSCLC-BM的临床结局和生活质量相对较差。NSCLC-BM患者缺乏循证管理。最近,随着对癌症驱动基因的深入研究和新型靶向疗法的出现,一些靶向药物可以穿过血脑屏障,在一段时间内预防或控制脑转移。然而,治疗疗效仅限于无症状或稳定BM,部分患者最终会出现中枢神经系统进展。
RT是NSCLC BM的标准治疗方法。对于具有驱动基因突变的患者,靶向治疗联合RT可能对这些患者有效。然而,既往发表的回顾性临床研究的结论并不一致。目前,治疗疗效的评估主要基于影像学,不能立即反映治疗效果,也不能反映RT对BM分子克隆的影响,无法指导临床医生设计个体化治疗方案。因此,迫切需要可以预测联合治疗疗效的生物标志物。
免疫检查点抑制剂(ICI)可以恢复免疫细胞的活力,对于无驱动基因突变或对多种靶向疗法耐药的患者,ICI是另一种有前途的治疗方法。研究显示,ICI联合RT可相互增强NSCLC BM治疗疗效。然而,尚不清楚RT是否会诱导和刺激NSCLC BM患者的免疫系统。
最近有研究报道,脑脊液(CSF)游离DNA(cfDNA)基因突变检出率高于血浆cfDNA,可以及时反映治疗疗效。此外,基于覆盖>1 Mb基因组区域的NGS大panel,可以准确计算肿瘤突变负荷(TMB)。本研究探索了NSCLC-BM患者RT期间CSF cfDNA的动态变化和外周血T细胞亚群的频率。我们首次发现NSCLC-BM患者RT前后CSF肿瘤突变负荷(cTMB)的变化可预测颅内无进展生存期(iPFS)。
研究结果
患者特征
纳入了19例2018年3月至2020年1月期间在南方医科大学或广东三九脑科医院诊断为NSCLC BM的患者。在RT前、RT期间和RT后收集 19 例患者的CSF和 11 例患者的匹配血浆样本。基线人口统计学和临床特征见表1。5例患者(D06、D07、S01、S03、S08)经CSF细胞学检查诊断为软脑膜转移。3例患者(S02、S05、S07)通过神经系统症状和钆增强MRI发现软脑膜转移。值得注意的是,4例患者(D01、D04、D07、S11)在RT期间未接受任何同步系统治疗。
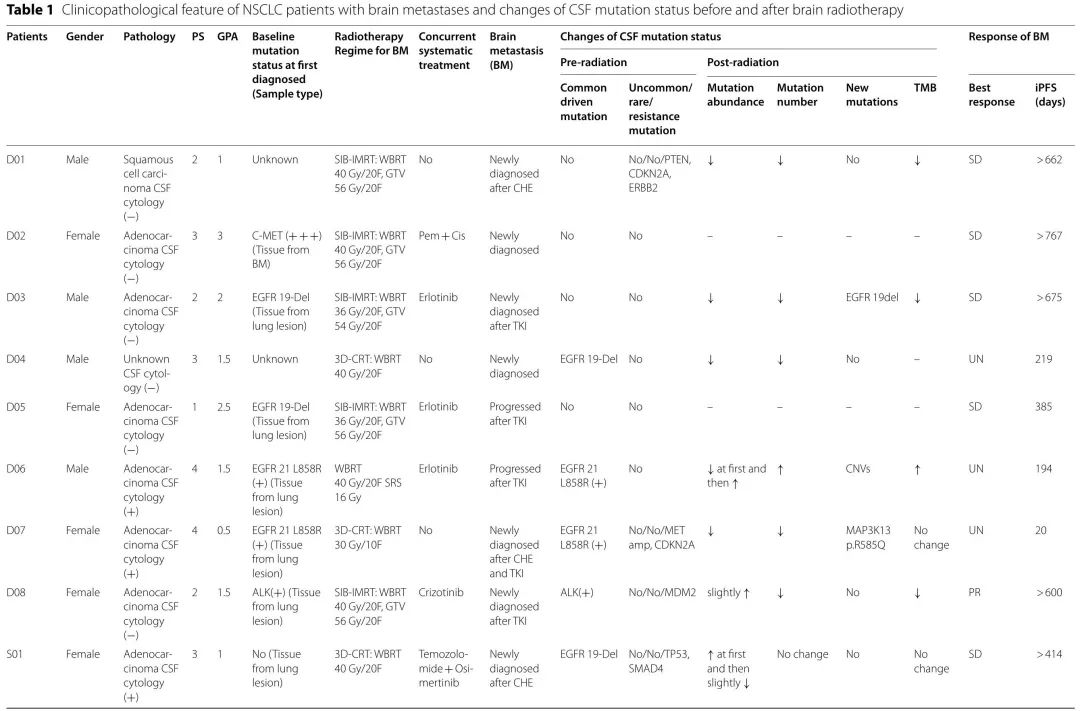

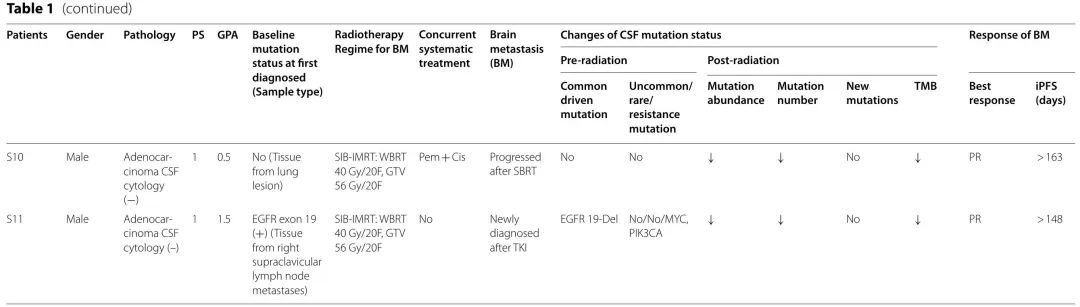
表1
RT对NSCLC-BM患者CSF cfDNA的影响
比较了RT前、RT期间和RT后CSF cfDNA水平。RT后,D07 CSF cfDNA量明显增加,D06和S01 CSF cfDNA量减少,其他患者RT后CSF cfDNA量无明显变化(图1)。队列中,RT期间和RT结束时CSF cfDNA检出率略低于RT前。正如预期的那样,在验证队列中,CSF cfDNA检出率高于血浆 cfDNA(图2A)。除D06外,大多数患者RT前后变异类型的组成相似,许多拷贝数变异发生于RT结束时。RT后CSF突变丰度较RT前显著增加(图2B)。
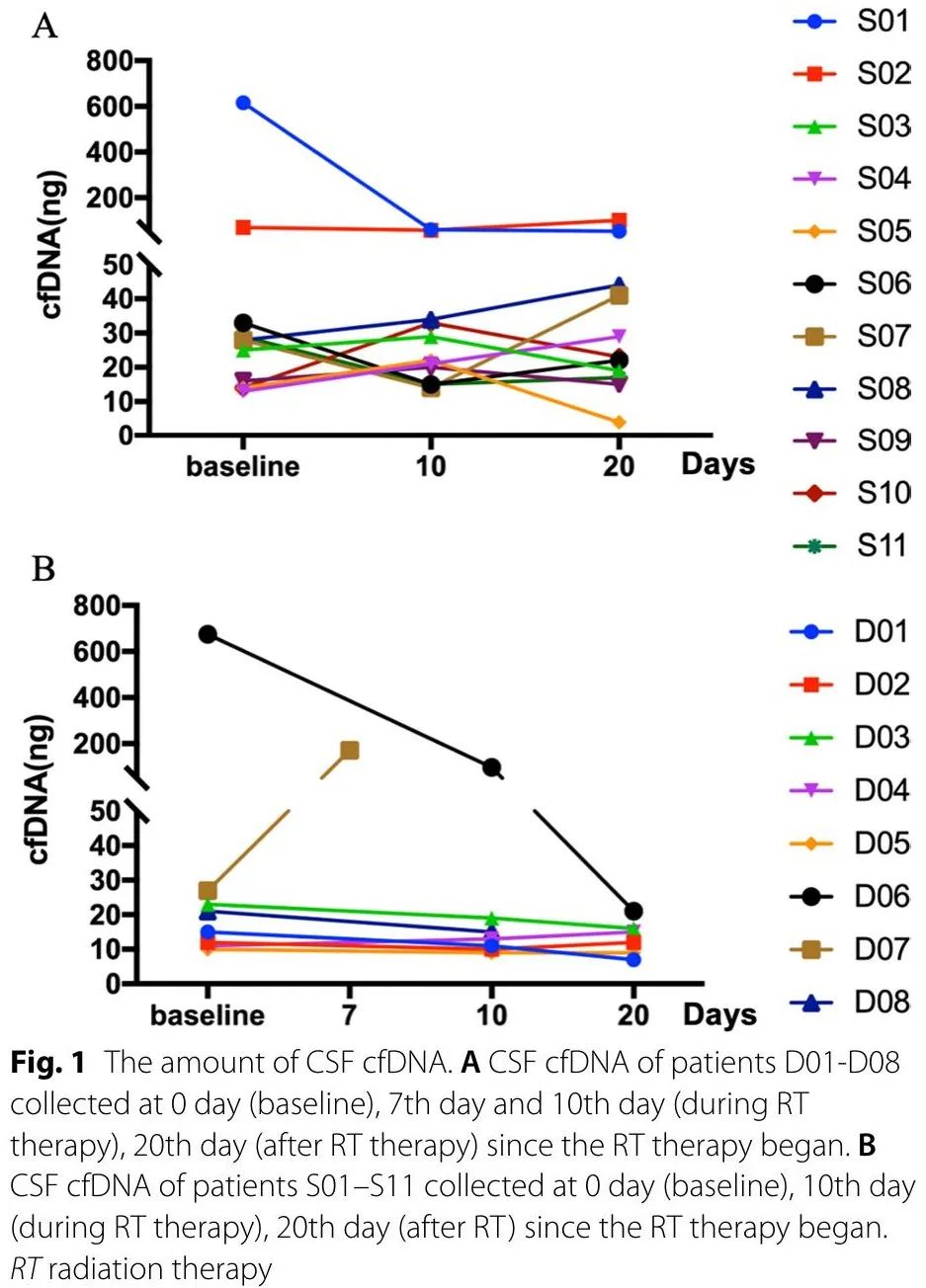
图1
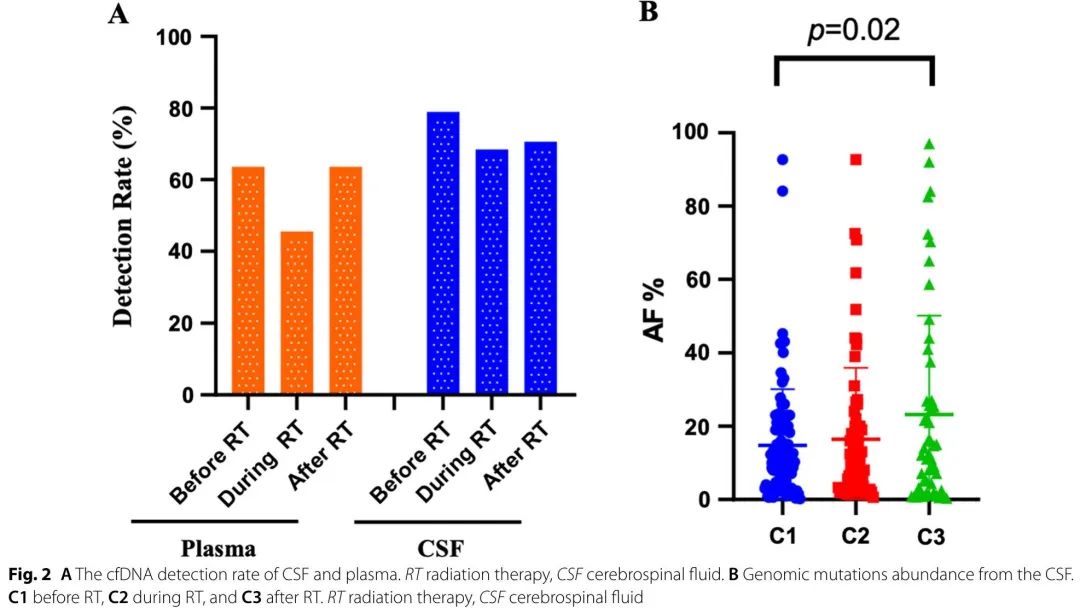
图2
13例患者(D01、D03、D04、D07、D08、S01、S02、S03、S05、S06、S07、S10、S11)CSF突变丰度最初增加,随后RT期间下降,突变数量稳定或减少(图3)。相反,D06、S04、S08在RT后CSF突变丰度和突变数量明显增加。7例患者(D03、D06、D07、S03、S04、S06、S08)在RT结束时检测到新的突变。D03、S03和S04检测到的新突变在配对的肿瘤组织或血浆样本中也检测到。此外,D02、D05和S09在RT前、RT期间或RT后CSF均未检测到突变。
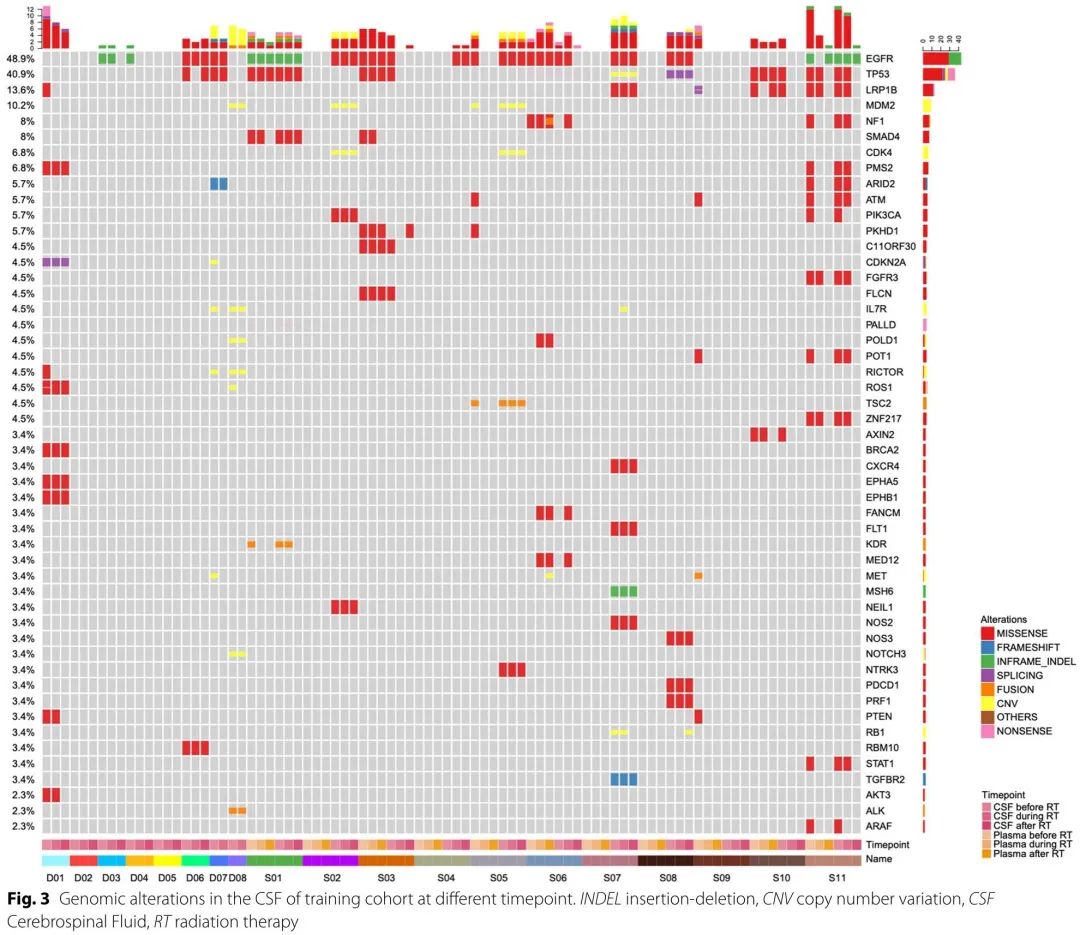
图3
比较系统治疗进展后新出现BM的患者(2/5)或初诊时伴有BM患者(2/6),既往研究中报告的罕见或耐药突变在系统治疗后新出现BM的患者中较常见(6/7)。在RT期间,这些突变的数量和丰度有所下降。
RT前后CSF TMB(cTMB)没有显著差异(图4A)。cTMB降低或检测不到的患者中位颅内无进展生存期(iPFS)未达到,这些患者的iPFS趋向于长于cTMB稳定或增加的患者(中位:4.43个月,范围:0.23-8.63个月)(HR 0.28,95% CI 0.07-1.18,P = 0.067)(图4B)。
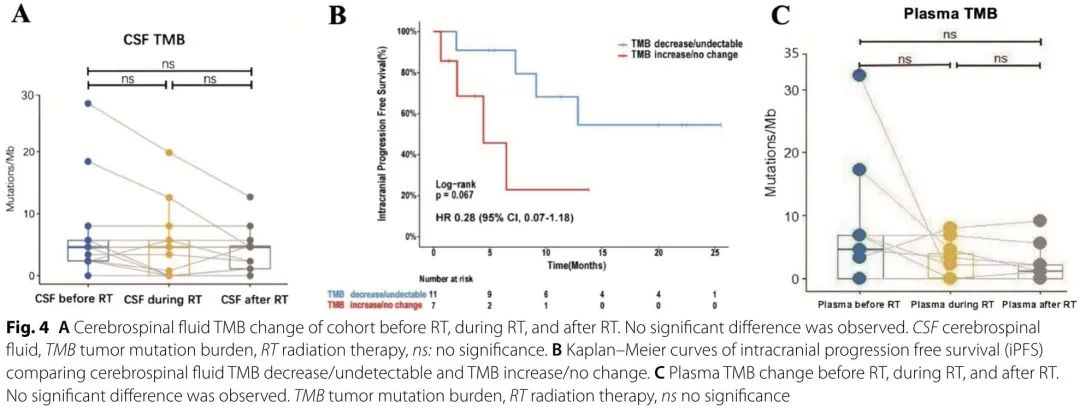
图4
iPFS的危险因素
为了确定预测接受RT±EGFR-TKI治疗的BM患者iPFS的独立危险因素,我们进一步基于脑转移诊断类型、软脑膜受累、体能状态(PS)评分、分级预后评估(GPA)评分和RT结束时新突变检出情况进行了亚组分析。没有发现显著的独立危险因素,可能是由于样本量有限和随访时间短。在本研究中,初始 EGFR-TKI±化疗后 BM进展的患者(6.47个月)的中位 iPFS 往往短于初诊时伴有 BM 的患者(未达到)和系统治疗(有或无TKI)后新出现 BM 的患者(9.13个月)。原因可能为初始EGFR-TKI±化疗后BM进展的患者很多生存结局非常糟糕,或者非挽救性RT可能使 BM患者获益。确切的原因值得进一步探索。
BM RT对血液免疫指标的影响
与之前的结果一致,RT前后血浆TMB无显著差异(图4C)。此外,分析外周血中T细胞亚群的变化,观察到RT后CD4+幼稚T细胞比例显著降低。RT期间,总T细胞、自然杀伤(NK)细胞和B细胞比例的变化在统计学上不显著,但总T细胞和B细胞的比例呈上升趋势。调节性T(Treg)细胞,一种抑制性T细胞,没有显著变化。我们没有发现其他T细胞亚群的比例发生显著变化,包括记忆T细胞(CD4+CD45RO+),细胞毒性T细胞(CD3+CD8+),辅助性T细胞(CD3+CD4+),CD8+ CD28+ T细胞和CD8+ CD28- T细胞。
讨 论
BM 对大多数临床医生来说是一个挑战,全脑放疗(WBRT)是公认的标准方法,对这些患者有效。尽管一些关于靶向治疗的研究对RT用于驱动基因突变BM患者提出了挑战,目前仍缺乏头对头临床试验比较单独靶向治疗与靶向治疗联合RT的疗效。因此,靶向治疗与RT联合治疗BM仍然存在争议,引起临床的强烈关注。NSCLC BM单独RT或联合治疗的疗效评估除影像学外,仍然有限。NGS的发展提供了一种新的方法,可以通过分析CSF评估治疗效果。
2020年美国临床肿瘤学会(ASCO)年会上公布的一项研究显示,从开始RT(胸:2.5-4.0 Gy/F;脑:6-9 Gy/F)到ctDNA量达到峰值的中位时间为2日(IQR:1-3日)。在血浆中,ctDNA只占cfDNA的一小部分,因为大多数cfDNA来源于非肿瘤细胞,尤其是血细胞。与血浆cfDNA相比,CSF cfDNA大多来源于肿瘤裂解。在RT期间和RT后,肿瘤细胞破坏导致细胞内内容物(包括cfDNA)的释放。在本研究中,只有 5.3%(1/19)的患者 CSF cfDNA 量显著增加,10.5%(2/19)的患者显著减少。RT期间(开始后 10-14 天)和/或RT结束时(开始后 26-28 天)相比RT前,未发现 CSF cfDNA 的动态变化。CSF cfDNA 新突变检出率与先前研究报告的一致,在本研究中,21%(4/19)的患者治疗后 CSF cfDNA 检测到新突变。值得注意的是,3 例患者(D03、S03、S04)RT结束时检测到的新突变在相应的肺肿瘤或血浆样本中也检测到。研究表明,放疗诱导的肿瘤溶解可能增加CSF cfDNA检出率。
据报道,EGFR-TKI获得性耐药机制包括EGFR T790M突变、MET或ERBB2扩增,EGFR-TKI进展时间较短与ERBB2、MET和TP53突变相关。此外,肺癌中CDKN2A缺失和EGFR突变共存通常提示对EGFR-TKI治疗反应较差。对EGFR-TKI耐药的亚克隆可能起源于多种基因变异,包括肿瘤干细胞中TP53突变、CDKN2A缺失和RB1缺失。Kenji Sugio报道,PTEN缺失可能导致罕见EGFR G719X突变患者EGFR-TKI获得性耐药。研究发现,在NSCLC患者中,MDM2扩增可诱导EGFR-TKI原发性耐药,并预测不良预后。CDC73、SMAD4、RB1和PIK3CA也可能在EGFR-TKI原发性耐药中发挥重要作用。此外,Keunchil Park发现,在初始EGFR-TKI失败后接受第三代TKI的患者中,TP53、RB1、PTEN和MDM2基因变异也与PFS较差独立相关。在本研究中, 52.63%(10/19)的患者检测到与 EGFR-TKI 获得性或原发性耐药相关的突变。除S08外,其他患者EGFR-TKI耐药相关突变的丰度或数量在RT期间均有不同程度的降低。值得注意的是,这些患者中有 70%(7/10)iPFS较长(> 110 天),这提示单独RT或 EGFR-TKI 联合 RT 可能有效减少或消除 NSCLC BM 中 EGFR-TKI 耐药克隆。
本研究使用了大panel(> 300 个基因),还计算了CSF肿瘤突变负荷(cTMB)并探索了其在 BM 患者中的临床价值。值得注意的是,cTMB 降低或检测不到的患者的中位 iPFS 长于cTMB稳定或增加的患者。然而,这一发现需要通过多中心、大队列研究得到验证。cTMB是否可以像血液TMB一样作为预后生物标志物,这在很大程度上仍然未知,需要进一步研究。此外,本研究还初步探索了BM RT是否会刺激免疫系统反应。基于对血液和血浆TMB淋巴细胞亚群的分析,我们发现BM RT对免疫系统的影响不确定。
在晚期NSCLC BM患者中,RT与治疗获益相关。CSF cfDNA基因突变检出率高于血浆cfDNA,可能是更有价值的RT疗效预测标志物。RT前后血浆TMB无显著差异,RT后CD4+幼稚T细胞比例显著降低。综上所述,这些结果表明,放疗诱导的肿瘤溶解可能提高CSF cfDNA检出率。单独RT或EGFR-TKI联合RT可能有效减少或消除NSCLC BM EGFR-TKI耐药克隆。未来评估真实世界NSCLC BM患者群体将明确CSF cfDNA的预测价值。
参考文献:
Qiao S, Hao Y, Cai L, Duan X, Wang L, Zhou A, Zhu X. Prognostic value of cell-free DNA in cerebrospinal fluid from lung cancer patients with brain metastases during radiotherapy. Radiat Oncol. 2023 Mar 11;18(1):50. doi: 10.1186/s13014-023-02239-y. PMID: 36906568; PMCID: PMC10007729.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言