Nat Commun 海军军医大学药学院王培团队等揭示免疫检查点相关性心肌炎的分子机制
2024-08-11 论道心血管 论道心血管 发表于上海
研究阐明了GSDME介导的焦亡驱动ICIs相关性心肌炎的作用及分子机制。
免疫检查点抑制剂(ICIs)改变了肿瘤治疗的格局,然而ICIs使用过程中出现了免疫相关不良事件(irAEs),其中ICIs相关性心肌炎虽发病率低,但致死率高。目前,ICIs相关性心肌炎的分子基础尚不清楚。焦亡作为一种新型的调节性细胞死亡形式,特点是Gasdermins (GSDMs)介导的膜孔形成和强烈的炎症。
2024年8月5日,海军军医大学药学院王培教授团队与同济大学附属第十人民医院药学部沈甫明/李冬洁教授团队开展合作,在Nature Communications发表题为“Gasdermin-E-mediated pyroptosis drives immune checkpoint inhibitor-associated myocarditis via cGAS-STING activation”的研究论文,阐明了GSDME介导的焦亡驱动ICIs相关性心肌炎的作用及分子机制。

首先,研究者发现在荷瘤小鼠上使用过量PD-1抗体进行长期治疗后,心脏内出现心肌炎症状,且出现了GSDME介导的焦亡,表现为GSDME的mRNA和蛋白水平上调、线粒体膜完整性被破坏、白细胞浸润等。在使用PD-1抗体治疗且发生疑似心肌炎的患者血液中也检测到GSDME的上升,提示GSDME介导的细胞焦亡可能在PD-1抗体诱导的心肌炎中发挥潜在作用。
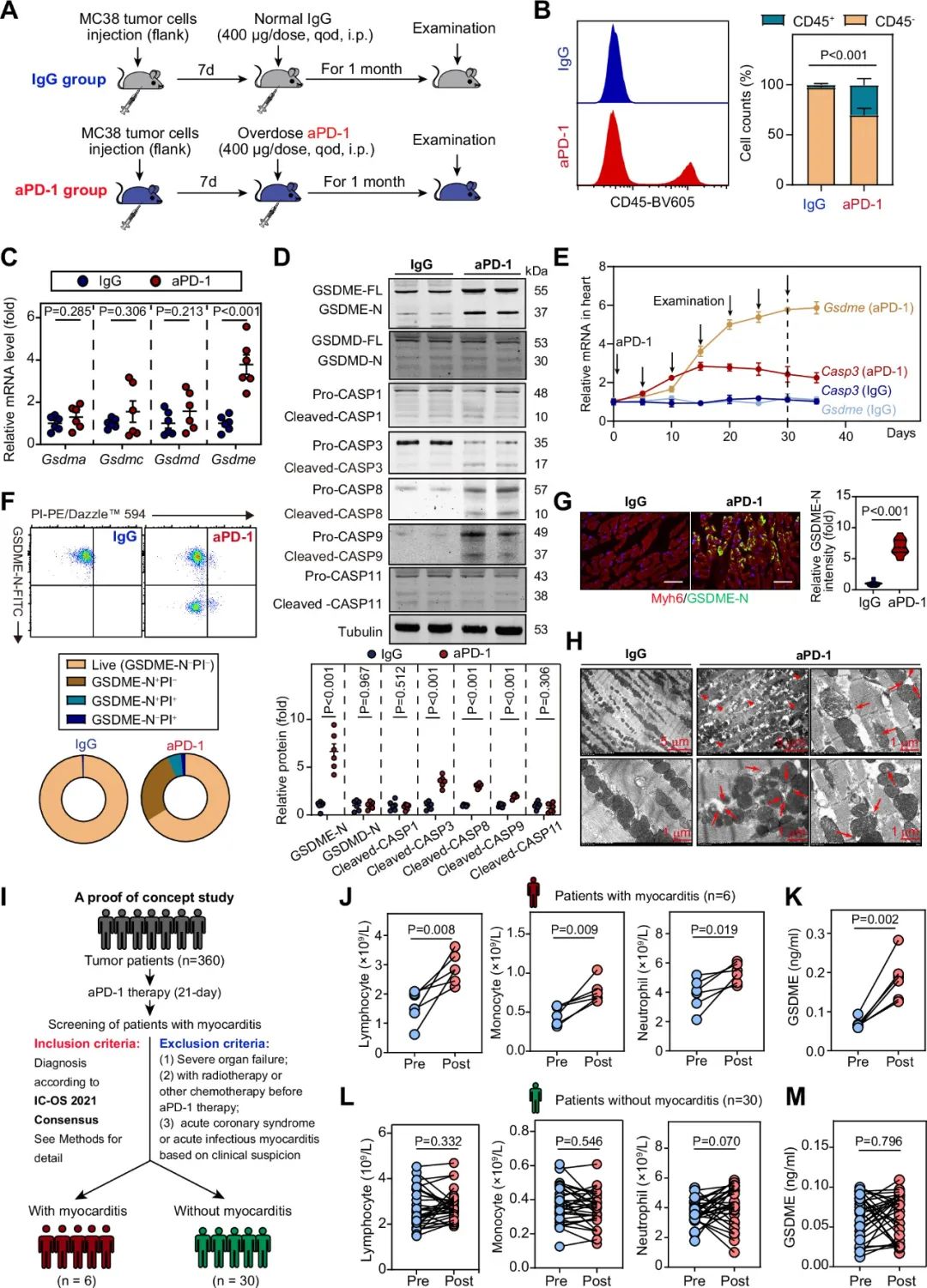
图1. GSDME介导的细胞焦亡在接受PD-1抗体治疗的小鼠和癌症患者中被激活
接下来,研究者使用GSDME敲除小鼠,探究GSDME在过量PD-1抗体在荷瘤小鼠上诱导的心肌炎中的作用,发现GSDME敲除减轻了PD-1抗体所诱导的心肌肥大、免疫细胞浸润、左室收缩功能下降、心肌损伤生物标志物的释放、纤维化、线粒体损伤等。这些结果表明,GSDME的缺失减轻了PD-1抗体治疗诱导的心肌炎和线粒体损伤。
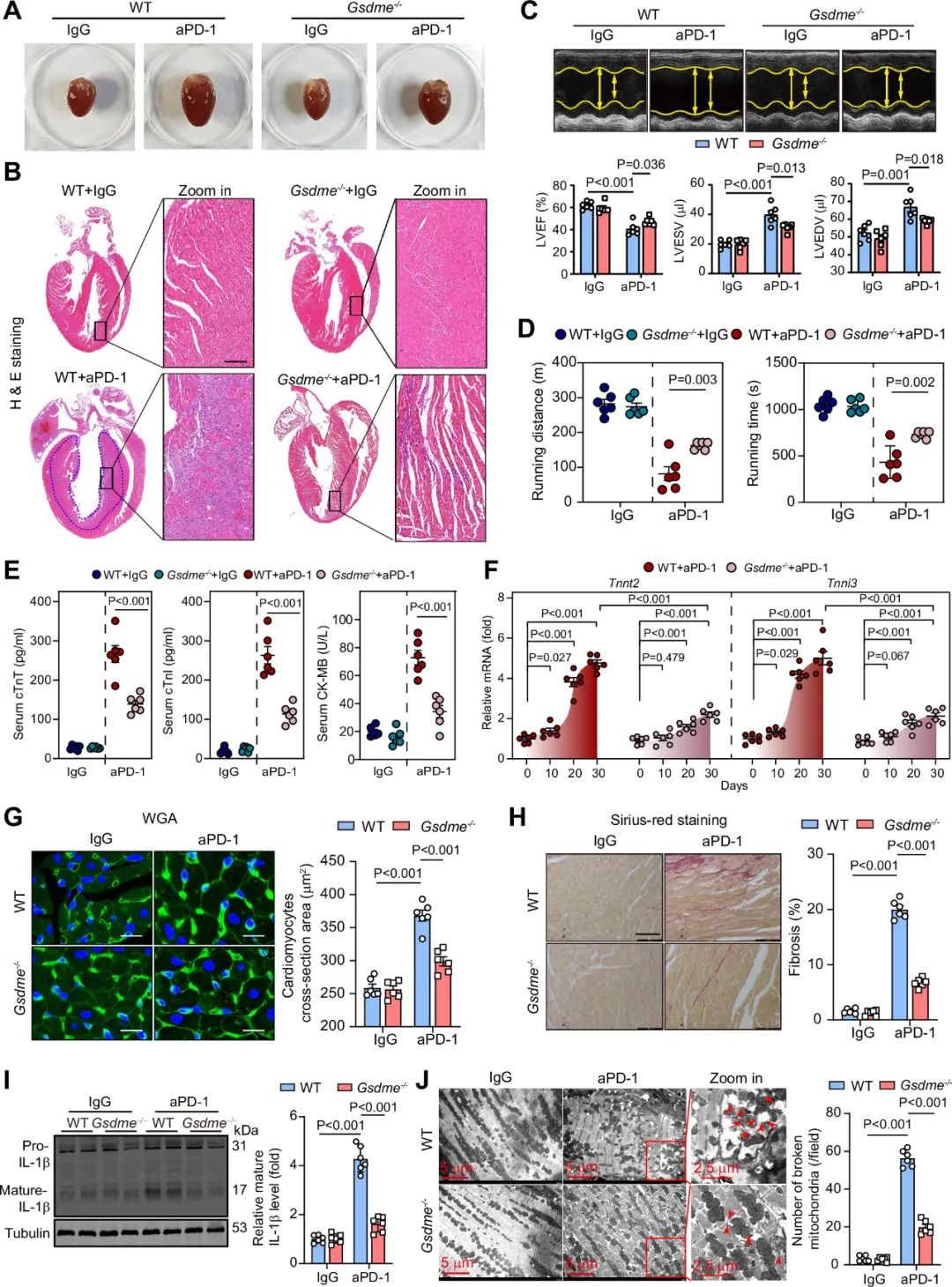
图2. GSDME的缺失减轻了PD-1抗体治疗诱导的心肌炎和线粒体损伤
鉴于免疫细胞浸润是ICIs相关性心肌炎的关键特征,研究者首先评估了模型中的T细胞活化和浸润。研究者通过免疫组化发现,使用PD-1抗体后,和WT小鼠相比,GSDME敲除小鼠的心脏内的T淋巴细胞浸润减少;使用流式发现GSDME敲除减少了心脏内CD4+ T细胞和CD8+ T细胞的比例,尤其是效应记忆T细胞(TEM)。针对CD4+ T细胞进一步分析,研究者发现GSDME敲除减少了促炎性的Th1和Th17的浸润,但增加了抑炎性的Th2的浸润。研究者使用PCR发现GSDME敲除减少Prf1、Gzmb、IFN-g、Il-17a的表达,但增加了Il-10和Il-4的表达。以上结果表明,GSDME的缺失减轻了PD-1抗体治疗诱导的T细胞激活和心脏浸润。
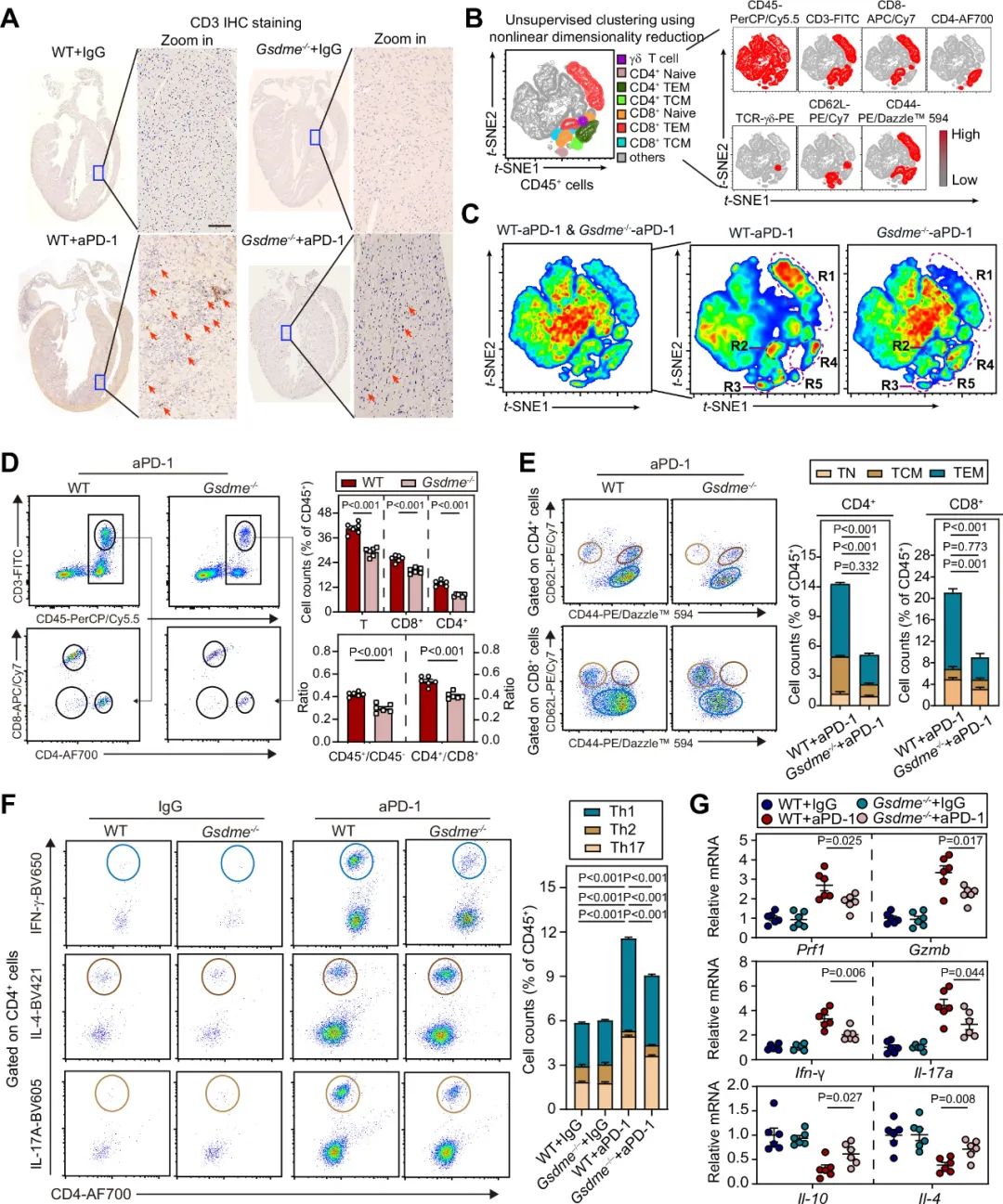
图3. GSDME的缺失减弱PD-1抗体治疗诱导的T细胞激活和心脏浸润
髓系细胞过度激活也是ICIs相关性心肌炎的特征之一。研究者通过免疫组化、流式和PCR发现GSDME的敲除抑制了髓系细胞的浸润,减少了心脏内的Ly6Chi单核细胞、CCR2-MHCIIhi巨噬细胞、CCR2+MHCIIhi巨噬细胞的数量,但增加了Ly6Clo单核细胞和CCR2-MHCIIlo巨噬细胞的数量。
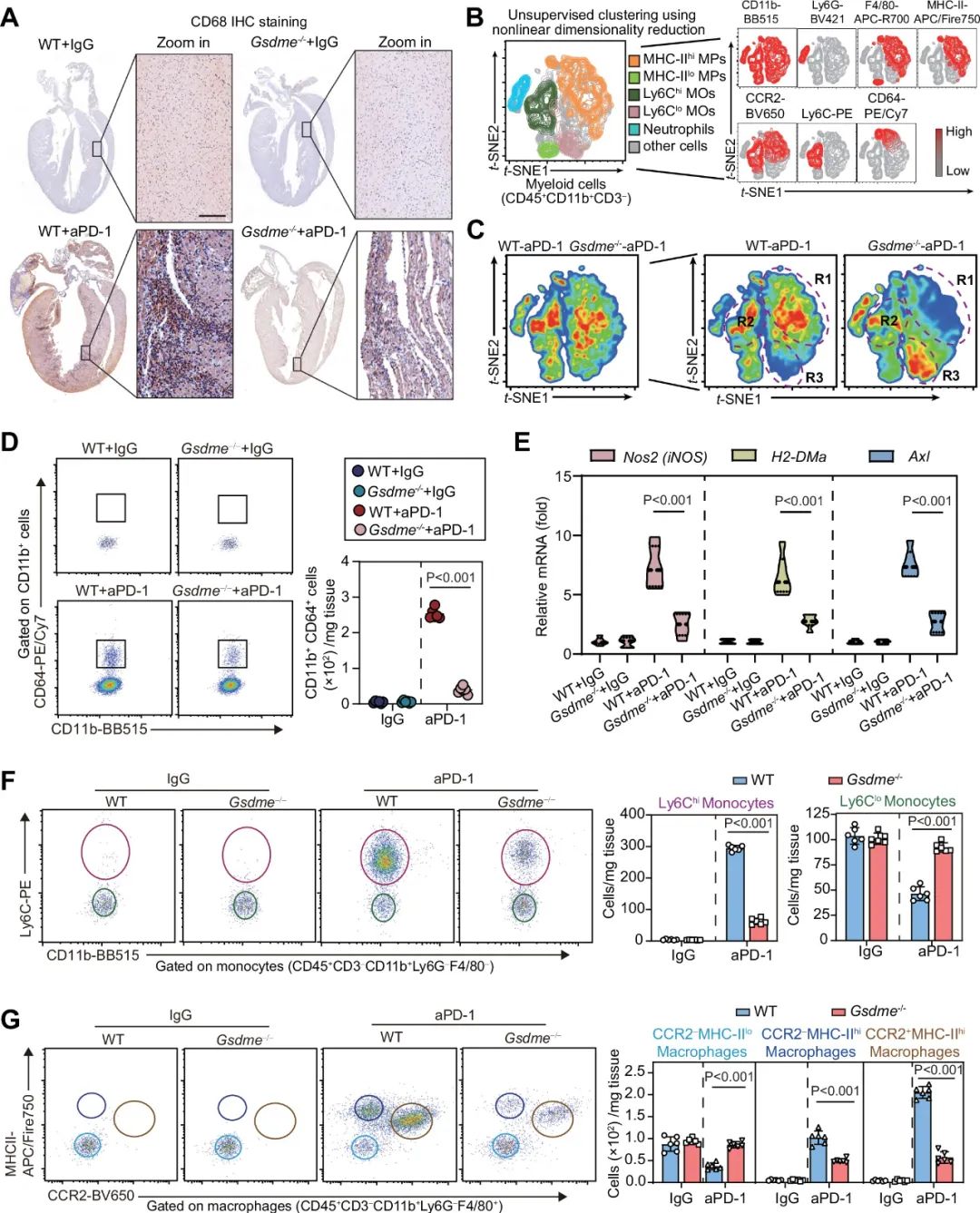
图4. GSDME的缺失减少PD-1抗体治疗诱导的髓系细胞活化和心脏浸润
研究者将Pdcd-/-和Gsdme-/-杂交,得到Pdcd-/- Gsdme-/-双敲除小鼠,并引入第二种ICIs相关心肌炎模型,即在Pdcd-/-小鼠上使用CTLA4抗体,通过H&E、免疫组化和流式发现Pdcd-/- Gsdme-/-小鼠心脏内的T细胞浸润和激活少于Pdcd-/-小鼠。
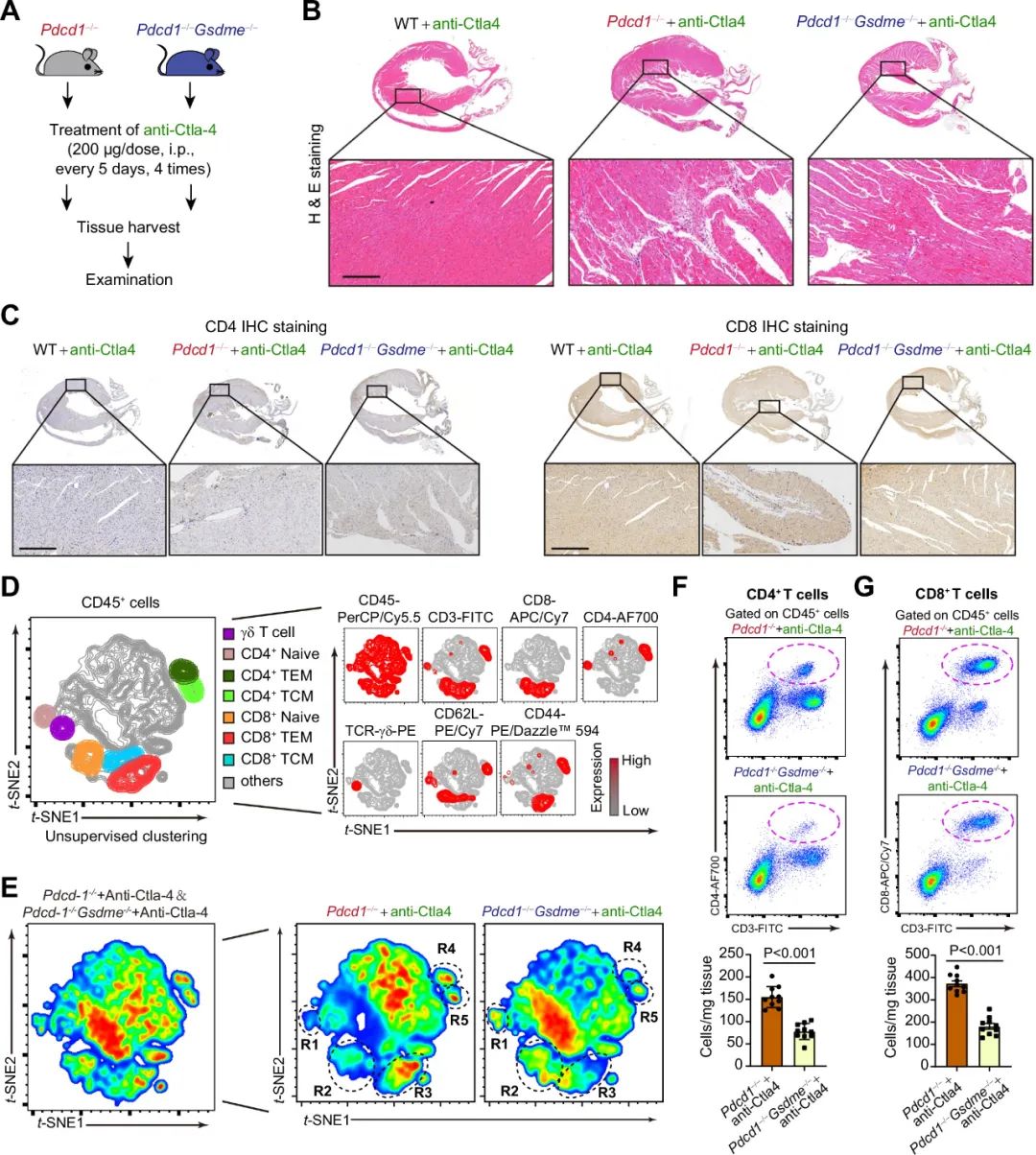
图5. Pdcd1−/−和Pdcd1−/−Gsdme−/−小鼠在接受anti-Ctla4抗体治疗后心脏T细胞浸润存在显著差异
同样的,研究者利用免疫组化和流式探究使用CTLA4抗体的Pdcd-/- Gsdme-/-小鼠和Pdcd-/-小鼠心脏内的髓系细胞的情况,发现与Pdcd-/-小鼠相比,Pdcd-/- Gsdme-/-小鼠心脏内的NOS2+细胞减少,Ly6Chi单核细胞减少,Ly6Clo单核细胞增加,CD68+细胞减少。
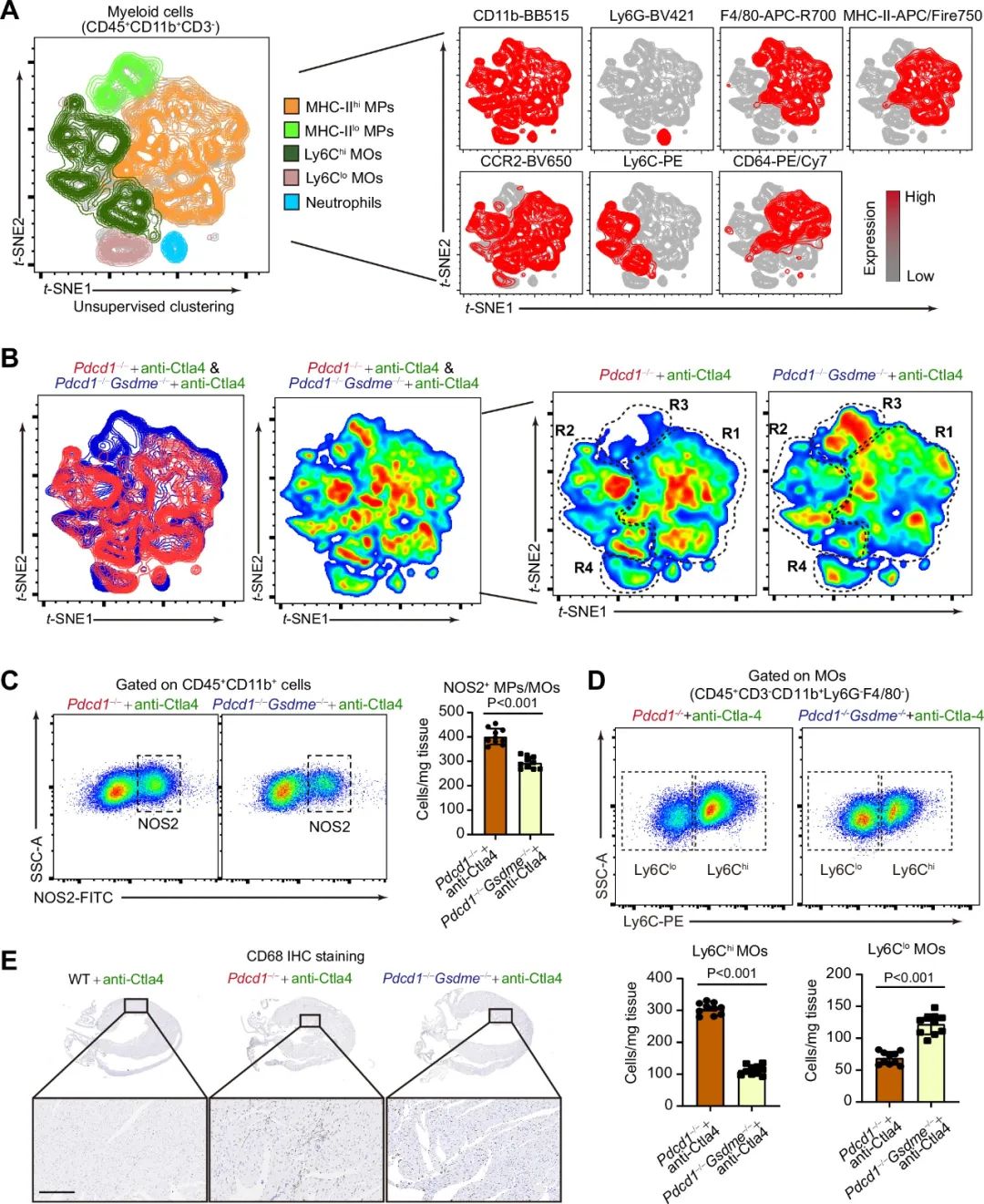
图6. Pdcd1−/−和Pdcd1−/−Gsdme−/−在接受anti-Ctla4抗体治疗后心脏髓系细胞浸润存在显著差异
为了解析心脏中哪种细胞发生了ICIs诱导的细胞焦亡,研究者构建了GsdmeStop/Stop小鼠,并将其与Myh6-Cre、Lysm-Cre小鼠杂交得到GSDME心肌细胞特异性恢复表达小鼠(GsdmeCR)和髓系细胞特异性恢复表达小鼠(GsdmeMR)。研究者发现,GsdmeCR而非GsdmeMR重现了ICIs诱导的心肌肥大、免疫细胞浸润、左室收缩功能下降、心肌损伤生物标志物的释放、纤维化、线粒体损伤等。
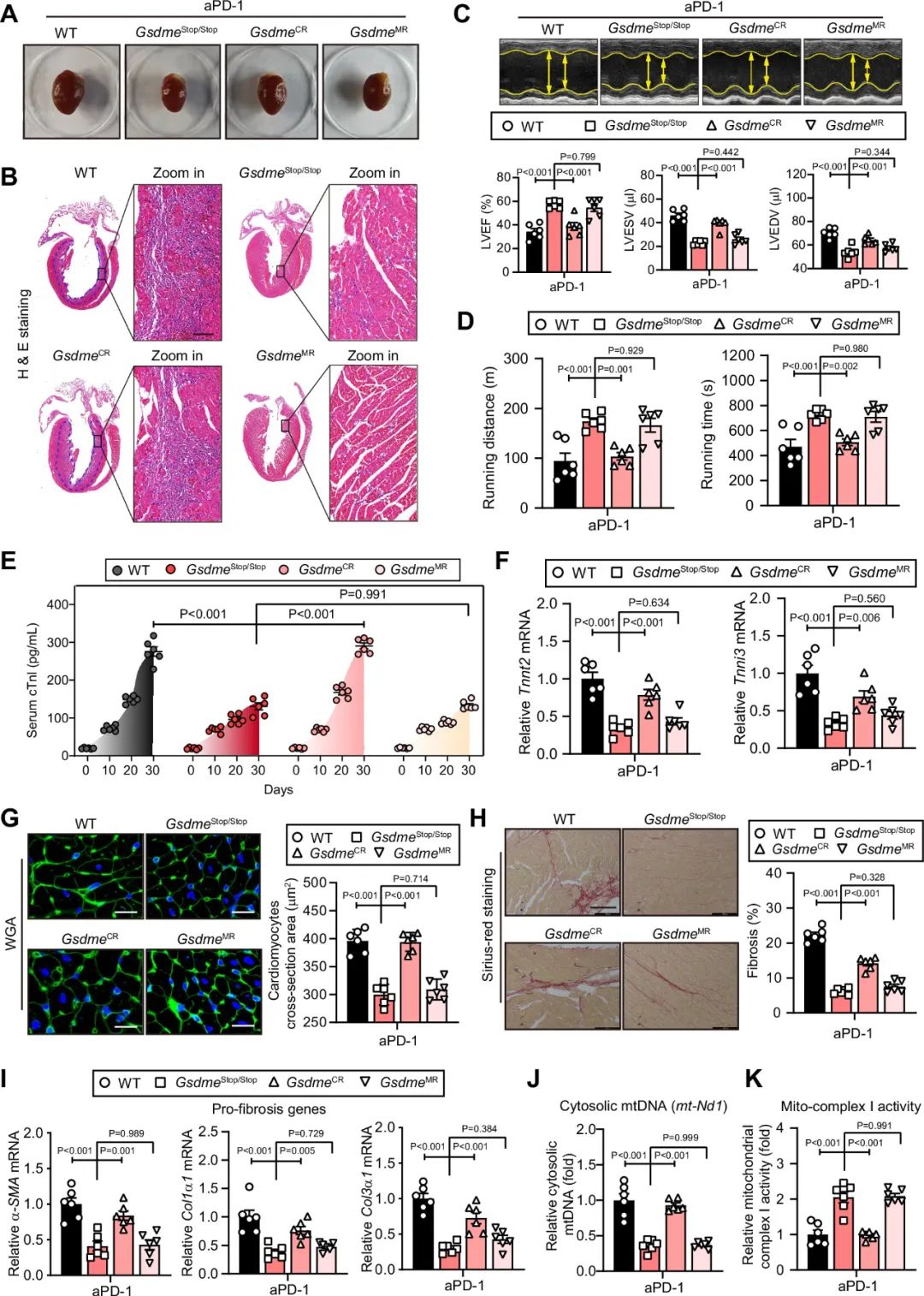
图7. 在GSDME转录终止小鼠(Gsdmestop/stop)的心肌而非髓系细胞中恢复GSDME的转录,可重现过量PD-1抗体治疗诱导的心功能障碍
研究者通过免疫荧光和流式进一步评估四种小鼠心脏内免疫细胞的浸润情况,发现在PD-1抗体治疗后,相较于WT小鼠,GsdmeStop/Stop小鼠心脏内浸润的CD4+ T细胞和CD8+ T细胞的量显著减少, GsdmeCR而非GsdmeMR重现了WT小鼠心脏中的CD4+ T细胞和CD8+ T细胞的浸润。GsdmeStop/Stop小鼠心脏内的促炎性Th1、Th17比例较WT减少,而抗炎性Th2细胞比例较WT增加,GsdmeCR而非GsdmeMR重现了WT小鼠心脏内的Th1、Th17和Th2的比例。相较于WT小鼠,GsdmeStop/Stop小鼠心脏内浸润的单核/巨噬细胞也有所减少。WT和GsdmeCR小鼠心脏内有类似比例的Ly6Chi、Ly6Clo单核细胞,CCR2-MHCIIlo、CCR2-MHCIIhi、CCR2+MHCIIhi巨噬细胞。GsdmeStop/Stop和GsdmeMR小鼠心脏内Ly6Chi单核细胞、CCR2-MHCIIhi和CCR2+MHCIIhi巨噬细胞减少了,但Ly6Clo单核细胞和CCR2-MHCIIlo巨噬细胞增加了。这些数据表明,心肌细胞中的GSDME而非髓系细胞中的GSDME对于PD-1抗体治疗诱导的心肌免疫/炎症激活具有决定性作用。
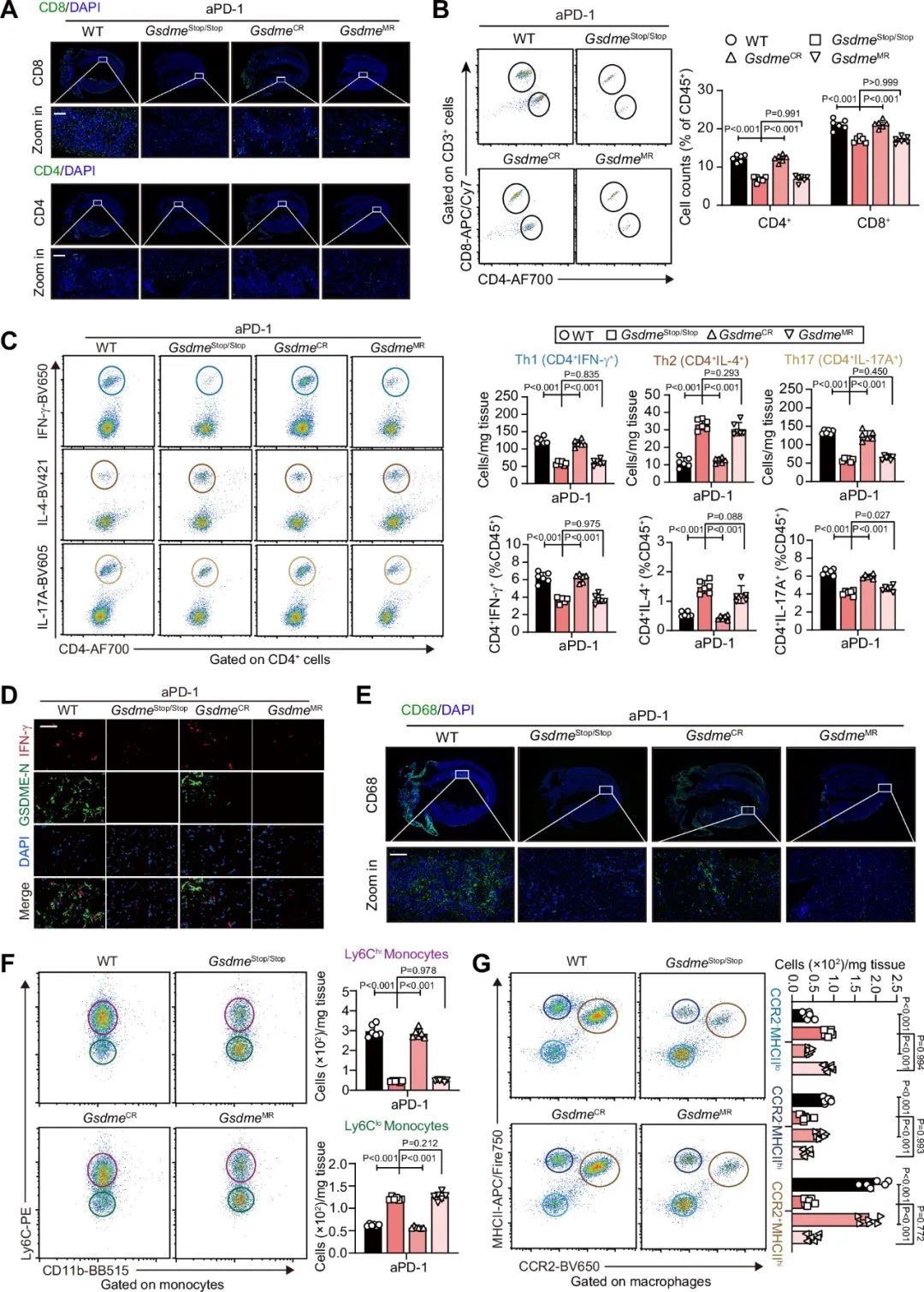
图8. 在心肌而非髓系细胞中恢复GSDME的表达重现PD-1抗体治疗诱导的心脏免疫细胞浸润和炎症
为了进一步了解PD-1抗体导致心肌焦亡的分子机制,研究者使用了蛋白质组学技术,发现GSDME的敲除影响了IFN信号通路和线粒体相关通路。基于cGAS-STING通路通过感知外源DNA将IFN信号与免疫连接起来,研究者提出假设:cGAS-STING通路可能涉及ICIs诱导的心肌细胞内GSDME介导的焦亡,并引入Stinggt/gt小鼠。研究者发现PD-1抗体导致的左室收缩功能下降、cTnT和cTnI的释放、GSDME的剪切、CD4+ T细胞和CD8+ T细胞的浸润,在Stinggt/gt小鼠中均有所改善。
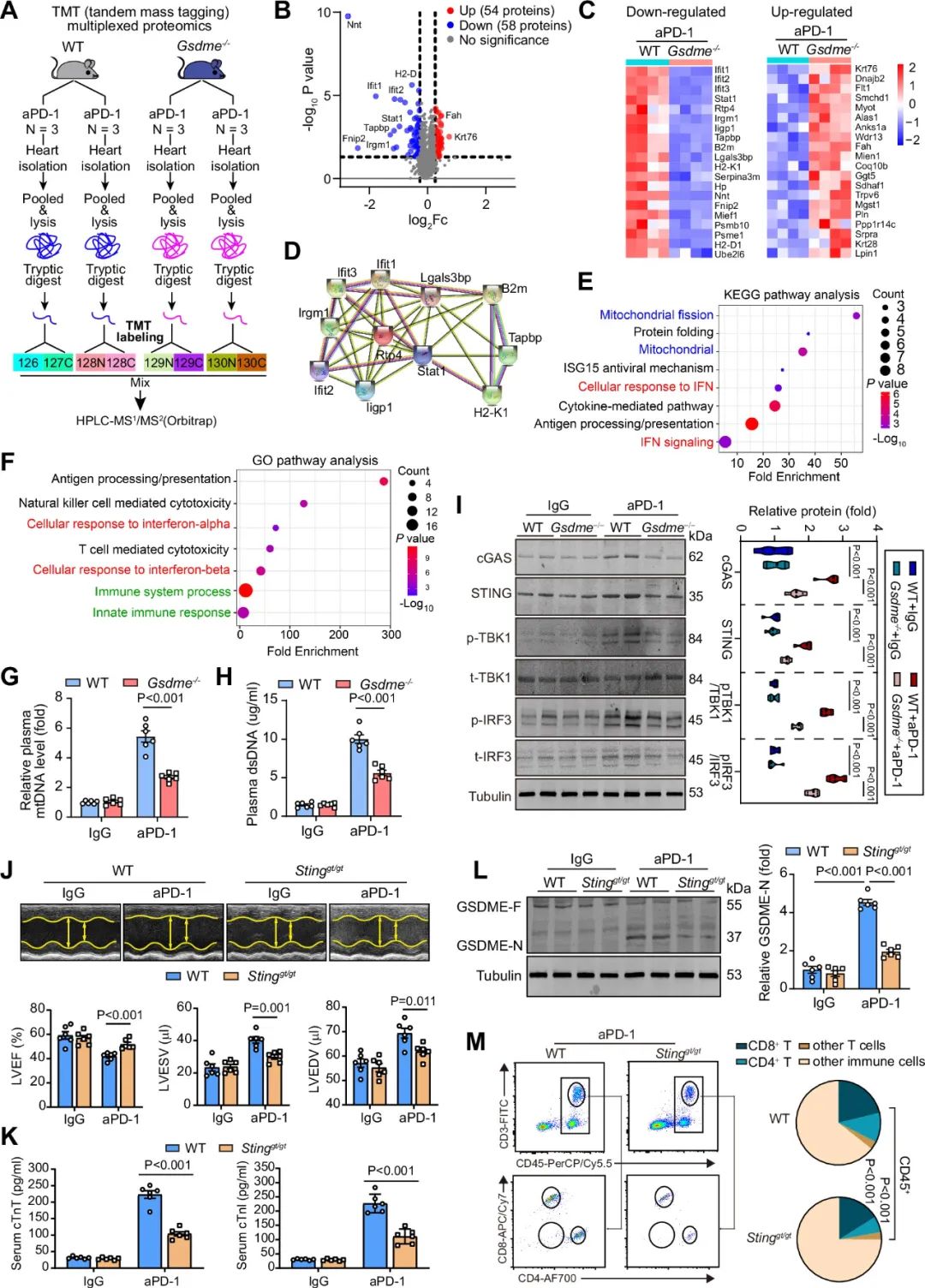
图9. cGAS-STING信号介导PD-1抗体治疗诱导的心肌炎
富马酸二甲酯(DMF)是GSDME的药理拮抗剂。研究者进一步探究使用DMF靶向 GSDME是否减轻ICIs相关性心肌炎,发现DMF阻断了小鼠心脏中GSDME的剪切,并减弱了PD-1抗体诱导的心脏肥大、左心室收缩功能不全、IFN-g和STINF的表达等。此外,研究者还观察到DMF可降低PD-1抗体导致的心肌炎引发的死亡率。这些结果表明,药理阻断GSDME可缓解PD-1抗体治疗相关的心肌炎。
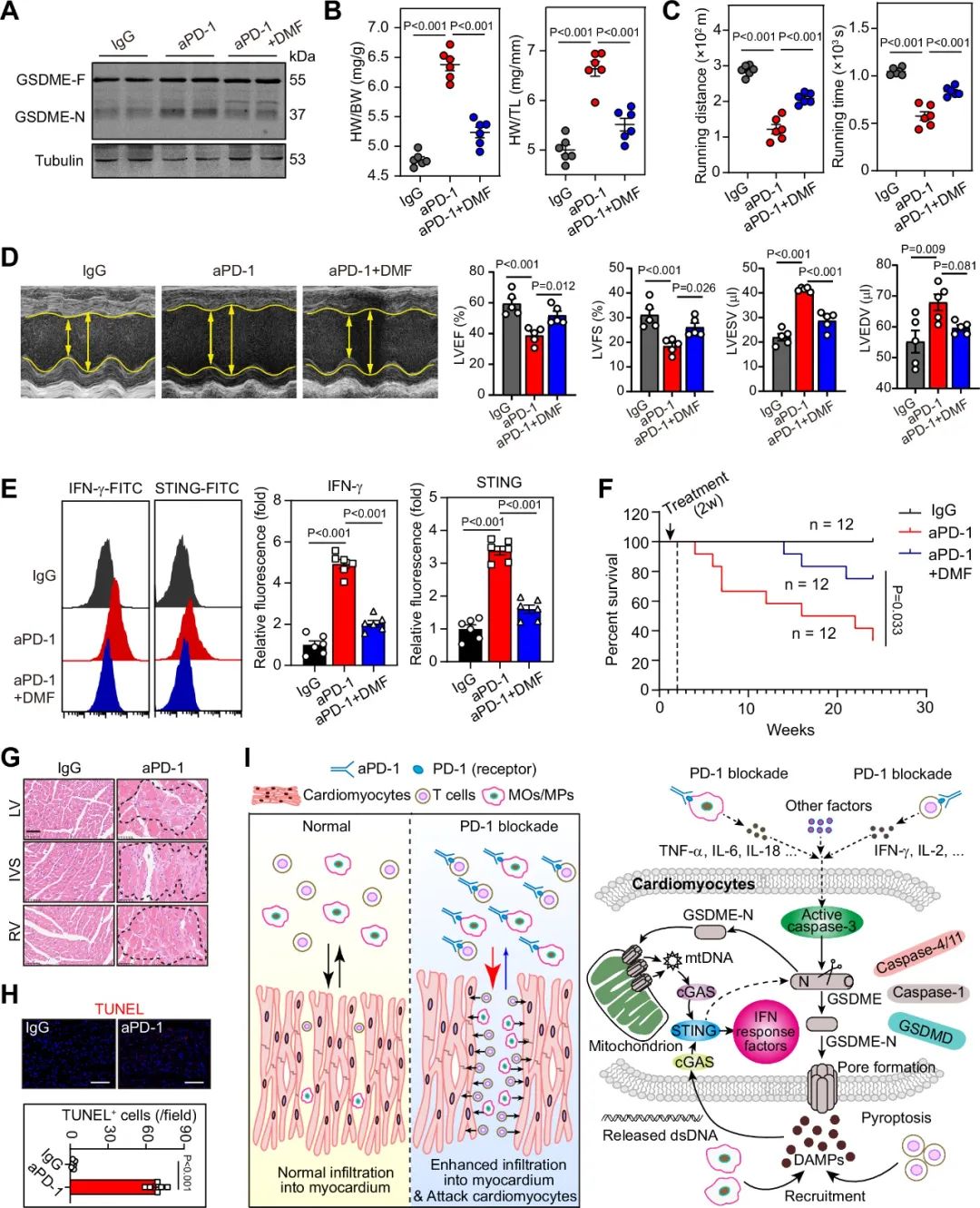
图10. 药物阻断GSDME可缓解PD-1抗体所致心肌炎并提高小鼠生存率
综上,该研究结果可能有助于促进对ICI相关心肌炎的理解,并表明靶向GSDME-cGAS-STING-IFN可能有助于预防和治疗ICI相关心肌炎。
海军军医大学药学院王培教授、同济大学附属第十人民医院药学部沈甫明/李冬洁教授为本文的共同通讯作者。
原文链接:
https://doi.org/10.1038/s41467-024-50996-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#心肌炎# #免疫检查点抑制剂#
54