脑组织铁沉积神经变性病(NBIA)|疑难探究
2024-10-24 神经科学论坛 神经科学论坛 发表于上海
本文介绍脑组织铁沉积神经变性病,包括定义、基因分类、临床症状、诊断及治疗,探讨铁超载与疾病关系,目前铁螯合剂有治疗潜力但仍需探索新疗法。
脑组织铁沉积神经变性病(neurodegenerationwith brain iron accumulation,NBIA)是一组由基因突变导致的以锥体外系症状为主,伴有其他复杂临床症状,在脑组织特定部位可见异常铁沉积的罕见的神经遗传变性疾病,发病率在(1~3)/1 000 000。尽管NBIA疾病谱系在临床上表现各一,但此类疾病在影像学尤其是磁共振(MRI)上因铁离子异常沉积而具有特征性的异常征象(常见铁沉积部位为苍白球、黑质、红核、丘脑等脑深部灰质核团)分子遗传学检测致病基因可以确诊。

1922年,在一小群患有逐步加重的构音障碍和痴呆的人中观察到基底神经节铁沉积,导致了一种新疾病的定义,最初被以首次描述它的临床医生的名字命名称为Hallervorden-Spatz综合征。如今,NBIA统称为以大脑铁内含物为特征的神经退行性疾病,主要发生在苍白球和黑质。
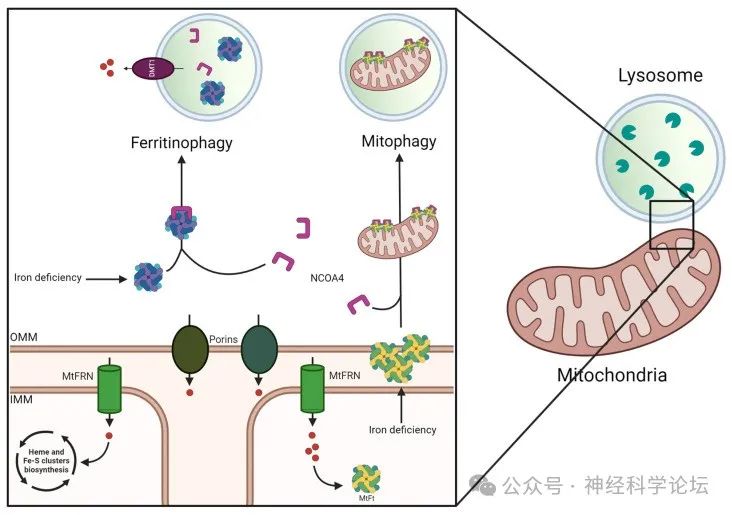
铁是一种必需的金属离子,参与多种细胞过程。然而,铁的反应性质使这种金属离子对细胞具有潜在的危险,需要严格控制其水平。细胞内铁浓度的变化与不同的神经病理学状况有关,包括伴有脑铁积聚的神经变性(NBIA)。顾名思义,NBIA包括一类罕见的、仍未得到充分研究的神经退行性疾病,其特征是大脑中铁的异常积累。NBIA通常伴有缓慢进行的锥体和锥体外系症状、轴突运动神经病、视神经萎缩、认知障碍和神经精神障碍。
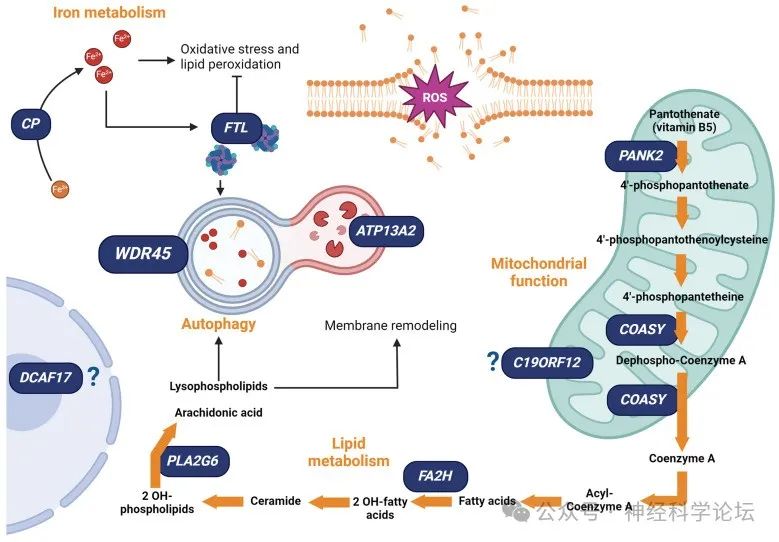
迄今为止,已有15种疾病被鉴定为NBIA亚型。他们目前的分类将特定的致病基因与不同的细胞途径联系起来:(1)辅酶A (CoA)生物合成(PANK2,COASY);(2)脂质代谢(PLA2G6,c19orf12,FA2H,SCP2,CRAT);(3)自噬(WDR45,ATP13A2,AP4M1,rep S1);(4)铁体内平衡(FTL,CP)和(5)其他未知的机制(GTPBP2,DCAF17)。除了两种疾病——由WDR45变异引起的X连锁螺旋桨相关神经变性(BPAN)和由铁蛋白轻链(FTL)基因突变引起的常染色体显性神经铁蛋白病——以外,其他疾病均以常染色体隐性方式遗传。
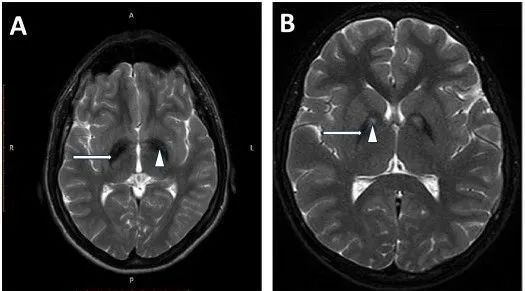
在影像学分类中,有几种类型的NBIA其临床表现属于遗传性帕金森病(FPD)的范畴,因此,其临床分类与FPD有重叠之处,如ATP13A2基因突变、PLA2G6基因突变均可导致FPD,因此,ATP13A2亦被称为PARK9,PLA2G6亦被称为PARK14。在导致NBIA的基因中,只有铜蓝蛋白基因和铁蛋白L链基因可直接导致铁离子代谢障碍,其余基因主要与脂肪代谢、溶酶体活性障碍等相关。
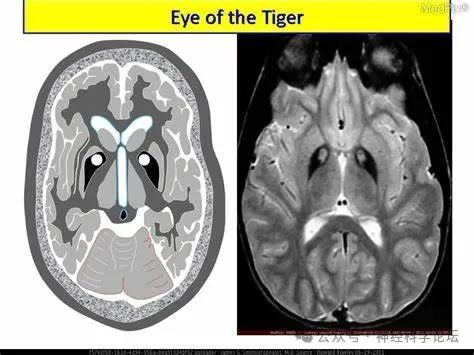
临床提示NBIA可能的病例,应该进行MRI检查。选择GRE、SWI等磁敏感序列或者高磁场MRI检查,有助于发现铁沉积。但随着年龄增长,正常老年脑或其他神经变性病,如多系统萎缩、阿尔茨海默病、帕金森病、进行性核上性麻痹等脑内也可以有铁沉积,需注意鉴别。特征性的影像学表现有助于诊断,如"虎眼征"高度提示PKAN;双侧黑质对称性T1高信号伴或不伴中间低信号提示BPAN;铁沉积部位继发囊性变提示NFT。
NBIA是一组由基因突变导致的以锥体外系症状为主,伴有不同程度的认知功能损害和精神症状,在苍白球、黑质、红核、丘脑等脑深部灰质核团可见异常铁沉积的罕见神经遗传变性疾病。NBIA具有高度临床和遗传异质性,其疾病谱系中10个亚型已经明确了致病基因。相对常见癫痫发作的NBIA亚型为:非钙依赖型磷脂酶A2相关性神经变性病(PLAN)、β螺旋蛋白相关性神经变性病(BPAN)、线粒体膜蛋白相关性神经变性病(MPAN)、脂肪酸羟化酶相关性神经变性病(FAHN)。罕见癫痫发作的NBIA亚型为:泛酸激酶相关性神经变性病(PKAN)和血浆铜蓝蛋白缺乏症(ACP)。
其中铁离子代谢障碍所致的NBIA主要包括血浆铜蓝蛋白缺乏症和神经铁蛋白病两种疾病。与铁离子代谢无关的NBIA包括7种,这些致病基因不参与铁离子代谢过程,脑内铁离子沉积及神经元死亡的原因尚不清楚,其治疗主要有脑深部电刺激(DBS)、巴氯芬、铁离子螯合剂等,但是治疗效果较差,研究较多的为泛酸激酶相关性神经退行性疾病(PKAN)。
铁超载和NBIA之间的相关性证实了维持正确的铁水平是细胞活力的关键,特别是在大脑中。令人惊讶的是,只有两个NBIA相关基因有助于维持铁稳态,并且它们与以最广泛的铁沉积为特征的两种NBIA形式相关。因此,尽管铁积累是NBIA诊断的金标准,但仍不清楚它是导致神经变性的其他细胞损伤的主要原因还是结果。
脑铁积累可以通过MRI成像来诊断,并被假设为氧化应激的原因,导致脑组织的退化。在确定了最常见的NBIA类型和这些特定疾病背后的机制后,现在可以探索可能的治疗途径。有四种主要类型的NBIA:泛酸激酶相关的神经变性(PKAN)、PLA2G6相关的神经变性(PLAN)、线粒体膜蛋白相关的神经变性(MKAN)和β-推进器蛋白相关的神经变性(BPAN)。这些疾病还没有针对病因的疗法,但铁螯合剂已被证明具有治疗NBIA的潜力。
螯合剂是能与金属离子形成复合物的物质。铁螯合疗法是一种很有前途的疾病治疗方法,但它仍然是治标不治本,或解决疾病的根源。铁螯合剂具有与铁结合的高亲和力,但也必须能够穿过或绕过血脑屏障以接近过量的铁,而不引起明显的铁耗竭。目前临床使用的三种铁螯合剂是去铁胺(DFO)、去铁西络(DFS)和去铁酮(DFP)。
总之,尽管对NBIA的研究仍在继续,但在过去几年中,对病理的遗传形式的新模型的开发已经给了我们增加对这种形式的神经变性的知识的巨大机会。沿着这条道路,科学研究可能会发现这种仍然无法治愈的疾病的新治疗方法,并给许多患有这种类型神经变性的人带来希望。
参考文献
Wydrych A, et al. Metabolic impairments in neurodegeneration with brain iron accumulation. Biochim Biophys Acta Bioenerg. 2024 Oct 2;1866(1):149517. doi: 10.1016/j.bbabio.2024.149517.
Agostini F, et al. Iron Dyshomeostasis in Neurodegeneration with Brain Iron Accumulation (NBIA): Is It the Cause or the Effect? Cells. 2024 Aug 19;13(16):1376. doi: 10.3390/cells13161376.
Kolarova H, et al. Lifetime risk of autosomal recessive neurodegeneration with brain iron accumulation (NBIA) disorders calculated from genetic databases. EBioMedicine. 2022 Mar;77:103869. doi: 10.1016/j.ebiom.2022.103869.
Marupudi N, Xiong MP. Genetic Targets and Applications of Iron Chelators for Neurodegeneration with Brain Iron Accumulation. ACS Bio Med Chem Au. 2024 Mar 11;4(3):119-130. doi: 10.1021/acsbiomedchemau.3c00066.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#神经变性病# #脑组织铁沉积#
23