蹇锡高院士团队AFM:纳米矿物在骨质疏松症治疗中的应用
2024-09-11 BioMed科技 BioMed科技 发表于上海
大连理工大学蹇锡高/王锦艳/柳承德&大连大学张学梅开发了一种以多聚磷酸盐为能源的活性钙磷酸纳米矿物(ECPN),用于骨质疏松症治疗。
能量代谢紊乱导致组织破坏是骨质疏松症的主要原因。虽然有效,但调节能量代谢的骨骼修复策略面临着相当大的挑战。在这里,大连理工大学蹇锡高/王锦艳/柳承德&大连大学张学梅开发了一种以多聚磷酸盐为能源的活性钙磷酸纳米矿物(ECPN),用于骨质疏松症治疗。ECPN在生理环境中促进三磷酸腺苷(ATP)的产生,提供能量以实现代谢稳态。它通过激活与AMPK相关的途径显著增强rBMSCs的自噬能力,促进成骨分化,并重建骨再生微环境。ECPN独特的纳米结构可以完全矿化胶原纤维,增强骨基质的机械性能。在体内,ECPN迅速渗透到骨质疏松的骨骼中,填补缺陷,矿化基质,并促进新骨形成。修复后的骨骼展现出与正常骨骼相当的机械性能。ECPN平衡了骨质疏松症治疗中对骨基质矿化立即需求和长期构建成骨微环境的时间敏感性。过去,这种代谢燃料用于生成组织工程功能性纳米材料的潜力被低估了。活性纳米矿物用于组织再生的概念可能会引领组织工程的新趋势。该研究以题为“Energetic Calcium Phosphate Nanominerals for Osteoporosis Treatment”的论文发表在《Advanced Functional Materials》上。

图1展示了能量纳米矿物促进骨质疏松症(OBs)修复的机制。在传统治疗方法中,由于缺乏对骨基质矿物质补充和生理环境重建与平衡的考虑,治疗过程往往耗时且效果有限。相比之下,ECPN作为一种高能矿物质载体,不仅促进了骨基质矿物质的形成,还通过提供能量来增强成骨细胞系列的活动,从而重建和平衡成骨环境。这种以ECPN为基础的治疗方法代表了一种新的骨质疏松症修复模式,它通过同时满足骨基质矿化和成骨微环境长期建设的时效性需求,为骨质疏松症治疗提供了一种有效的策略。
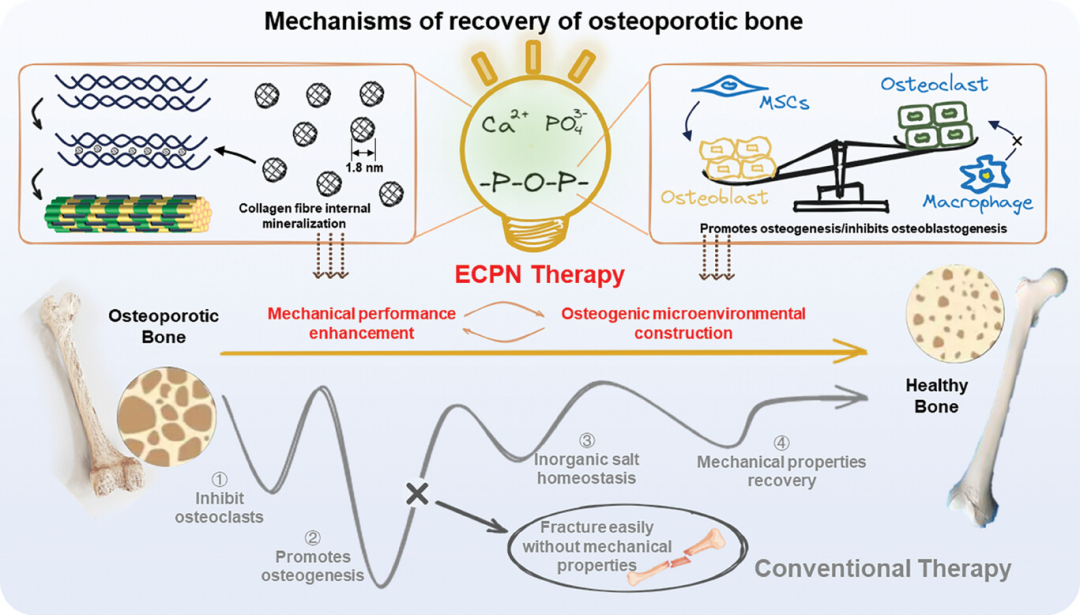
图1. 能量纳米矿物促进成骨细胞恢复的机制
【ECPN的合成和表征】
图2展示了ECPN的合成和表征过程。通过使用不同分子量的聚磷酸盐(polyPx)与钙离子和磷酸根反应,形成了稳定的ECPN,用于胶原基质的矿化补充和骨质疏松骨的修复。研究发现,较高分子量的polyPx能够形成更小尺寸的ECPN颗粒,这些颗粒具有更好的稳定性和渗透性,能够有效地穿透并矿化胶原纤维。通过透射电子显微镜(TEM)、动态光散射、冷冻透射电子显微镜(cryo-TEM)和X射线衍射(XRD)等技术对ECPN的形态和结构进行了详细分析,确认了其非晶态钙磷酸盐(ACP)的特性。此外,通过红外光谱(IR)分析进一步验证了ECPN中高能磷酸键的存在。这些结果表明,ECPN的合成过程简单,成本低廉,且所制备的ECPN具有良好的稳定性和生物相容性,为骨质疏松症的治疗提供了一种有前景的纳米材料。
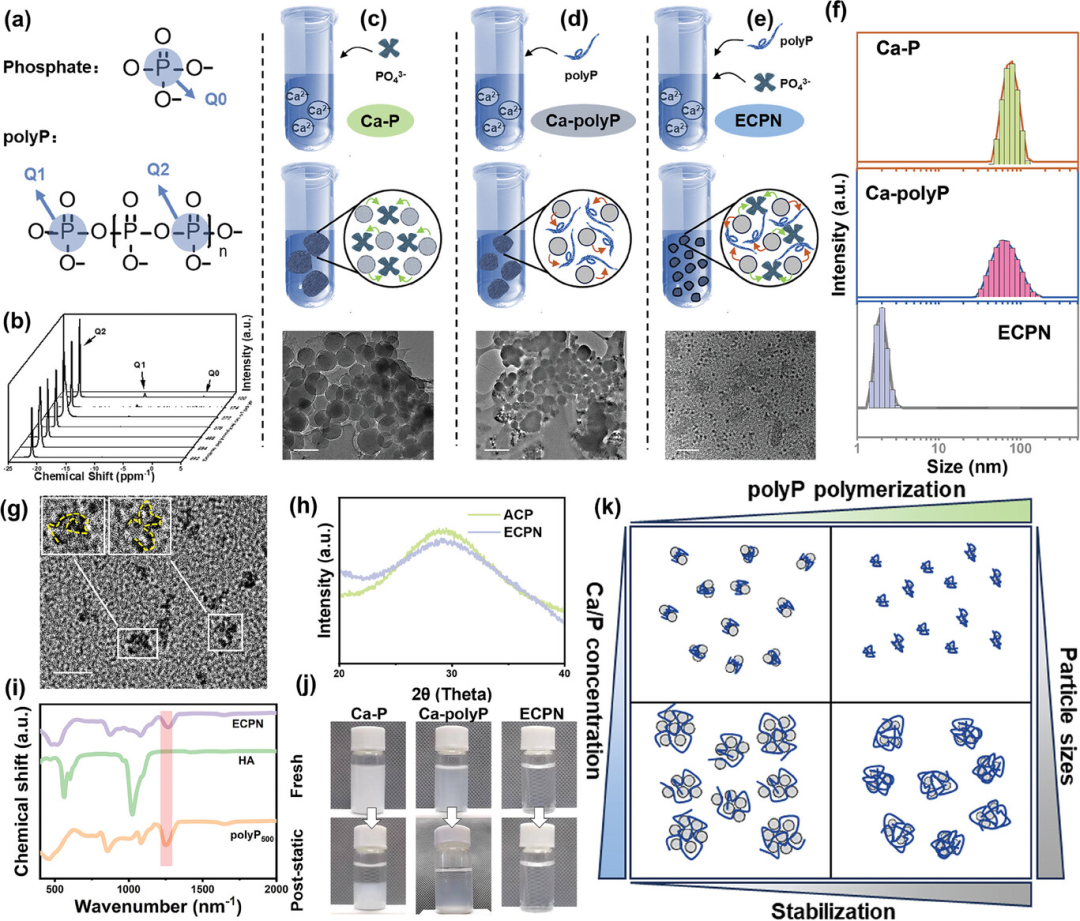
图2. ECPN的合成和表征
【使用ECPN矿化的胶原纤维和骨基质的表征】
图3详细描述了ECPN在矿化胶原纤维和骨基质方面的应用和效果。通过在不同三维胶原基质中进行矿化实验,观察到ECPN能够有效地渗透并矿化胶原纤维,形成高对比度的矿化区域,而对照组则显示出矿化不完全的现象。此外,通过高角环形暗场扫描透射电子显微镜(HAADF-STEM)和冷冻透射电子显微镜(cryo-TEM)图像,进一步证实了ECPN在胶原纤维中的定向矿化和微晶体的周期性沉积。在体外实验中,将骨质疏松骨(OBs)浸入ECPN溶液后,通过微型计算机断层扫描(micro-CT)和纳米压痕测试,发现ECPN处理的OBs在矿化密度、骨体积分数(BV/TV)以及杨氏模量和骨硬度方面均有显著改善,接近健康骨骼的水平。这些结果表明,ECPN不仅能够促进胶原纤维的矿化,还能够显著提高骨质疏松骨的机械性能。
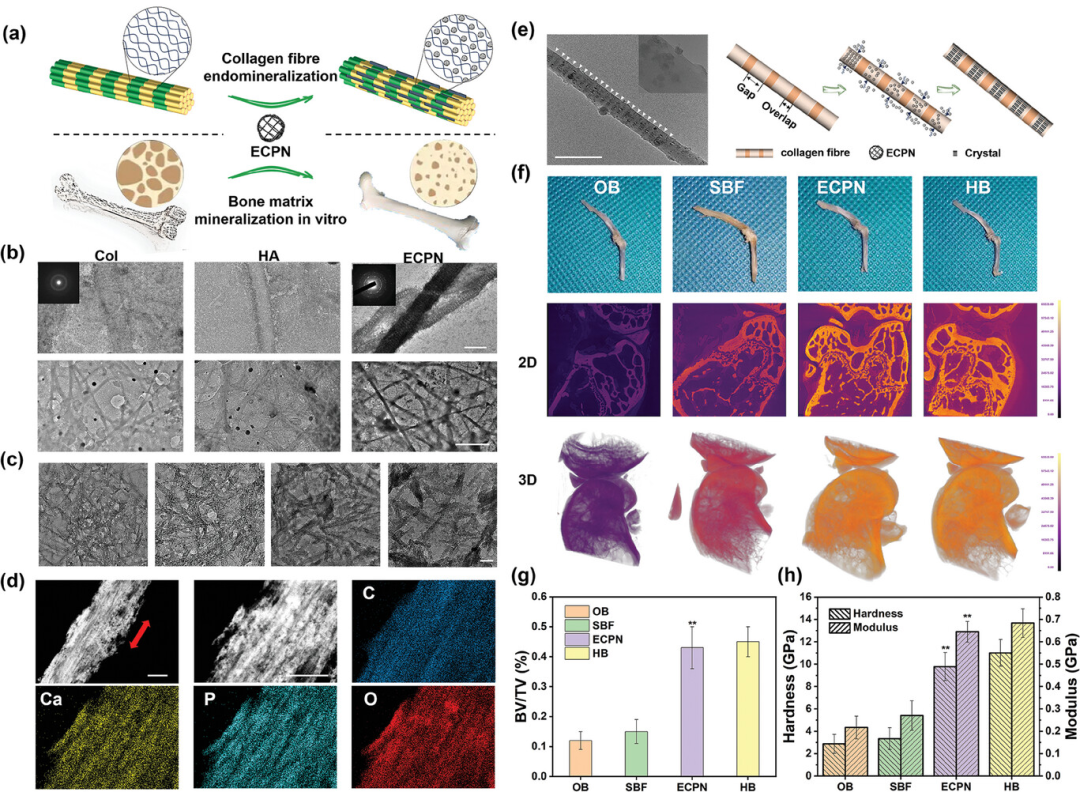
图3. 使用ECPN矿化的胶原纤维和骨基质的表征
【ECPN通过rBMSCs利用的潜在途径】
图4探讨了ECPN对骨髓间充质干细胞(rBMSCs)能量产生和自噬作用的影响。研究发现,ECPN能够显著增加线粒体数量并促进三磷酸腺苷(ATP)的生成,从而增强细胞的能量代谢。此外,ECPN通过激活与AMPK相关的信号通路,显著提高了rBMSCs的自噬能力,这通过自噬相关基因和蛋白(如LC3B和p62)的表达变化得到证实。自噬的增强进一步促进了成骨分化,为构建成骨微环境提供了支持。此外,ECPN的内化激活了rBMSCs中溶酶体的产生,这通过溶酶体相关膜蛋白-1(LAMP-1)的荧光染色得到证实。这些结果表明,ECPN通过调节能量代谢和自噬过程,有效促进了rBMSCs的成骨分化,为骨质疏松症治疗提供了新的策略。
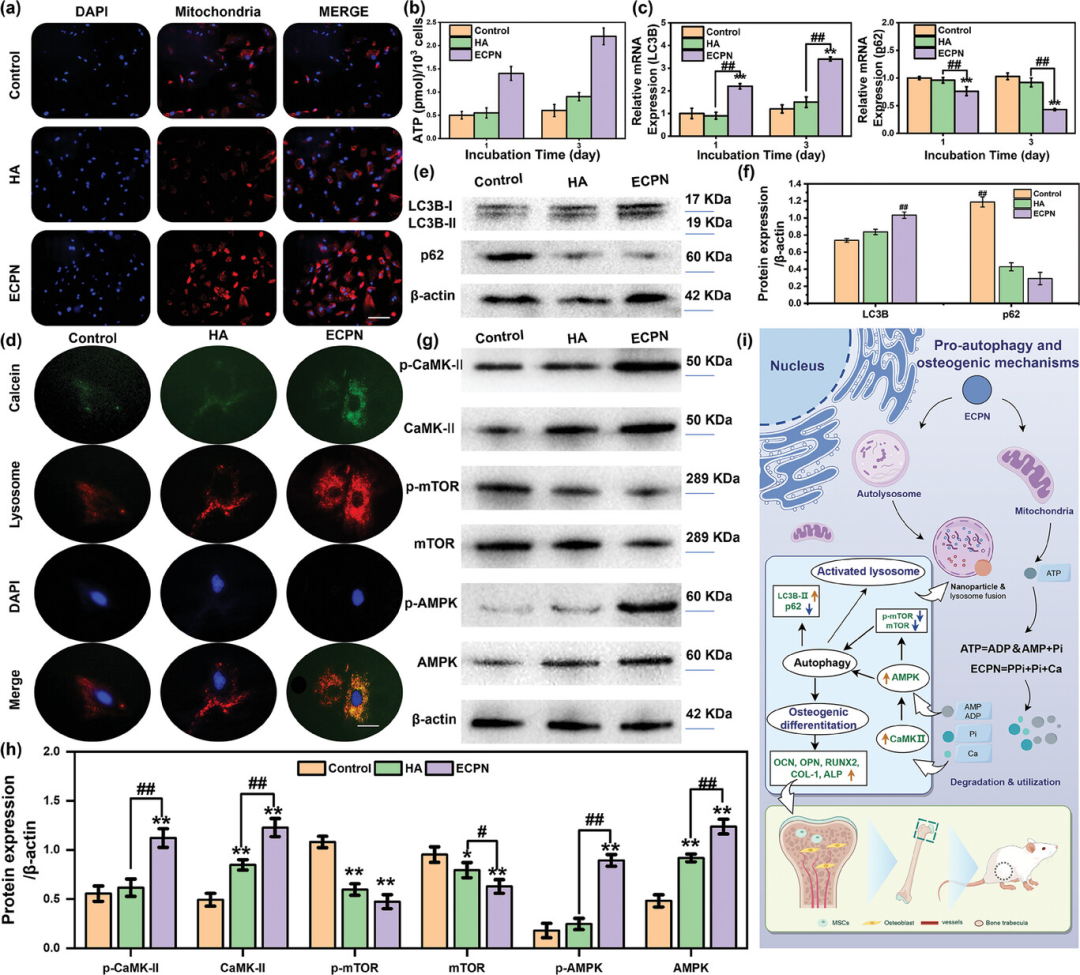
图4. ECPN通过rBMSCs利用的潜在途径
【ECPN的体外生物相容性和成骨微环境的建立】
图5展示了ECPN在体外培养中对骨髓间充质干细胞(rBMSCs)的生物相容性及其在建立成骨微环境中的作用。实验结果表明,ECPN对rBMSCs没有明显的细胞毒性,并能够促进细胞增殖。通过qPCR和西方印迹分析,发现ECPN能够上调与成骨相关的基因和蛋白的表达,如碱性磷酸酶(ALP)、Runx2、胶原蛋白I型(COL-1)、骨桥蛋白(BSP)和骨钙素(OCN),并且这种上调效果比传统的羟基磷灰石(HA)更为显著。此外,ECPN处理的rBMSCs在ALP活性和钙结节形成方面也表现出更高的水平。同时,ECPN还显示出抑制RAW264.7巨噬细胞向成骨细胞分化的能力。这些发现证实了ECPN在促进成骨分化、抑制成骨细胞形成以及构建有利于骨组织修复的微环境中的有效性,表明ECPN是一种具有良好生物相容性和成骨诱导性的材料。
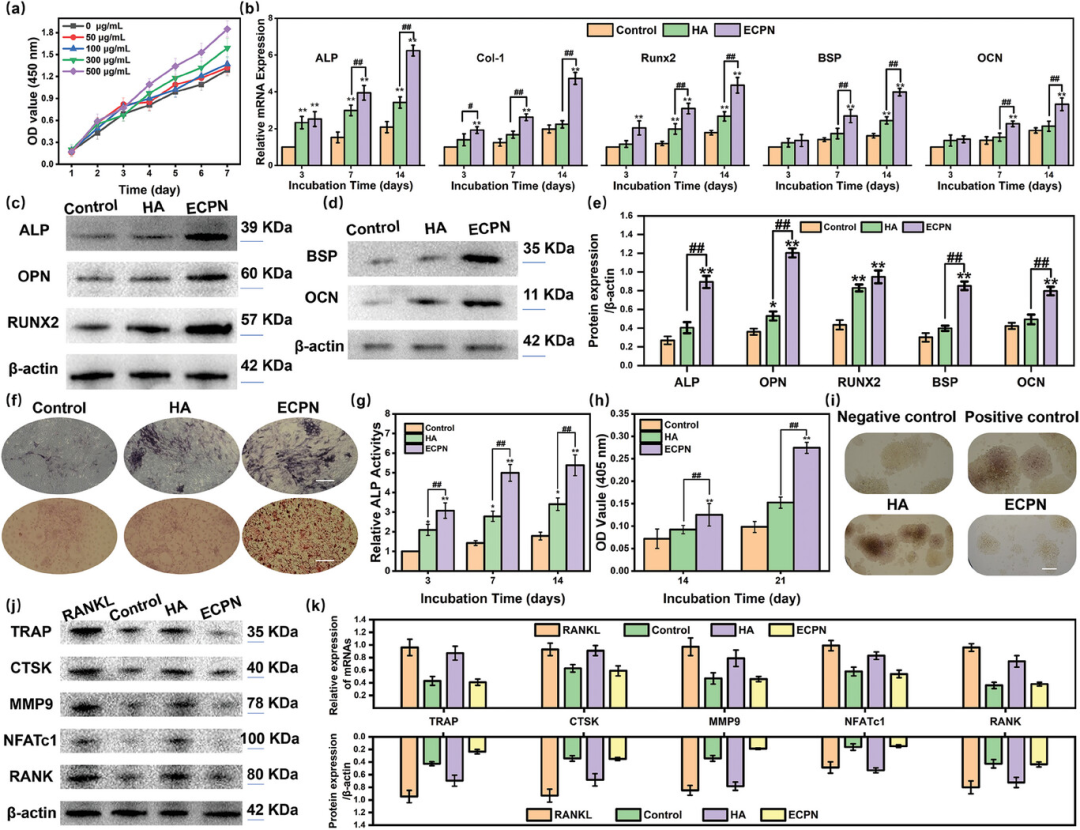
图5. ECPN的体外生物相容性和成骨微环境的建立
【ECPN对小鼠股骨骨质疏松症治疗的微创注射和ECPN处理骨骼修复后的体内结果】
图6展示了ECPN通过微创注射方式在体内对骨质疏松小鼠模型的股骨进行修复的过程和效果。通过在小鼠股骨中注射ECPN,研究发现ECPN能够迅速渗透到骨质疏松的骨骼中,填补骨缺损,矿化骨基质,并促进新骨的形成。随着时间的推移,ECPN处理的骨骼在微型计算机断层扫描(micro-CT)图像中显示出新骨形成量的逐渐增加,并且在12周后达到了与健康骨骼相似的水平。此外,通过组织学染色和免疫组化染色进一步证实了新骨组织的形成。在机械性能测试中,ECPN处理的骨骼展现出与健康骨骼相当的硬度和杨氏模量,表明其能够有效恢复骨质疏松骨骼的机械强度。这些结果表明,ECPN不仅能够促进骨质疏松骨骼的快速修复,还能够显著提高修复后骨骼的机械性能。
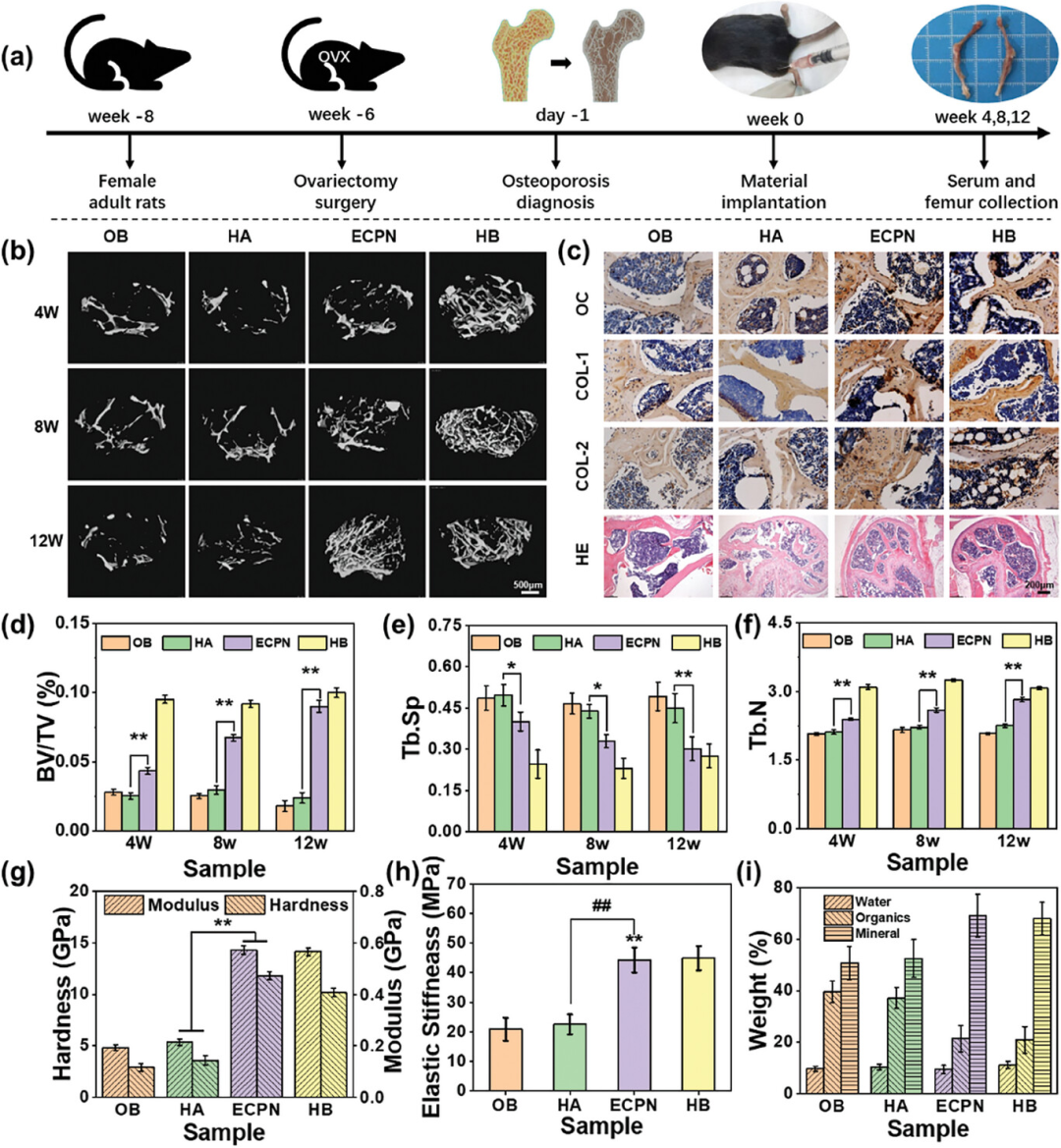
图6. 通过ECPN对小鼠股骨骨质疏松症治疗的微创注射和ECPN处理骨骼修复后4、8、12周的体内结果
【与健康骨骼和HA处理的OB相比,ECPN修复大鼠OB缺陷的体内结果】
图7探讨了ECPN在体内对骨质疏松大鼠模型的股骨缺损进行修复的能力。研究发现,通过将ECPN作为填充材料植入骨质疏松大鼠的股骨缺损区域,ECPN能够有效地促进新骨的形成,并在12周后实现了缺损的完全修复,其效果优于未经处理的骨质疏松骨(OB)和羟基磷灰石(HA)处理组。微型计算机断层扫描(micro-CT)分析显示,ECPN处理组的新骨体积、骨密度、骨小梁数量和骨小梁间距等指标均有显著改善,接近健康骨的水平。此外,免疫组化染色结果表明,ECPN处理区域的成骨相关蛋白表达水平较高,显示出更好的矿化和成骨活性。
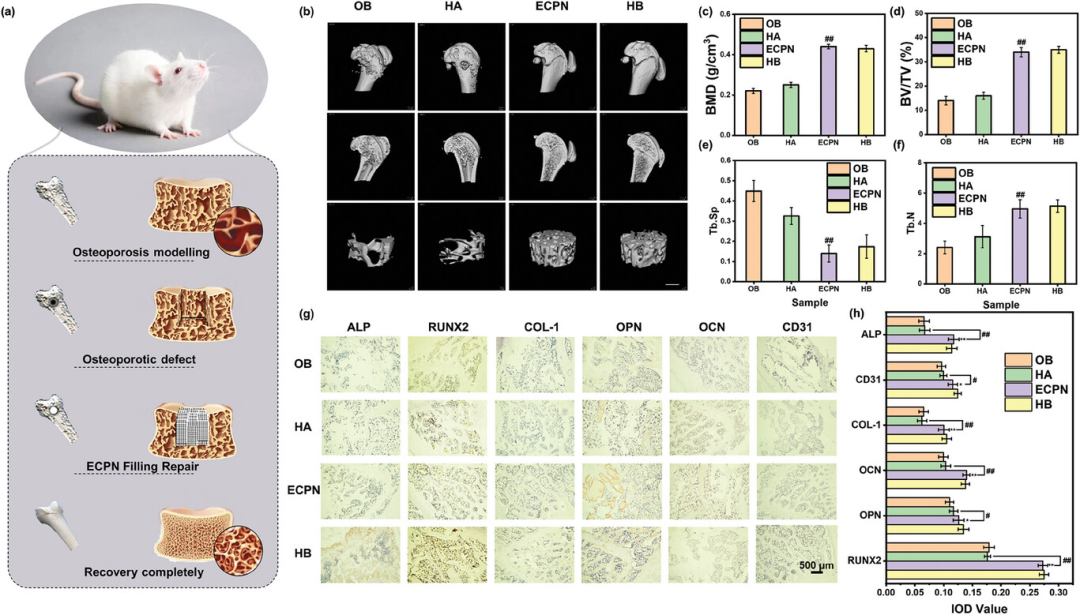
图7. 与健康骨骼和HA处理的OB相比,ECPN修复大鼠OB缺陷的体内结果
【小结】
该研究设计并合成了一种以多聚磷酸盐为稳定的活性钙磷酸纳米矿物(ECPN),它能够在生理环境中穿透骨基质,矿化胶原纤维的内部,并恢复骨质疏松骨(OBs)的机械性能。同时,ECPN通过调节能量代谢、增加线粒体数量和促进ATP产生,增强成骨分化并重建成骨微环境,有效结合了能量调节和骨基质矿化,满足了骨质疏松症治疗中骨矿物质补充和成骨环境建立的需求,为骨质疏松症的治疗提供了新的思路,并且扩展了生物模拟纳米矿物在组织工程中的制备和应用领域。
原文链接:
https://doi.org/10.1002/adfm.202415906
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















学习!前沿知识,学习通用
45
#骨质疏松症# #纳米矿物#
58