JAMA子刊:胚系基因检测协助预测横纹肌肉瘤患儿生存预后
2024-10-18 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
该研究揭示了携带RMS相关基因CPV与生存率预后、两种RMS形态(融合阴阳性)之间的关系,并建议将CPV列为RMS风险分层中的参考指标之一。
横纹肌肉瘤(RMS)是儿童软组织肉瘤中最常见的肿瘤,其通常有两种基本形态:胚胎型与腺泡型,且五年总生存率(OS)为65% - 70%。腺泡型RMS通常由PAX3或PAX7基因与FOXO1基因的融合所导致,所以被称为融合阳性。此种RMS类型也更为凶险。对比之下,胚胎性RMS缺乏典型的PAX3/7与FOXO1的基因融合,而是通常由于RAS信号通路中的体细胞突变,11号染色体15.5号位置的杂合性丧失,和整个染色体的改变所致,所以也被称为融合阴性。融合阴阳性便是目前用于RMS风险分层的方案。至今为止,对于提升RMS中高风险组生存率的尝试还未成功。
然而,尽管生殖系易感突变的存在已经在其他儿童癌症中帮助指导了风险分层,生殖系标记尚未用于RMS风险分层中。研究发现,7%的RMS患者体内有生殖系癌症易感突变(缩写CPV),并且胚胎型体内出现CPV的概率又高于腺泡型(前者为10%,后者3%)。由于RMS的风险分层尚不精准,所以确定CPV是否与儿童RMS患者的生存预后有关,以及其是否可以为治疗方案提供有效信息便显得尤为重要。
近日,由 Philip J. Lupo 和 Martin-Giacalone 团队发表于 JAMA Network Open的题为 Germline Genetic Testing and Survival Outcomes Among Children With Rhabdomyosarcoma — A Report From the Children’s Oncology Group的文章,揭示了携带RMS相关基因CPV与生存率预后、两种RMS形态(融合阴阳性)之间的关系,并建议将CPV列为RMS风险分层中的参考指标之一。

此项研究有580名中位数年龄为5.9岁的RMS患者参与,其中229为男性,351名为女性,82.5%的患者为融合阳性。他们均经过组织学确认(即确认为融合阳性或阴性)的RMS诊断,并且在美国贝勒医学院o人类基因组测序中心进行了生殖系外显子组测序以知晓其是否携带CPV。此外,由于种族也可能会导致预后结果的不同,故种族也是此研究的参数之一。根据参与者自愿公开的数据显示,参与者种族和族裔包含了西班牙裔、非西班牙裔的黑人或非裔美国人、非西班牙裔的白人,或其他非西班牙裔的种族群体(包括阿拉斯加原住民、亚裔或夏威夷原住民和太平洋岛民)。此项研究的结果衡量标准参数为总生存率(OS)和无事件生存率(ESF)。ESF定义为从研究注册日期起到肿瘤复发或进展、二次恶性肿瘤或任何原因导致的死亡的时间;OS定义为从研究注册日期起到任何原因导致的死亡的时间。研究队列的中位随访生存时间为4.75年。
研究结果显示,在所有样本中,携带24种RMS相关基因中1种的CPV的患者OS低于不携带CPV患者10个百分点左右,而EFS则并无较大差别。若扩大分析对象群体,将携带63种癌症相关基因中1种的CPV患者与无CPV患者对比,则二者在OS与EFS并无差别。
若仅聚焦于融合阳性的患者,区别于以上结论,携带24种RMS相关基因中1种的CPV的患者OS和EFS均低于不携带CPV患者。若扩大分析对象群体,将携带63种癌症相关基因中1种的CPV患者与无CPV患者对比,则结论同上。
在融合阴性患者中,携带CPV的患者OS与EFS都低于不携带CPV的患者,但却与融合阳性且不携带CPV的患者类似。
此外,此项研究还分析了4个常见具体基因变异状态下与CPV和RMS预后的联系—分别为:TP53, NF1, HRAS, 和BRCA2—并发现TP53和NF1受CPV影响较大,特别是在融合阳性患者中,OS和EFS显著降低。对于HRAS和BRCA2,CPV的出现则并为造成任何不同。
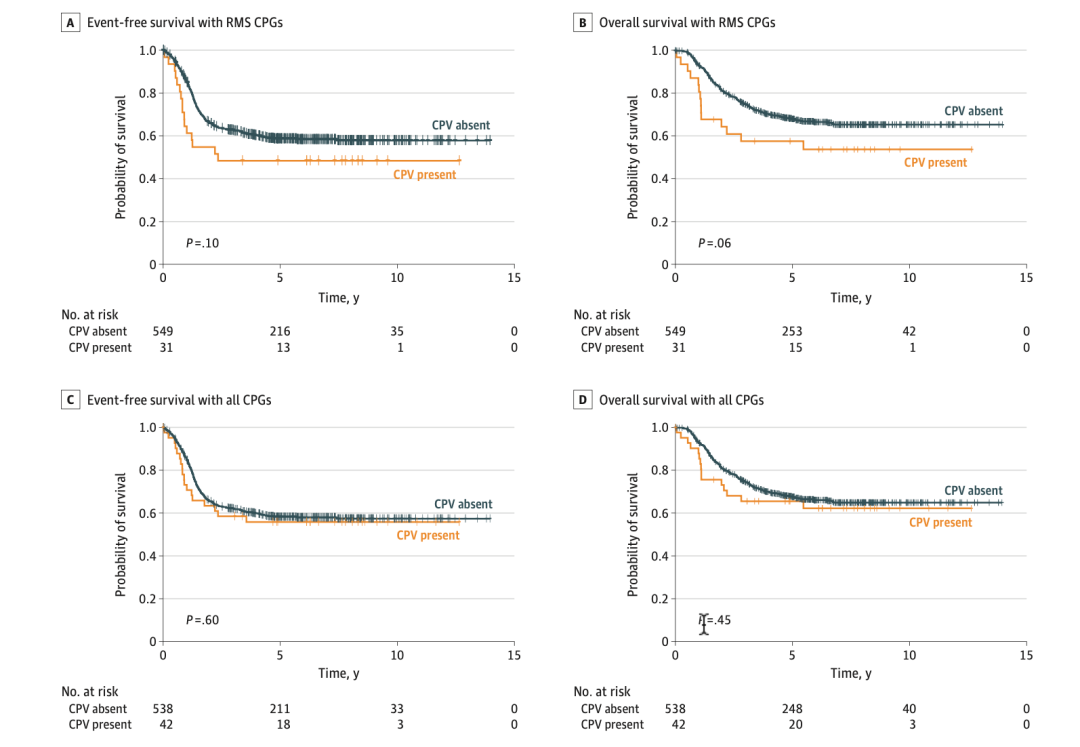
图:A)携带24种RMS相关基因中一种的CPV的患者的与不携带CPV患者的ESF对比。B) 携带24种RMS相关基因中一种的CPV的患者的与不携带CPV患者的OS对比。C)携带63种癌症相关基因中一种的CPV的患者的与不携带CPV患者的ESF对比。D)携带3种癌症相关基因中一种的CPV的患者的与不携带CPV患者的OS对比。
总之,该研究为儿童RMS风险分层,治疗方案个性化,以及预后提供了重要的新思路。目前,RMS的风险分层还仅限于组织学,即将RMS归为融合阳性或阴性,此手段不足以准确预测疾病风险。
文章中指出CPV与患有RMS的儿童的EFS和OS有显著且具体的关联。尤其是在融合阳性的患者中,这种关联最为明显。此外,携带CPV的融合阴性RMS患者的生存率与融合阳性RMS患者相似,而后者通常与更具侵略性的肿瘤相关。尽管TP53基因的变异通常与二次恶性肿瘤同时出现,但是TP53的变异与RMS预后的联系不受到二次恶性肿瘤的影响。研究还表明,携带HRAS突变的RMS患者的生存率较低,这提示针对RAS通路的靶向治疗可能对这类患者有益。
总结而言,这项研究表明CPV在RMS患者的预后中可能具有重要作用,尤其是在融合阴性RMS患者中,CPV状态可能是一个重要的预后因素。将CPV列为儿童RMS风险分层的指标之中可能会帮助更多患者与医疗人员预测疾病的发展及预后。未来的研究应结合生殖系和体细胞数据,以进一步揭示CPV如何影响RMS的发生和治疗结果。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#风险分层# #横纹肌肉瘤# #生殖系癌症易感突变#
36