Sci China Life Sci 西苑医院刘玥主任医师团队首次基于时空转录组学揭示Gelsolin促进心梗后心室重构的新机制
2024-12-31 论道心血管 论道心血管 发表于陕西省
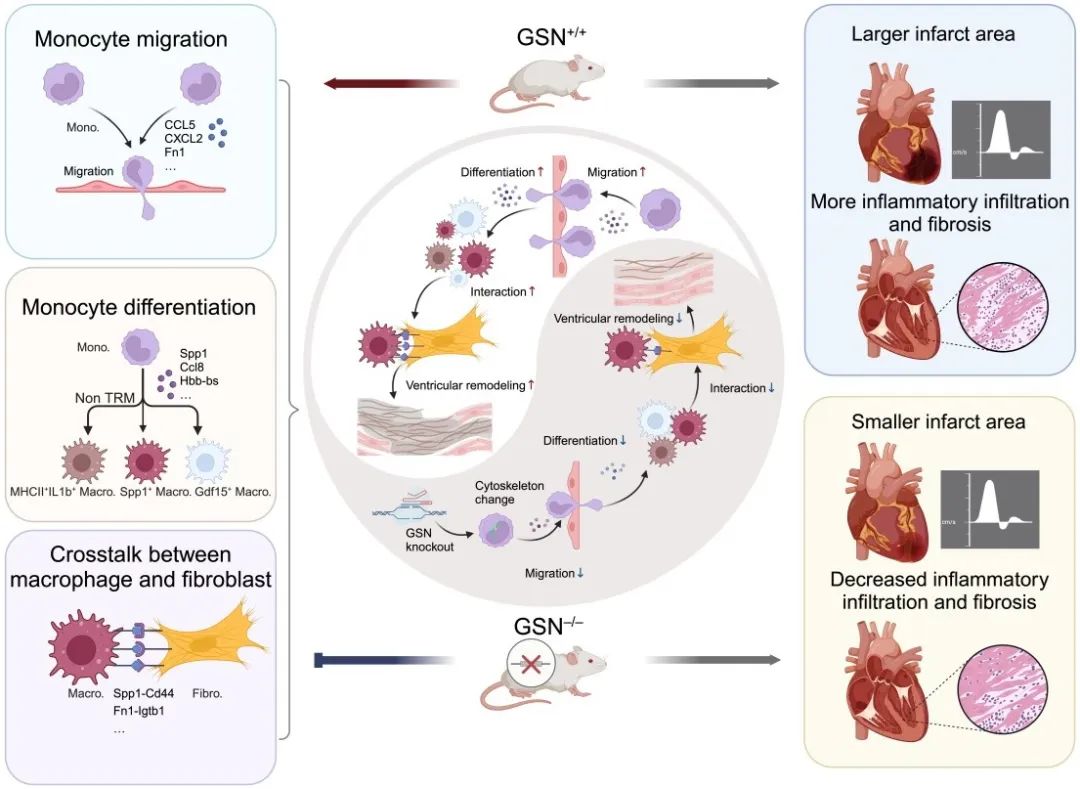
该研究全面描绘了Gelsolin对心肌梗死后早期和晚期心脏空间分子特征的影响,Gelsolin通过调控Fn1促进单核细胞骨架重塑和伪足生成,加速其向梗死区募集和向巨噬细胞趋化。
心肌梗死是一种常见的缺血性心脏病,严重威胁人类健康。近几十年血运重建等早期再灌注疗法不断发展,心肌梗死患者急性期生存率明显提高,但随着幸存者人数的增加,心肌梗死后心力衰竭的患病率也随之升高,导致心血管相关死亡率不断攀升。心肌梗死后的心室重构被认为是心力衰竭的关键病理特征,细胞骨架作为心脏结构支撑的基础框架,在心室重构修复中具有重要作用。靶向细胞骨架逆转心室重构成为改善心梗后心衰的重要治疗策略。
凝溶胶蛋白(Gelsolin)是一种调控肌动蛋白细胞骨架的关键介质,与心室重构、心脏肥大等病理过程等密切相关。前期我们首次提出并验证了骨架蛋白Gelsolin变形能力增强促进了冠心病血瘀证的形成,为理解病证结合血瘀证的生物学实质提供了科学证据,而敲除Gelsolin可通过抑制心肌细胞凋亡和不利细胞骨架重塑预防心力衰竭的发生发展。然而,现有研究对其作用机制尚未有深入探索,Gelsolin在心肌梗死后心室重构中如何调控细胞骨架变化、影响细胞间相互作用及驱动心肌纤维化等过程仍有待深入研究。
2024年12月24日,中国中医科学院西苑医院刘玥主任医师团队在SCIENCE CHINA-life sciences上发表了题为“Spatiotemporal Transcriptomics Unveil Gelsolin as a Critical Regulator in Ventricular Remodeling after Myocardial Infarction”的研究成果,该研究首次从时空转录组学的角度分析了凝溶胶蛋白对心肌梗死后不同阶段心脏分子表型的影响。从细胞特征、空间位置、基因表达模式和细胞间相互作用方面全面揭示了Gelsolin通过调控非心肌细胞细胞骨架促进心肌梗死后心室重构的作用机制,并筛选出Gelsolin下游关键的调控因子及相关通路,为靶向Gelsolin的心梗后心力衰竭治疗策略提供了新思路和理论依据。
该研究利用CRISPR/Cas9技术结合空间转录组学技术,描绘了心肌梗死后早期(48h)和晚期(4w)两个时间点Gelsolin敲除(GSN-/-)和野生型小鼠(GSN+/+)的心脏组织变化及空间特征,明确了Gelsolin与心肌梗死后不同阶段心脏表型之间的关系。研究发现Gelsolin在心肌梗死后被进一步激活,主要在缺血缺氧区域发挥作用。敲除Gelsolin可有效改善心梗模型小鼠的早期心肌炎性损伤和晚期心肌纤维化,并减轻心脏功能障碍和心室重构。
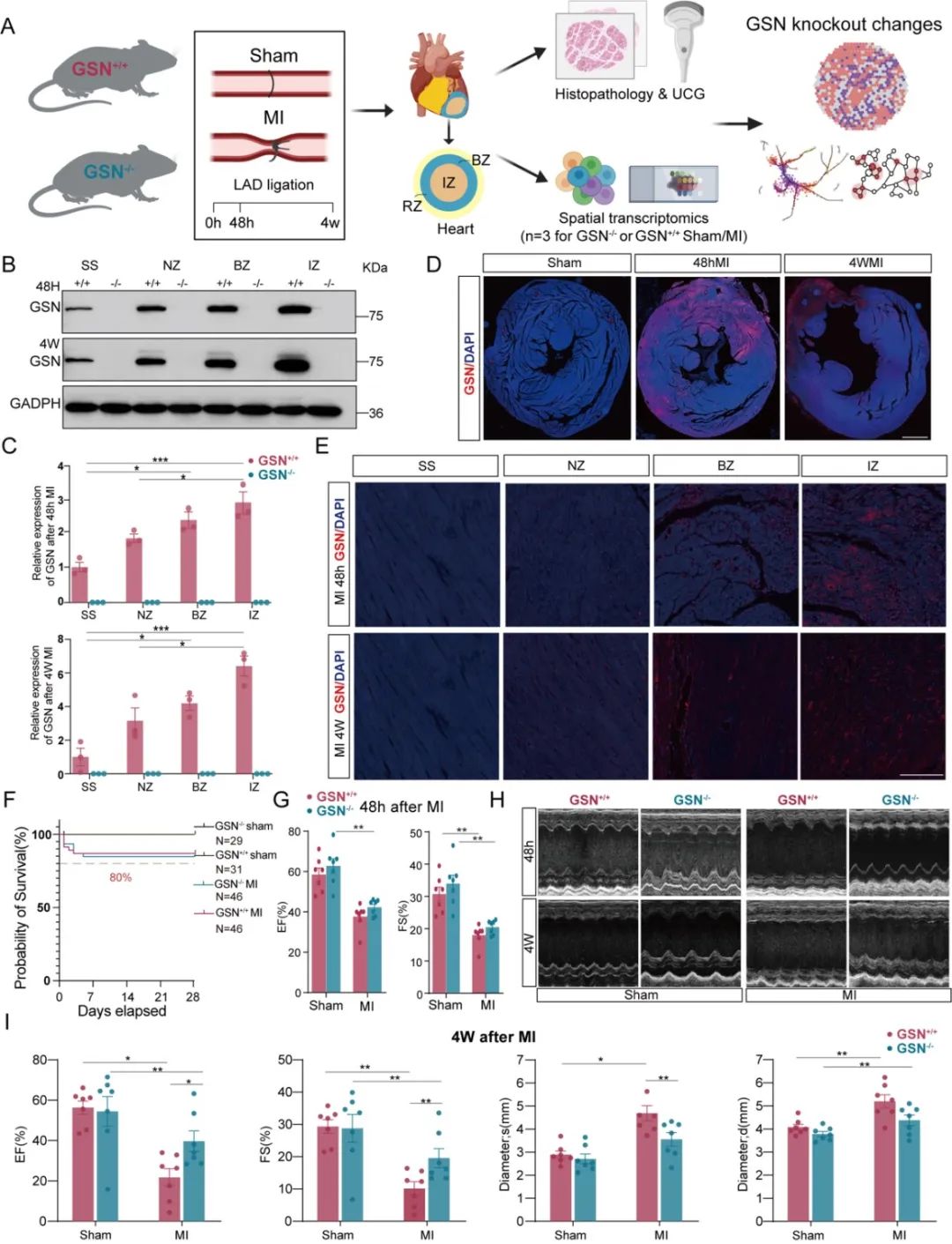
进一步对GSN-/-和GSN+/+小鼠心脏空间特征进行深度分析,发现Gelsolin的敲除显著降低了早期梗死区域(IZ)及邻近梗死区域(BZ)的单核细胞丰度,与其改善心梗后早期炎性细胞浸润有关。鉴于Gelsolin在单核细胞迁移和趋化中的关键作用,作者进一步结合迁移相关基因筛选出Gelsolin介导单核细胞募集的关键基因,包括经典的趋化因子、炎症因子以及细胞外基质相关基因,发现敲除Gelsolin后大多数迁移基因表达显著降低,尤其是纤连蛋白1 (Fn1)。已有研究表明,单核细胞的过度募集是促进心肌梗死后炎性损伤的核心因素,而持续加剧的炎症反应在晚期心脏纤维化、不良心脏重构中起着至关重要的作用。作者认为促进单核细胞募集是Gelsolin影响心梗后心室重构的始动环节。除单核细胞迁移和浸润外,心肌梗死另一大特征是单核/巨噬细胞格局的动态转变。因此,该研究进一步对髓系细胞进行了亚聚类分析,共识别出2个单核细胞群、3个心脏常驻巨噬细胞簇(TRM)和3个非常驻巨噬细胞群(Non TRM),发现GSN-/-小鼠心脏梗死区域中非常驻巨噬细胞群比例的一致减少,与敲除Gelsolin抑制早期单核细胞迁移相对应。
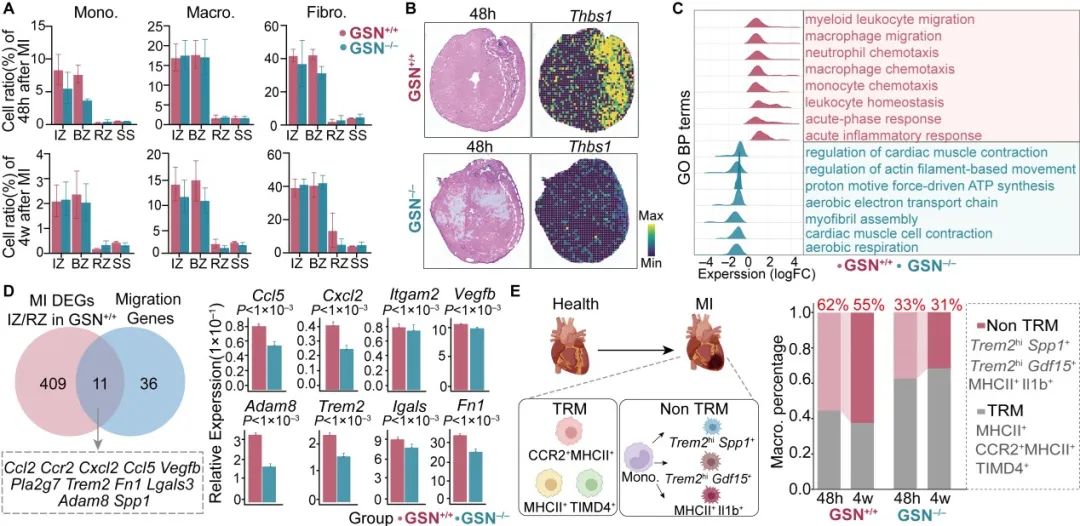
接下来,作者进一步通过拟时序确定Gelsolin对单核/巨噬细胞分化的影响,发现敲除Gelsolin有效延缓了单核细胞向Trem2+Spp1+巨噬细胞分化,并抑制了分化相关基因Egr1、Lgals1、Ctsd的表达,功能分析提示这些基因高度富集在细胞外区域、胶原纤维以及ECM组成中。既往研究表明Spp1+巨噬细胞具有促成纤维细胞活化的特性,因此,作者推测Gelsolin可能不仅影响巨噬细胞的分化,还参与调控其与成纤维细胞的细胞间通信。
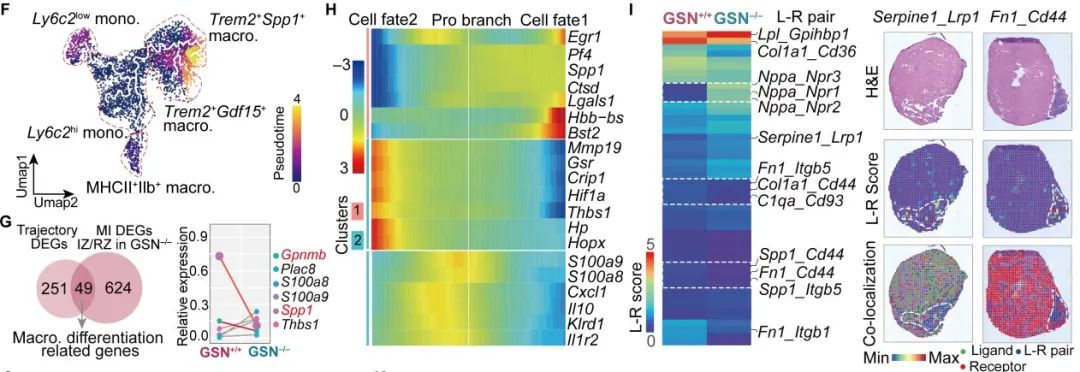
随后,作者利用stLearn比较了心肌梗死后晚期GSN+/+和GSN-/-小鼠心脏中空间受配体的相互作用,发现促纤维介质Spp1、Fn1相关配体-受体对在GSN+/+小鼠心肌梗死区域中被特异性激活,而具有抗纤维化作用的配体-受体对,例如Serpine1_Lrp1、Grn_Tnfrsf1a等则在GSN-/-小鼠心肌梗死区域中显著上调。作者进一步综合差异基因、拟时序分析和STRING蛋白互作数据库构建Gelsolin的下游调控网络,发现Gelsolin下游中Fn1调控的靶基因最多,在心脏梗死区域显著高表达,并与Spp1、Sparc、Lox、Lgals等ECM相关基因高度共定位。提示Gelsolin可能通过调节Fn1相关受配体对和ECM蛋白增加巨噬细胞与成纤维细胞串扰,从而促进成纤维细胞活化和心室重构。
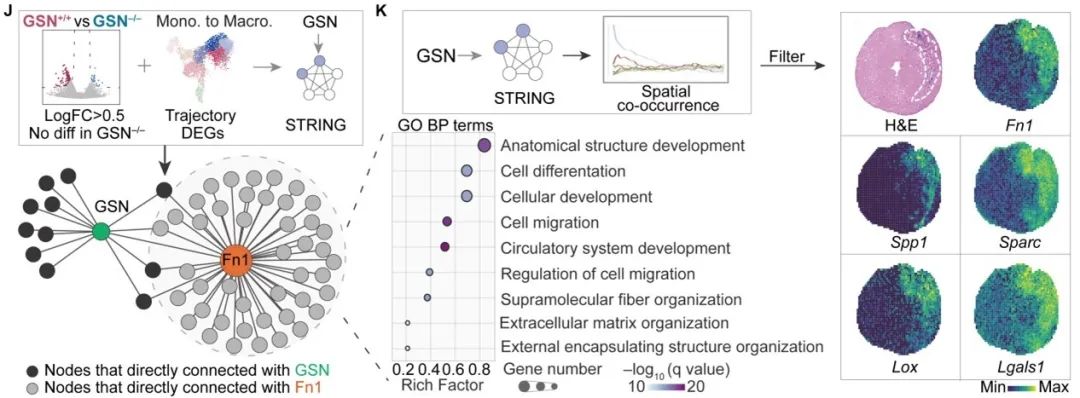
综上,该研究全面描绘了Gelsolin对心肌梗死后早期和晚期心脏空间分子特征的影响,Gelsolin通过调控Fn1促进单核细胞骨架重塑和伪足生成,加速其向梗死区募集和向巨噬细胞趋化。巨噬细胞的累积进一步增加了与成纤维细胞的串扰,Fn1、Sparc、Spp1等ECM蛋白分泌增加,促进成纤维细胞活化和胶原生成并加重心肌梗死后心室重构。该研究结果突破了以往心肌梗死主要关注心肌细胞骨架的研究局限,揭示了Gelsolin通过调控非心肌细胞(单核/巨噬细胞)细胞骨架结构在心室重构中的关键作用,为Gelsolin在心肌梗死后心室重构中的作用机制提供了直接证据和数据基础,推动了以抑制Gelsolin为目标临床疗法的转化与应用。
中国中医科学院西苑医院博士研究生王文婷、中国中医科学院西苑医院综合内科主治医师刘艳飞为共同第一作者,中国中医科学院西苑医院(国家中医心血管病临床医学研究中心)刘玥教授为独立通讯作者。该研究受到国家自然科学基金委、国家中医药管理局青年岐黄学者等项目的资助。
原文链接:
https://link.springer.com/article/10.1007/s11427-024-2806-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#心肌梗死# #凝溶胶蛋白#
29