荚卫东教授:肝细胞癌免疫新辅助治疗的初步探索
昨天 肝癌在线 肝癌在线 发表于上海
本文介绍 HCC 免疫新辅助治疗,包括临床价值、临床探索、呈现特征、热点问题,如目标人群、治疗方案、治疗周期等,总结其安全性和可行性及未来探索热点。
前言:随着靶向药物及免疫检查点抑制剂的不断发展,系统抗肿瘤治疗为肝细胞癌(HCC)患者带来了新的希望。手术切除是HCC患者获得长期生存的主要途径,降低肝癌术后复发率、提高根治性切除率是改善HCC患者预后的关键。目前新辅助治疗的临床研究已探索了局部治疗(TACE、HAIC、放疗)以及系统治疗等方法,为患者带来了一定的生存获益。近日,中国科学技术大学附属第一医院荚卫东教授分享“肝细胞癌免疫新辅助治疗的初步探索”学术报告,肝癌在线特将精华内容整理成文,以供临床医生参考。
Why: HCC免疫新辅助治疗临床价值
手术切除是中国肝细胞癌(HCC)患者获得长期生存的主要途径。但是随着HCC分期的进展,其手术根治可能性逐渐降低。东方肝胆团队发起的一项前瞻性观察性研究中[1],894例HCC患者接受手术切除后,术后1-2年出现复发高峰(每年约23%)。此后复发率逐渐减少,直到术后2-3年,然后复发率会再次上升,在术后4-5年出现第二个高峰(每年约35%)。与无复发和晚期复发(>2年)的患者相比,早期复发(≤2年)的患者总体生存是最差的(所有P<0.001);早期复发患者的复发后生存期(PRS)也比晚期复发患者的要差(19.1m vs. 37.5m,P<0.001)。而肿瘤微转移通常发生在诊断和手术前数年的早期,难以识别检测[2]。
基于TACE/HAIC肝细胞癌新辅助治疗进行了多项初步探索研究。2007年,一项回顾性研究评估对246例中心型巨大肝癌患者行术前TACE,结果显示术前TACE对可切除巨大肝癌的长期生存有改善作用[3];2013年一项荟萃分析纳入21项研究,共3210例患者,结果显示,术前TACE并未显著改善可切除HCC患者5年无疾病生存(DFS)率(32.1% vs. 30.0%,P=0.17)和5年总生存(OS)率(40.2% vs. 45.2%,P=0.37),复发及死亡率相当[4];2019年,一项随机对照、多中心、III期研究旨在评估术前新辅助HAIC治疗对改善超米兰标准BCLC A/B HCC患者术后生存的有效性。相较对照组,新辅助治疗组显著提升OS率和无疾病进展生存(PFS)率[5];2021年一项多中心、回顾性研究纳入377例可切除巨大肝癌患者(≥10cm),结果显示,术前TACE组中位OS和无复发生存期(RFS)均显著优于未行TACE组,且未增加围手术期发病率或死亡率[6]。
过去,化疗是晚期HCC系统抗肿瘤治疗的主流,但疗效有限且不良反应显著。2007年,索拉非尼获批,作为第一个在晚期肝癌患者中被证实有效的靶向药物,改变了HCC的治疗格局;2017年,基于免疫检查点抑制剂为基础的多种系统抗肿瘤治疗的方案如雨后春笋般先后获批用于HCC治疗。基于免疫检查点抑制剂为基础的系统抗肿瘤治疗方式更新迭代为HCC患者带来更多生存获益[7],一线靶免联合治疗中位OS可达16.4-26.3月,实现生存获益新高度。
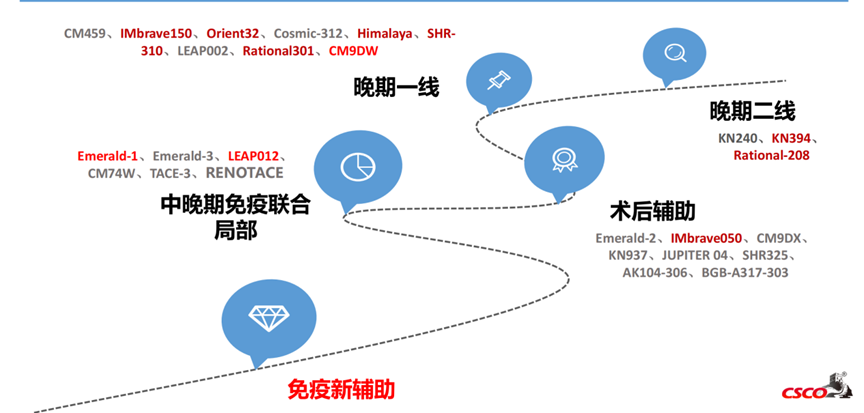
免疫检查点抑制剂在肝细胞癌全程管理中的发展进程
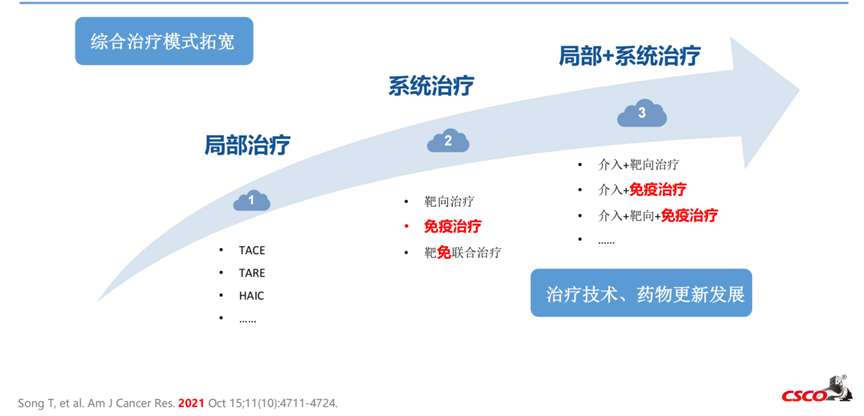
以免疫治疗为基础的系统治疗飞速发展驱动新辅助治疗时代变革
免疫新辅助治疗独特优势--激活肿瘤免疫应答,缩小肿瘤,清除微转移灶
术前患者肿瘤体积大、新抗原多,免疫系统功能也相对完整,免疫新辅助能够触发机体释放更多肿瘤抗原,激活更多数量和亚群的T细胞,充分激活免疫应答,术前缩小肿瘤;同时活化的T细胞通过血管和淋巴管到达并清除微转移病灶,引发更大范围的抗肿瘤免疫反应[8]。
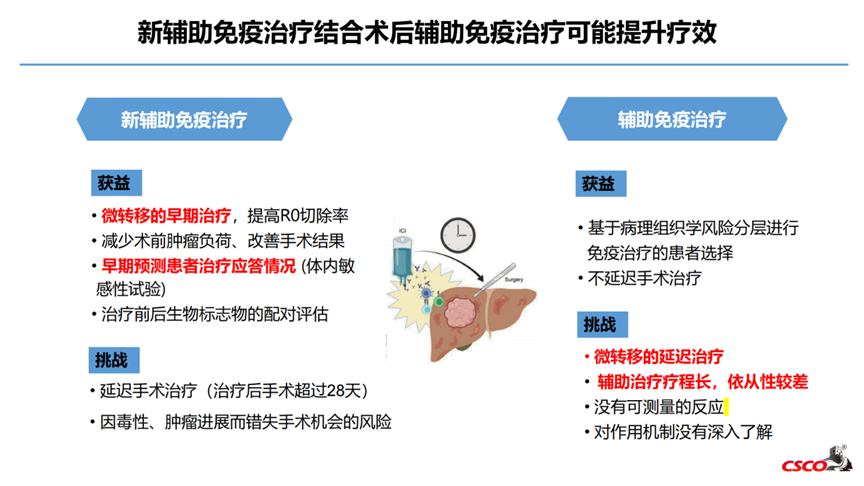
相对辅助治疗,新辅助治疗潜在优势包括:控制微小的转移病灶,减少术前肿瘤负荷,提高R0切除率,降低复发,延长生存;早期预测患者治疗应答情况;相比辅助治疗,新辅助疗程短,依从性更高[9,10]。
免疫新辅助治疗在其他实体肿瘤的治疗中已获得证实,具有临床获益。

How: HCC免疫新辅助治疗临床探索
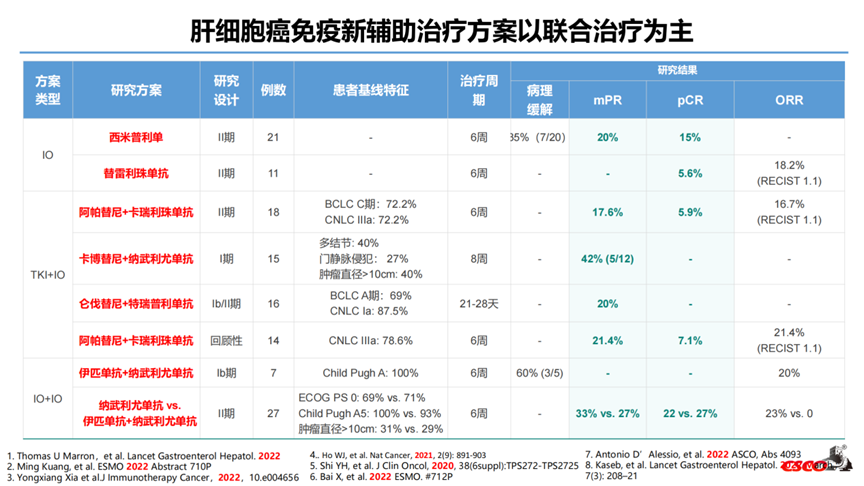
1-纳武利尤单抗单药或联合伊匹木单抗用于可切除肝细胞癌围手术期的Ⅱ期随机对照、开放标签研究最终结果-2020-ASCO-Poster 4599
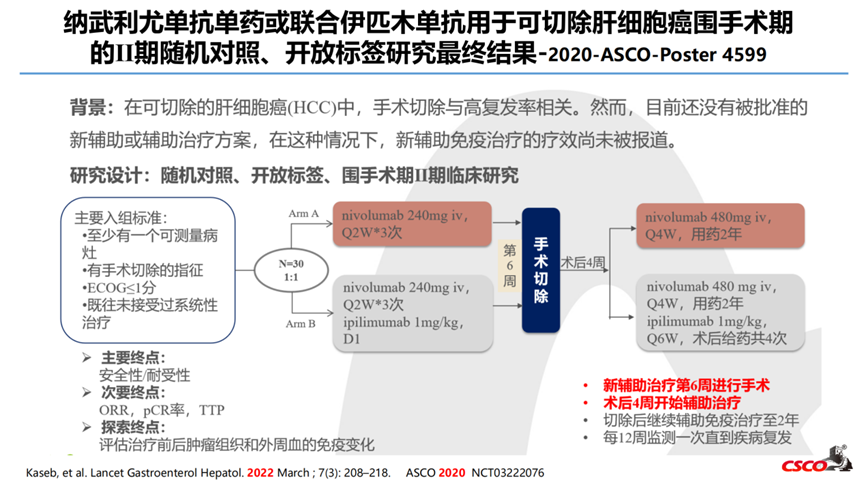
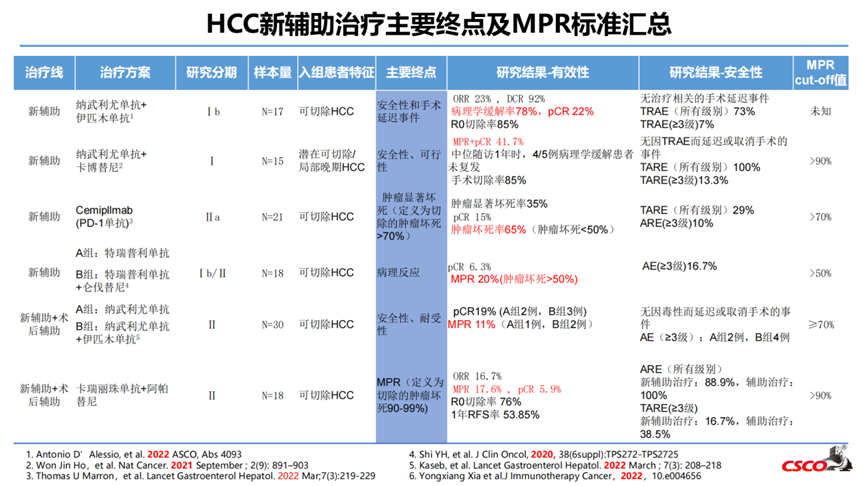
研究纳入30例病人,2例病人撤回同意,1例病人治疗时不合格,随机27例(A组13例,B组14例),21例病人按计划行手术切除(1例由于既往手术引起冰冻腹部,2例因残余病灶小,3例因疾病进展)。安全性在围手术期和术后阶段相似,无导致手术推迟或取消的毒性发生。21例病人中5例达到了pCR(pCR率24%)、3例病人(16%)达到MPR(坏死效果50-99%);术后复发与术前免疫治疗致病理缓解深度相关。
2-卡博替尼联合纳武利尤单抗新辅助边缘可切除或局部晚期肝细胞癌的Ib期开放标签研究- 2021 ASCO-GI Abs
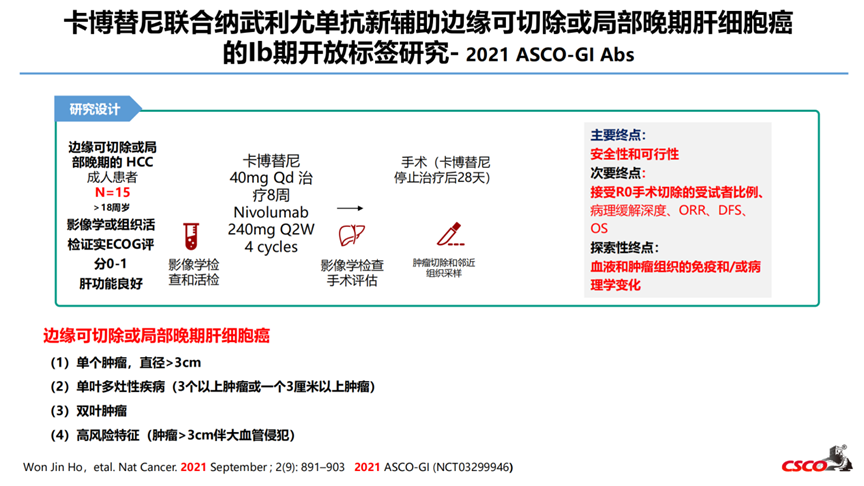
研究纳入15例HCC患者,其中12例接受R0手术切除,5例获得pCR或MPR。
3-西米普利单抗(PD-1抗体)新辅助治疗可切除肝细胞癌单臂、Ⅱ期、开放标签研究2021-AACA-poster CT182

入组21例患者,20例接受手术切除(1例IIIb期,肝门淋巴结转移,无法手术),从开始西米普利单抗治疗至手术切除的中位时间为29天(IQR 27-35)。20例接受手术切除的患者中:肿瘤完全坏死3/20(15%),肿瘤显著坏死7/20(35%),肿瘤坏死<50% 13/20(65%),根据RECIST 1.1,3例PR,17例SD(对应的总缓解率为15%)。
20例(95%)患者在新辅助治疗期间发生任何级别的不良事件;7例(33%)患者发生3级不良事件,未观察到4级或5级不良事件;1例患者发生3级斑丘疹,1例患者在新辅助治疗期间发生3级肺炎;进行类固醇治疗,导致手术延迟2周。尽管未给予西米普利单抗辅助治疗,但成功进行了手术切除。
坏死≥50%的患者中免疫细胞浸润显著高于无坏死患者。4例坏死≥50%的患者(3例100%坏死,1例50%坏死)肿瘤中CD8+T细胞浸润显著高于4例几乎无坏死的患者(P=0.0010),这一发现是肿瘤所特有的,邻近正常肝脏中观察到的T细胞数量无明显变化。切除后坏死达50%或以上的患者,在治疗前和治疗后标本的RNAseq分析中,除B细胞和幼稚T细胞特征细胞(基线时均未富集)外,CD8+T细胞、活化或功能障碍细胞、细胞毒性细胞、单核细胞源性巨噬细胞和B细胞在基线时富集,治疗后富集均增加。在几乎没有或没有坏死的患者中,这些标记物的表达水平没有变化(<50%)。
4-围手术期:卡瑞利珠单抗+阿帕替尼治疗可切除肝细胞癌2021-ASCO-Abs 4082

在可切除HCC患者中,使用卡瑞利珠单抗联合阿帕替尼围手术期治疗实现了29.4%的MPR,安全性可控。Biomarker分析CXCL10、CXCL 11和MS4A4A(巨噬细胞四聚体)在HCC对治疗的病理反应中的潜在作用。仍需要大样本数据进一步观察来阐明围手术期卡瑞利珠单抗联合阿帕替尼在可切除HCC患者中的疗效和安全性。
5-IPI(D1 Only)+Nivo用于肝细胞癌的新辅助治疗(PRIME-HCC研究)2022-ASCO-Abs-4093
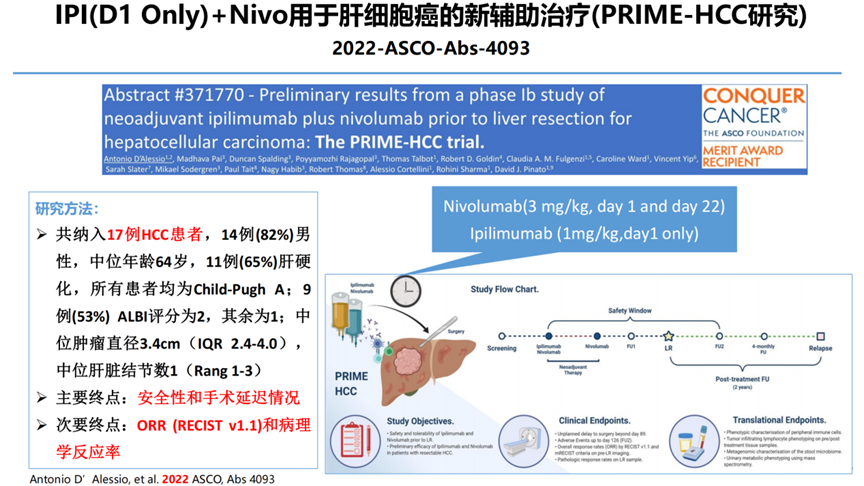
疗效:ORR达23%,DCR达92%;22%获得pCR。
研究结论:Nivo+Ipi用于HCC患者的新辅助治疗具有良好的安全性且不会延迟手术,其抗肿瘤活性具有很好的前景。
6-替雷利珠单抗新辅助治疗可切除的复发性HCC患者一项非随机对照II期研究(TALENT)- ESMO 2022 Abstract 710P
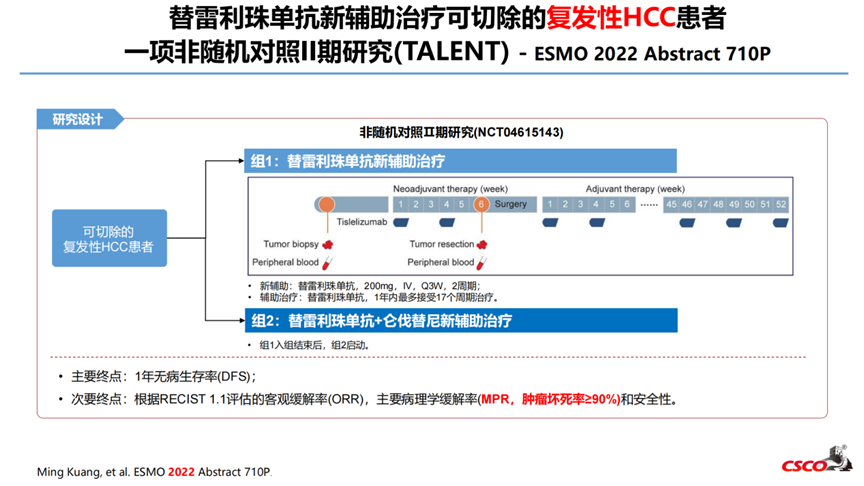
2021年1月-2021年9月,组1共入组了11例患者,所有患者均接受了新辅助治疗和手术切除。影像学缓解:ORR 18.2%(2/11),CR 1例,PR 1例,SD 8例。1例PD患者伴肝脏病灶增大以及新发肺和骨转移。病理学缓解:2例患者(R12,R16)肿瘤坏死率超过70%,其中1例pCR,1例肿瘤坏死率85%。其他患者肿瘤坏死率5-35%。截止至2022年03月20日,2例患者复发。新辅助阶段,任何级别的AE发生率为36.4%(4/11),无SAE发生;最常见的AE包括瘙痒(n=2),皮疹(n=2),疲劳(n=1);无因TRAE延迟手术的事件发生。该研究是第一项证明替雷利珠单抗新辅助治疗rHCC患者具有良好安全性和疗效的试验。
截止2023年9月30日,组2共纳入14例患者。所有患者行肝切除术前均完成替雷利珠单抗和仑伐替尼联合新辅助治疗。新辅助治疗阶段,14.3%(2/14)患者发生3级以下不良事件,未发生严重不良事件。最常见不良事件为疲劳(2例)、高血压(1例)和食欲下降(1例)。影像学方面,根据RECIST1.1标准,1例患者(8.3%)部分缓解,11/12患者(91.7%)疾病稳定,8例患者肿瘤缩小。病理学缓解方面,4例患者肿瘤坏死超过70%,其中1例肿瘤坏死85%,3例完全缓解。其他患者病理缓解为5-55%。直至2023年9月30日,仅1例患者术后1年内复发。替雷利珠单抗和仑伐替尼联合治疗新辅助治疗rHCC显示出令人鼓舞的疗效和安全性。联合治疗的长期效果还需进一步探索。
7-Abstract 4126:卡瑞利珠单抗联合阿帕替尼围术期治疗中高复发风险的可切除肝细胞癌的一项II/III期研究:II期阶段主要病理缓解率
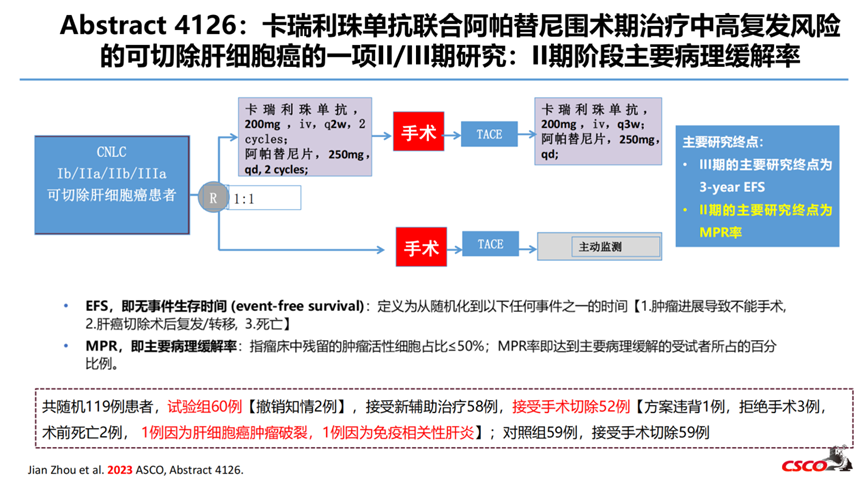
疗效方面,24/60例患者达到了MPR,即ITT人群的MPR率为40%,可手术人群(24/52)的MPR率46.2%。3例患者达到了pCR,即ITT人群的pCR率为5%,可手术人群的pCR率为5.8%。6/60例(10%)患者的残留活性肿瘤比例≤5%。安全性方面,19.3%患者出现3级以上TRAEs,其中最常见不良反应是AST升高(12.1%)、高血压(5.2%)和ALT升高(10.3%)。
本研究II期阶段的分析结果未达到无效性分析的终止标准。卡瑞利珠单抗联合阿帕替尼用于中高危复发风险的可切除肝细胞癌患者的主要病理缓解率较高,并且安全可耐受。
肝细胞癌免疫新辅助治疗临床初步探索--呈现的特征
1. 研究设计多为单中心、前瞻性的Ib期-II期、小样本的探索,缺乏III期研究数据;
2. 尚无标准的治疗模式:既有免疫单药、多数属于联合方案(IO+TKI 或者IO+IO)为主;又有术前新辅助治疗,多数结合术后辅助治疗;
3. 可切除的定义缺乏统一的标准:BCLC分期-A/B/C;CLNC分期-Ib/IIa/IIb/IIIa;
4. 新辅助治疗的周期相对固定:6周-8周;
5. 研究的主要终点多为安全性和以病理缓解率等为代表的短期指标,pCR在5.6%~27%、mPR约在17.6%~42%,与mOS的相关度未明。
What: HCC免疫新辅助治疗热点问题
1-适合的目标人群
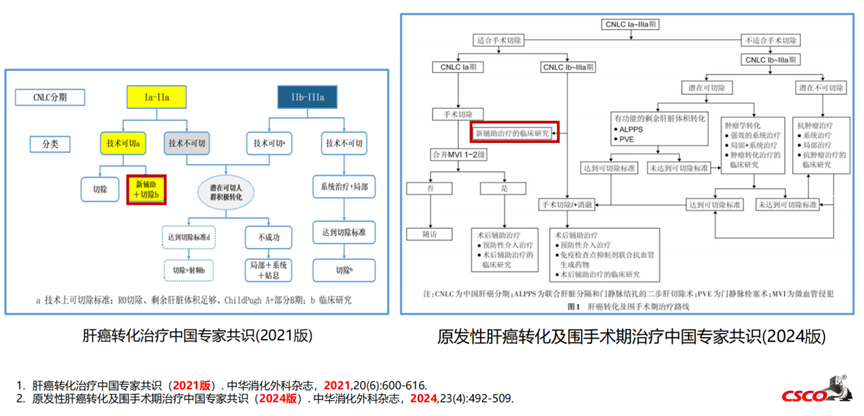
人群选择:“可切除”人群
可切除的定义缺乏统一的标准,不同的中心对可切除HCC的定义可能有所不同;多发肿瘤、大血管侵犯、门脉高压并不是手术的绝对禁忌证;现有的目标人群肝癌分期缺乏统一:BCLC分期-A/B/C期,CLNC分期-Ib/IIa/IIb/IIIa。
挑战与探索:
1.是否所有可切除HCC都需考虑新辅助治疗?
2.如何筛选免疫新辅助治疗的获益人群?
3.高危复发因素人群如何定义和分层?
2-适合的治疗方案
新辅助治疗选择方案时需考虑的因素包括:较高的抗肿瘤活性:更多的患者获得缩瘤;较高的ORR;较快的起效时间:减少手术等待时间;较短的TTR;较低的治疗失败率:避免失去手术机会;较低的PD率;可控的不良反应;较低的G3 TRAE,特别是较低的肝毒性,避免增加术后肝衰风险,保证手术的安全性。其中,较低的PD率、较低的肝毒性是新辅助治疗选择方案时重要的考量因素。
有限研究提示罕见因AE而导致手术延迟和取消。术前治疗安全性需谨慎考量,目前免疫新辅助系统治疗≥3级AE发生率大多在17%~23%,现有临床数据显示,缺乏新辅助治疗对手术延迟、手术取消或治疗期间死亡的统计。
理想方案制定遵循原则:肿瘤进展率低(低PD率),较高的缓解率(ORR),达到缓解时间早(较短TTR),较低的G3 TRAE(尤其是肝毒性、安全性良好)。
挑战与探索:
1. PD-1单抗--单药或者联合如何选择?哪些患者需要靶免联合治疗?
2. 如何选择个体化方案,进一步提高免疫新辅助治疗的效果(免疫治疗生物标志物的探索)?
3-新辅助治疗周期
新辅助治疗周期相对固定(6周-8周),PFS、TTR、中位AE时间决定新辅助治疗的疗程;在新辅助治疗的过程中,患者可能会因病情进展或治疗后出现肝脏毒性或其他严重的毒副作用等手术禁忌证而错失手术机会;HCC肿瘤体积倍增时间(TVDT)约为4-5个月,肿瘤生长模式存在异质性,亚洲研究报告的TVDT时间较其他地区短(4.1m vs. 5.8m),HBV感染为主的人群中更具侵袭性。
4-与OS相关性高的替代终点选择
术后复发与术前免疫治疗致病理缓解深度相关。肝细胞癌MPR的定义需统一,MPR/EFS与长期生存相关性不明确。
5-如何进一步提升免疫新辅助治疗的效果
5.1 免疫新辅助治疗联合术后辅助治疗
5.2 免疫新辅助治疗联合局部治疗
仑伐替尼联合替雷利珠单抗+经导管肝动脉化疗栓塞(LEN + TIS + TACE)围手术期治疗有高复发风险的可切除肝细胞癌:一项前瞻性、单臂、II期研究(ChiCTR2100048249),共纳入29例患者,26例患者接受R0手术治疗,2例患者(1例PR和1例SD)拒绝手术并继续接受LEN + TIS,1例患者出现PD并进行二线治疗。截至2023年9月,中位随访时间8.0个月(四分位距4.6-12.3个月)。未观察到3级或以上AE[11]。
Notable-HCC是一项单中心的Ib期临床试验,可切除HCC患者为研究对象。研究纳入符合条件的患者20例,中位年龄为58.5岁(48-78),19例患者ECOG PS评分为0,1例患者ECOG PS评分为1,所有患者Child-Pugh分级均为A。HCC最常见的潜在病因是HBV感染(85.0%),16例患者为新诊断HCC,4例患者为复发性HCC。3例(15.0%)患者BCLC分期为0期,17例患者为A期;17例(85.0%)患者CNLC分期为Ia期,3例(15%)患者为Ib期。研究发现:RECIST 1.1评估的ORR为42.1%,达到客观缓解的患者均为部分缓解(PR),疾病控制率(DCR)为100%。mRECIST评估的ORR为63.2%,其中3例患者达到完全缓解(CR),9例患者达到PR,DCR为100%。19例患者接受根治性R0切除术,其中2例(10.5%)患者达到病理学完全缓解(pCR),6例(31.6%)患者达到主要病理缓解(MPR)。1例(5%)行射频消融术,其余19例(95%)患者行根治性R0切除术。从新辅助治疗开始到手术切除的中位时间为55.9天(范围,49-69),4例患者手术延迟超过10天。与常规HCC切除术相比,替雷利珠单抗联合SBRT的新辅助治疗并未增加手术难度和术后并发症的风险。20例患者均发生任何级别的治疗相关不良事件(TRAE),未发生4~5级TRAE。所有AE均可自行消退,无需皮质类固醇治疗[12]。
总 结
对于可切除HCC患者,免疫新辅助治疗具有安全性和可行性,可以明显改善PFS、EFS以及病理缓解,评估长期生存数据(OS)有待于临床进一步观察;适合目标人群、个体化治疗方案、与OS相关性高的替代终点选择、基于免疫新辅助治疗联合术后辅助治疗以及联合局部治疗等,将成为HCC免疫新辅助治疗新的探索热点,有望改善高复发风险可切除HCC的疗效。
参考文献
1. Ming-Da Wang, et al. Oncologist.2020:25(10);e1541-e1551.
2. Hu Z, Nat Genet. 2019 ;51(7):1113-1122.
3. Xiao-ping, Chen,et al.Dig Surg 2007;24:208–213.
4. Zhou YM, et al. BMC Gastroenterol. 2013 Mar 19;13:51.
5. Li C, Wang MD, et al. Hepatol Int 2019;13:736–47.
6. Shaohua Li, et al. 2021 ASCO Oral #4008.
7. Yang C, et al. Nat Rev Gastroenterol Hepatol. 2023 Apr;20(4): 203-222.
8. Topalian S L, Taube J M, Pardoll D M. Science, 2020, 367(6477).
9. O‘Donnell JS, et al. Clin Cancer Res. 2019;25(19):5743-5751.
10. Soh J, Hamada A, Fujino T, Mitsudomi T. Cancers (Basel). 2021 ;13(16):4035.
11. Jiayi Wu, et al. ASCO GI 2024, Abstract 503.
12. Li Z, et al. Nat Commun. 2024 Apr 16;15(1):3260.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肝细胞癌# #免疫新辅助治疗#
2