刘秀峰教授:肝细胞癌系统治疗的未来方向
2024-10-23 肝癌在线 肝癌在线 发表于上海
近日,东部战区总医院刘秀峰教授作“肝细胞癌系统治疗的未来方向”学术分享,肝癌在线特将精华内容整理成文,供临床医生参考。
肝细胞癌(HCC)是我国常见的恶性肿瘤,其常用治疗手段包括手术切除、肝移植、消融、立体定向放疗、经动脉栓塞化疗、肝动脉灌注化疗和系统治疗等。近5年来,HCC系统治疗取得了一系列突破性进展。近日,东部战区总医院刘秀峰教授作“肝细胞癌系统治疗的未来方向”学术分享,肝癌在线特将精华内容整理成文,供临床医生参考。
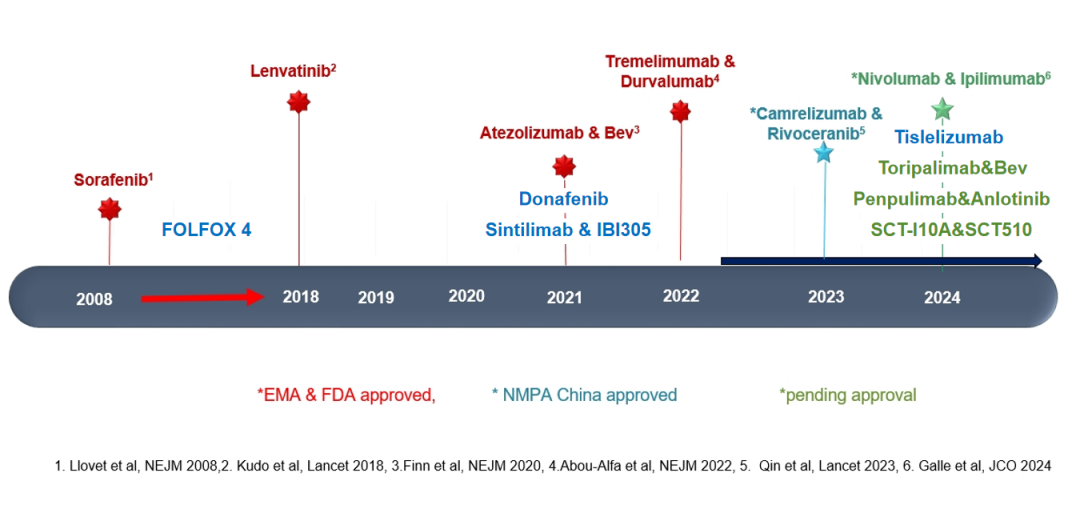
图1-HCC系统治疗
01 病因驱动的系统治疗
从图1可以洞察,中国获批适应症的HCC系统治疗选择远超于欧美国家和日本。究其主要原因,以免疫检查点抑制剂为基础的靶免联合治疗青睐于HBV相关HCC患者,病因学因素贡献了10%左右的疾病进展风险和死亡风险下降。
回顾2008~2018的十年间,HCC系统治疗的临床研究是“沉默”的,数项III期研究折戟沉沙,其中包括MET高表达晚期HCC患者应用Tivantinib(ARQ 197)和FGF19基因扩增/过表达患者应用Fisogatinib(BLU-554)。这两项研究在沉默的十年里都是“过客”,但是笔者的中心有幸参与其中,都观察到有效的病例。尤其,今年ESMO报道了另一个FGFR4抑制剂依帕戈替尼(ABSK011)的研究成果[1],荣获“最佳壁报奖”,值得研究者反思。
依帕戈替尼可用于治疗晚期实体瘤,尤其是存在FGFR4信号通路异常(如配体FGF19扩增/过表达、FGFR4突变/扩增/融合等)的晚期HCC、胆管癌、乳腺癌等。本次ESMO会上发布的数据中,依帕戈替尼作为单一药物,展现出可控的安全性和优异的抗肿瘤活性。40例经治的、FGF19过表达的HCC患者接受了依帕戈替尼220mg BID治疗,其中38例可评估,有效率达到36.8%(14/38),疾病控制率(DCR)达到78.9%(30/38)。同时,接受过免疫检查点抑制剂(ICIs)和酪氨酸激酶抑制剂(mTKIs)治疗的患者有效率达到44.8%(13/29),最长DoR达到16.4m,mDoR达到7.4m,DCR达到79.3%(23/29),mPFS达到5.5个月。
这些小分子TKIs是否还有机会重塑HCC系统治疗的格局不得而知,但是在那个“沉默的年代”,领域内以欧美学者引领的PIs一直试图寻找HCC的功能驱动靶点,只是没有真正意义上把病毒性HCC和非病毒性HCC分开。今天,我们站在肿瘤免疫微环境(TME)的高度回望过去,突然发现“此中有真意,欲辩已忘言”!病因驱动的系统治疗临床研究开展不仅是过去失败研究“痛的领悟”,也将是未来重要的方向之一。
非病毒相关HCC约占HCC总体的25%,主要包括非酒精性脂肪性肝病(NAFLD)、酒精性肝病和其他[2]。从NAFLD进展到非酒精性脂肪性肝炎(NASH)再演变为HCC的过程,本身就具有独特的分子和免疫特征,受到诸多因素的影响。2020年后,随着学界对NAFLD认识的深入,NAFLD更名为MAFLD。与曾用名NAFLD相同,MAFLD作为多系统代谢功能紊乱累及肝脏的表现,其发病机制、临床表现、病理改变及自然转归均存在一定异质性。鉴于MAFLD复杂的病理生理学特征,通过单一的检测方法或指标诊断MAFLD往往略显偏颇,需要制订类似代谢综合征多种工作定义来明确MAFLD的定义和诊断标准(图2)。
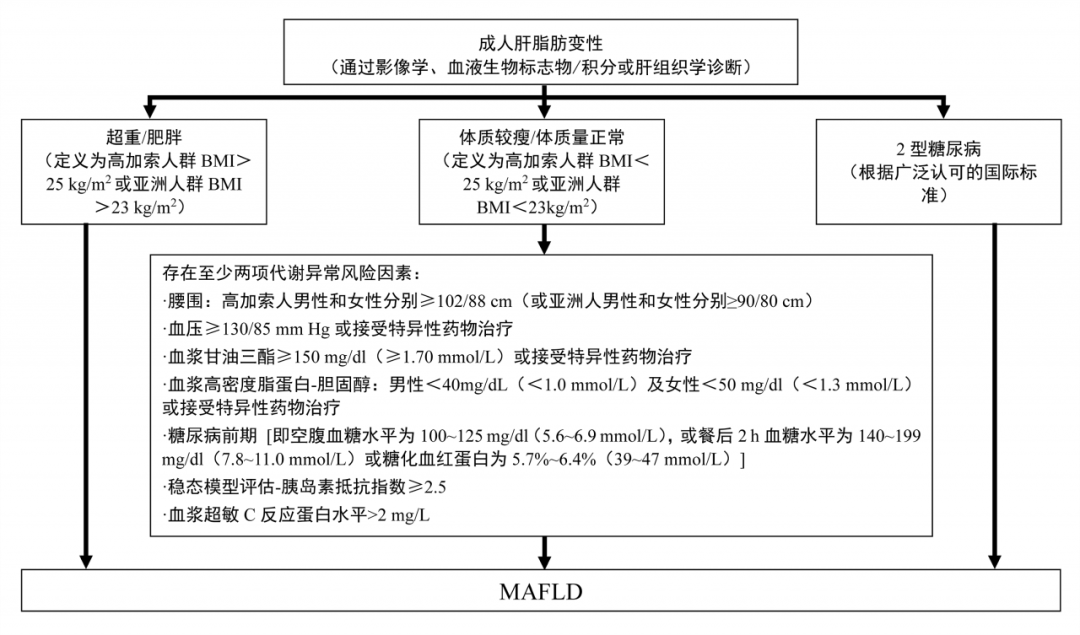
图2-MAFLD诊断标准
无论是NAFLD抑或MAFLD,其实从免疫检查点抑制剂中的获益都非常有限(可能需要双免或系统化疗),本身的病程较病毒相关HCC长。有研究[3]比较了NAFLD和MASLD(概念等同于MAFLD)患者不可切除HCC的预后,发现NAFLD和MASLD组之间的总生存率没有显著差异,NAFLD和MASLD患者的中位总生存期(mOS)分别为583天和472天,1年和3年生存率亦无显著差异(1年,71.1% vs. 70.3%;3年,26.3% vs. 24.3%)(图3)。
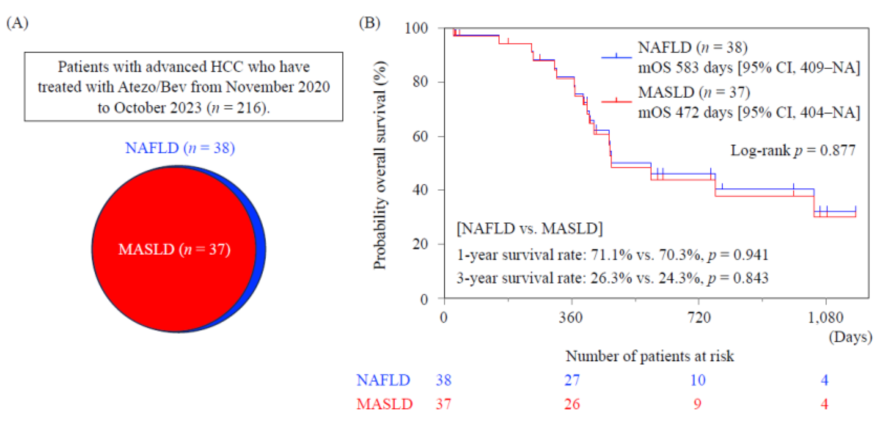
图3-NAFLD和MASLD组阿替利珠单抗+贝伐珠单抗联合治疗下HCC的预后
这些非病毒相关HCC在布局系统治疗前需要从影像组学、蛋白组学、基因组学等多组学层面仔细甄别,避免免疫治疗的过度,还原疾病的自然病程。
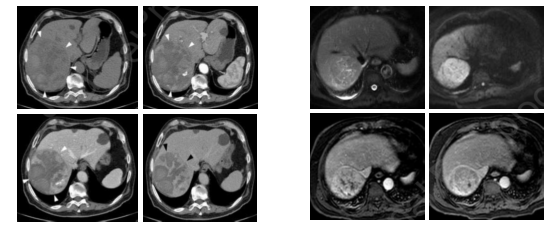
图4-肝脏肿瘤的影像学表现
图4左图为65岁非肝硬化男性,右肝叶9.6厘米(白色箭头),肿块轮廓清晰。在CT平扫上病灶呈异质性;在动脉期呈不规则强化;在门静脉期和延迟期上,肿块与周围实质相比密度明显降低,表现为“快退”。右图为72岁非肝硬化男性,S7段有一个5.7cm的肿块。在MRI上,病变在T2脂肪抑制序列上表现为高强度,并显示扩散受限。在给药后,显示动脉不均匀强化和门静脉相“快退”。
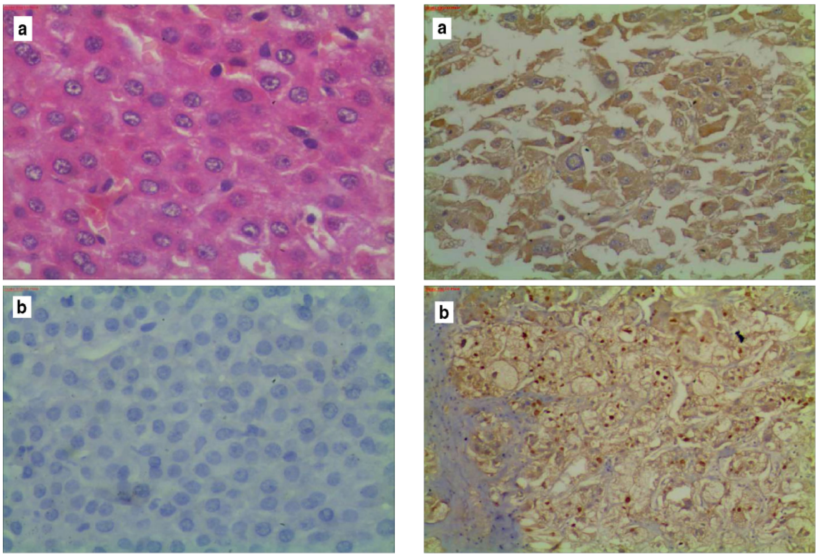
图5-不同病因所致HCC病理学表现
图5左a为NBNC-HCC伴小梁型,少见有丝分裂(核I级),无淋巴细胞浸润。肿瘤为I期(T1 N0 M0)(H&E×200);左b显示同一病例肝炎抗原免疫染色阴性(链亲和素生物素×400);右a HCV细胞质染色阳性,有明显的核假包涵体;右b HBV核心抗原核染色阳性的乙肝病例,神经和淋巴浸润伴肝硬化改变,两种肿瘤图均为核级II。肿瘤为IIIA期(T3 N0 M0)(链亲和素生物素×200)。
02 局部系统治疗的延伸
系统治疗的快速进步促成“局部系统治疗”概念的诞生,在BCLC或CNLC分期系统诊治路径中,局部治疗均明确定义了适应症,BCLC C期或CNLC IIIb期是局部治疗的“禁忌”。
如下两项临床研究的报道明显是“局部系统治疗”的有力佐证:
①HAIC+LEN+PD-1抑制剂对比仑伐替尼+PD-1抑制剂治疗IIIb期HCC[4]:PSM后,与LEN-P组相比,HAIC-LEN-P组的mOS和中位无进展生存期(mPFS)显著延长(mOS:27.0个月 vs. 9.0个月,P<0.001;mPFS:8.0个月 vs. 3.0个月,P=0.001)。IPTW后,HAIC-LEN-P组的mOS(HR=0.384,P<0.001)和mPFS(HR=0.507,P<0.001)显著高于LEN-P组。HAIC-LEN-P组的ORR是LEN-P组的两倍(PSM队列:67.3% vs. 29.1%,P<0.001;IPTW队列:66.1% vs. 27.8%,P<0.001)。
②局部消融+特瑞普利单抗对比特瑞普利单抗治疗IIIb期HCC,结果显示既往接受过治疗的uHCC患者中,次全消融联合特瑞普利单抗与单独使用特瑞普利单抗相比,改善了临床疗效,且安全性可接受[5](图6、图7)。
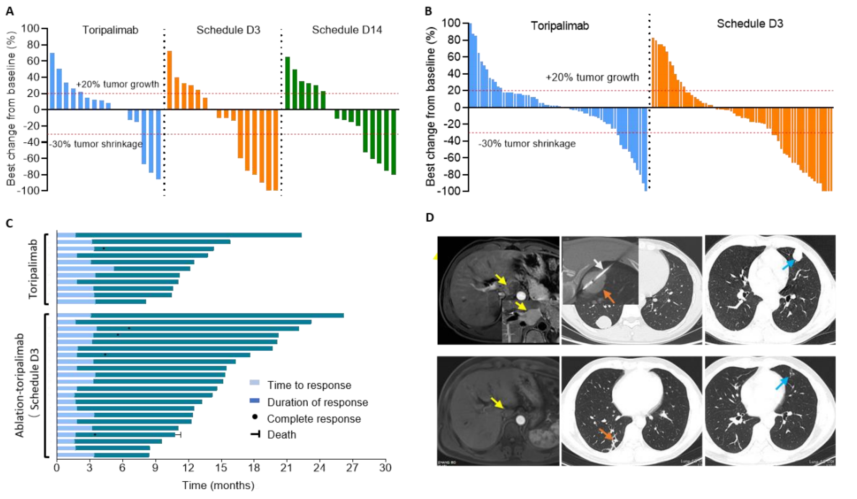
图6-根据mRECIST的肿瘤反应
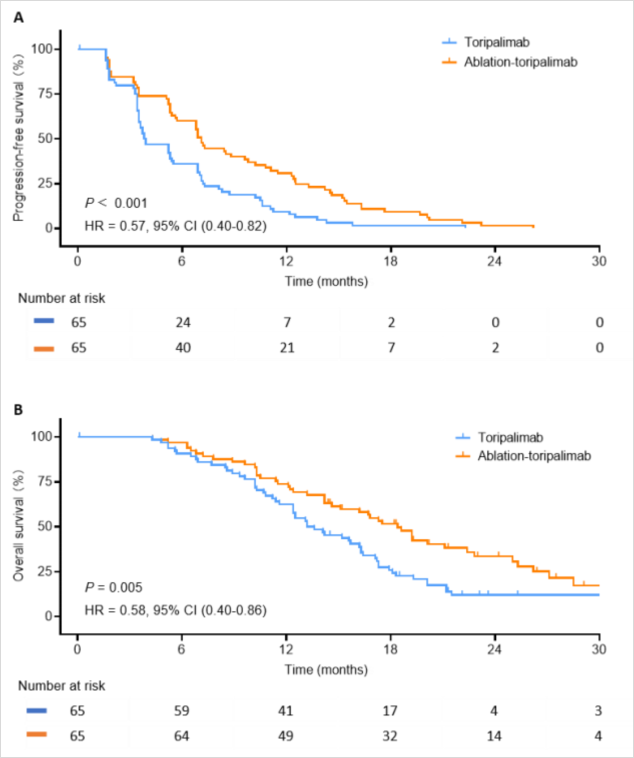
图7-PFS和OS分析
二线治疗如何开展研究是目前棘手的话题,现有的证据都是一线TKI或系统化疗进展后开展的。在免疫治疗如火如荼的当下,一线的场景早已改变,二线治疗如何开展很少有高循证医学证据回答。
如下三项小型的II期研究试图探索二线TKIs如何应用:
① 阿替利珠单抗+贝伐珠单抗失败后uHCC的二线治疗中,仑伐替尼在现实环境中表现出相比于索拉非尼更好的PFS,但OS相当[6](图8);
② ICI进展后应用卡博替尼,27名和20名患者分别接受过一种和两种先前治疗,中位随访时间为11.2个月,结果如图9所示[7];
③发布于2024ASCO会上的一项研究评估了瑞戈非尼联合帕博利珠单抗在既往只使用了一种ICI方案后进展的晚期HCC患者中的疗效。研究根据先前治疗定义了两个队列:队列1=阿替利珠单抗+贝伐珠单抗;队列2=任何其他ICI方案(单独或联合)(图10),结果如图11所示[8]。
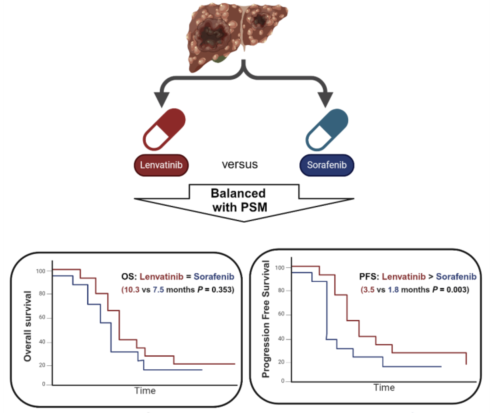
图8-PFS与OS分析
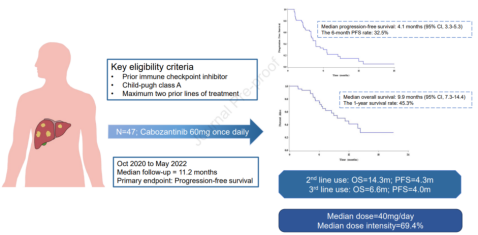
图9-mPFS为4.1个月,mOS为9.9个月,1年OS率为45.3%
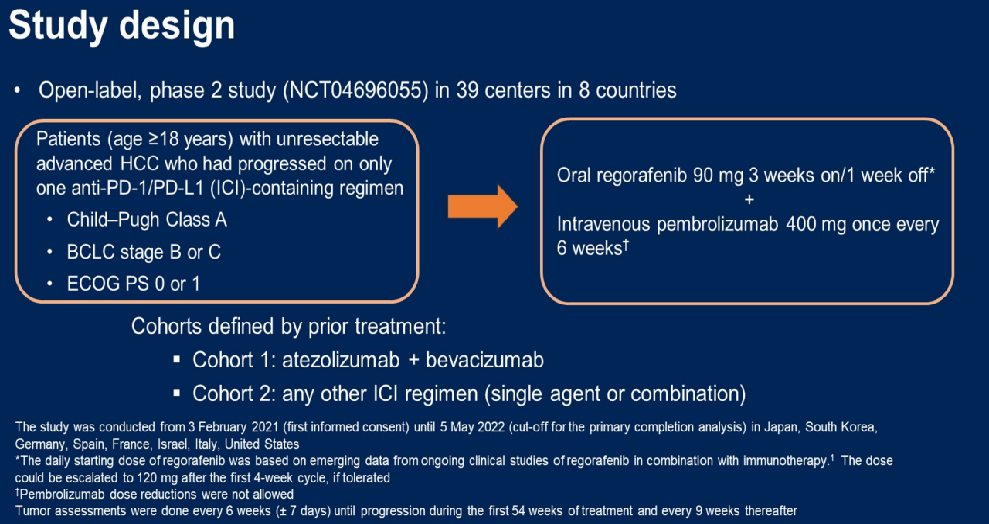
图10-研究设计
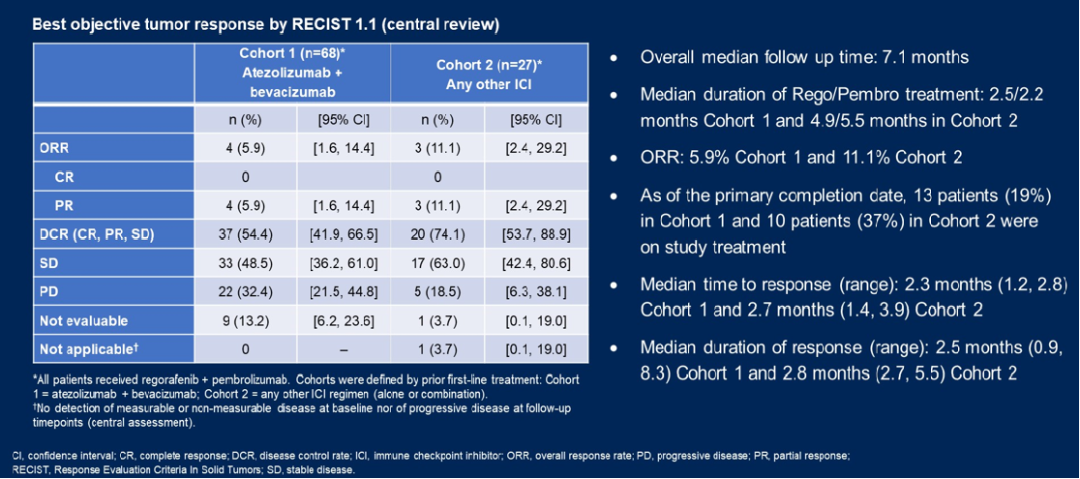
图11-研究结果
以上研究回避了一线免疫治疗的进展方式,并未在二线场景下考察异质性。免疫治疗存在原发耐药和继发耐药是不争的事实,原发耐药的患者本应规避免疫治疗的“重启”或“再挑战”;而继发耐药后,肝内进展、肝外进展抑或血管进展的应对策略在临床实践中需要区别对待,以上“局部系统治疗”的案例同样可以移植到二线场景。
我国学者在对接受ICIs治疗的中国晚期HCC患者中总结了四种不同的进展模式(p-IIb、p-IIIa、p-IIIb和p-IIIc),它们在PPS(进展后生存期)和OS方面表现出显著差异,提示免疫治疗失败后HCC进展和预后的异质性(图12)[9]。因此,二线系统治疗的未来方向极有可能需要二次分层(正如我们分析一线III期临床研究的后续治疗影响),需要析因分析,不能简单粗暴。
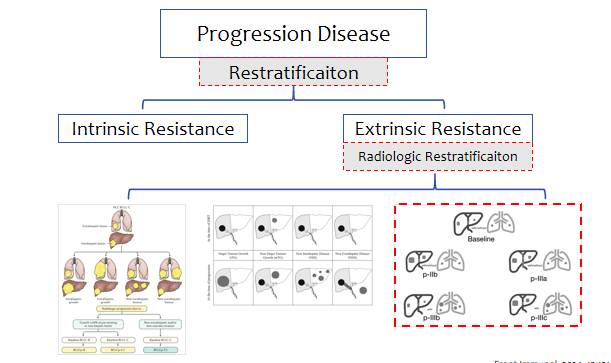
图12-晚期HCC患者四种不同的进展模式
在“局部系统治疗”概念的支撑下,另一个重要话题是肝功能对OS的影响。发表于Digestive and Liver Disease的一项综述[10]指出,维持最佳肝功能至关重要,肝功能失代偿可能会导致抗肿瘤治疗临时或永久停止。肝功能失代偿并非总与疾病进展相关,约15%的患者与系统治疗有关。而当局部和系统同时或序贯进行时,及时识别并充分管理显得尤为重要。有学者提出晚期HCC系统治疗试验设计的次要终点指标应该包括DFS(无失代偿生存,decompensation-free survival)(图13),期待这个另类的“DFS”引起业界的关注,期待它早日登上临床研究的舞台。
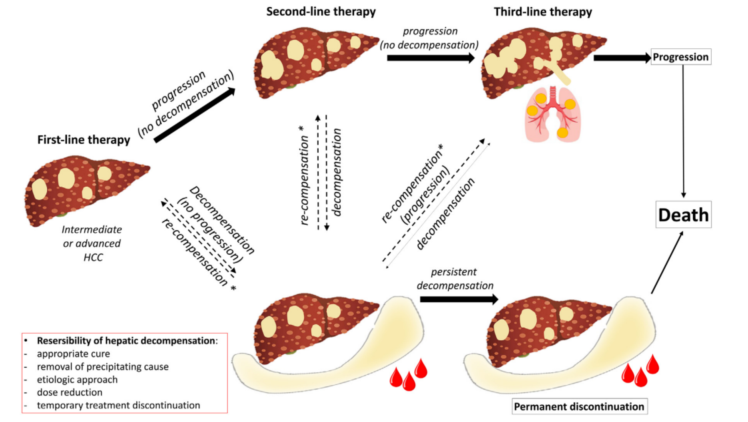
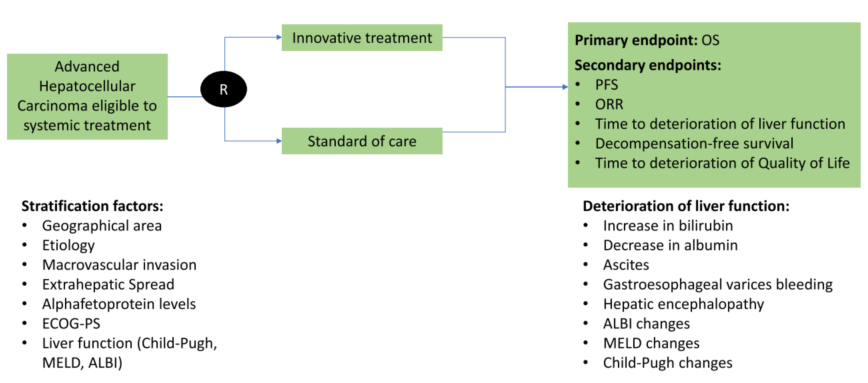
图13-关于晚期HCC全身治疗试验设计的提案
03 “机会之窗”研究
“Window-of-Opportunity” studies
“机会之窗”研究利用癌症诊断后的“窗口”时间,通常是在癌症治疗开始之前。近年来,这种研究设计已经成为药物开发的一个更常规的特征,因为这个“窗口”提供了一个机会,可以对未受先前治疗干扰的肿瘤治疗进行彻底的药效学评估。许多最初的窗口试验都是对重新用于癌症治疗的药物的生物活性进行调查。在“机会之窗”研究中,分子终点通常是描述性的,没有正式的统计检验。如果研究队列较大,可将RFS作为次要终点,或者短期临床暴露可以纳入以注册为目的的大队列研究,作为与病理反应和/或特定生物标志物一起的共同主要终点,以验证实验室结果并将其与临床有意义的终点相关联。
早先“报阳”的大型III期临床研究IMbrave 050,在今年ESMO最终公布了阴性结果。免疫治疗或者靶免治疗能否从后线迁移到辅助治疗阶段目前尚无定论。纵观HCC的根治手段东西方差异(图14),其实存在适应症把握范围不同(5年生存率差异较大),不同的“人”(术者)、不同的“刀”(切除)、不同的“针”(射频),相同的辅助治疗手段,面对的是不同病因的患者,在如此多“混杂因素”下判读III期临床的结果,说实话学霸也无能为力,解决的办法可能是新辅助免疫+辅助免疫治疗,这在晚期黑色素瘤中已经得到证实(图15)[11]。
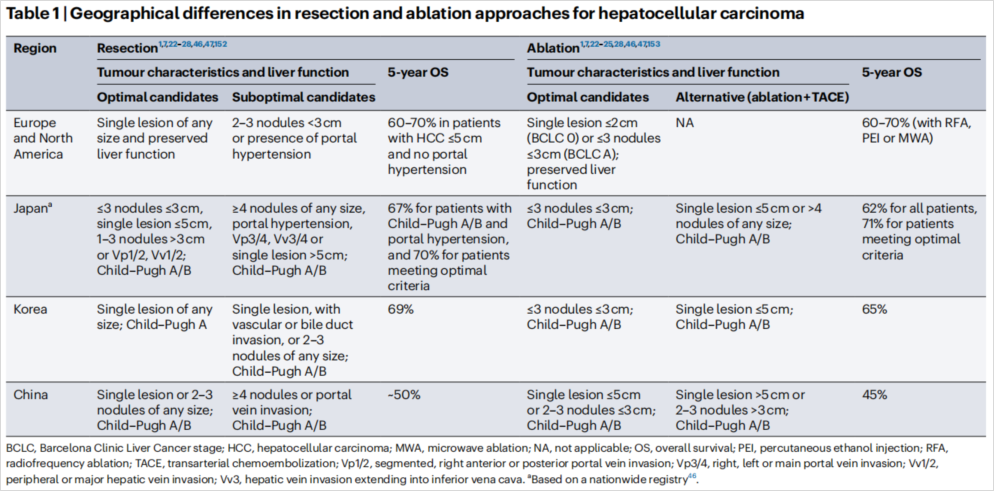
图14-HCC切除和消融方法的地理差异

图15-研究封面与主要结果
辅助免疫治疗面对的MRD,免疫原性较根治性治疗前的免疫原性迥异,提前布局免疫治疗理论上可以促进更广泛的T细胞效应。图16展示了免疫疗法和疫苗在HCC新辅助和辅助治疗中的作用机制[12]。
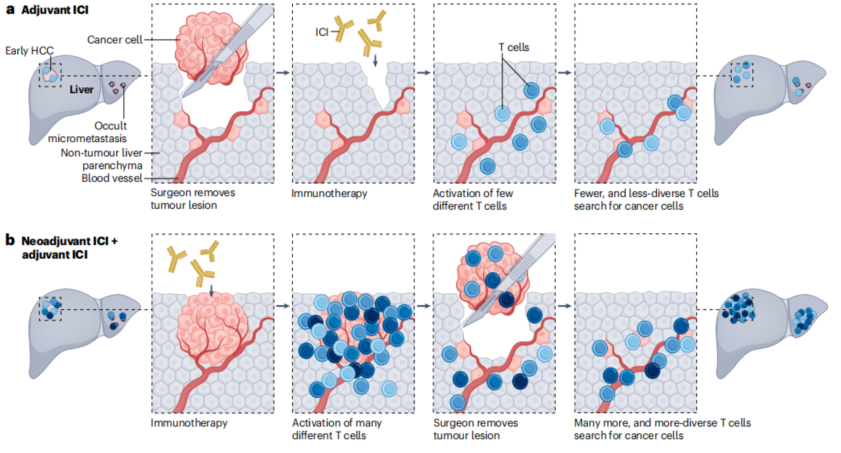
图16-免疫疗法和疫苗在HCC新辅助和辅助治疗中的作用机制
a,手术后辅助ICIs,从而激活不同的T细胞亚群。
b,术前新辅助ICIs,与辅助相比,可促进更广泛的T细胞效应。
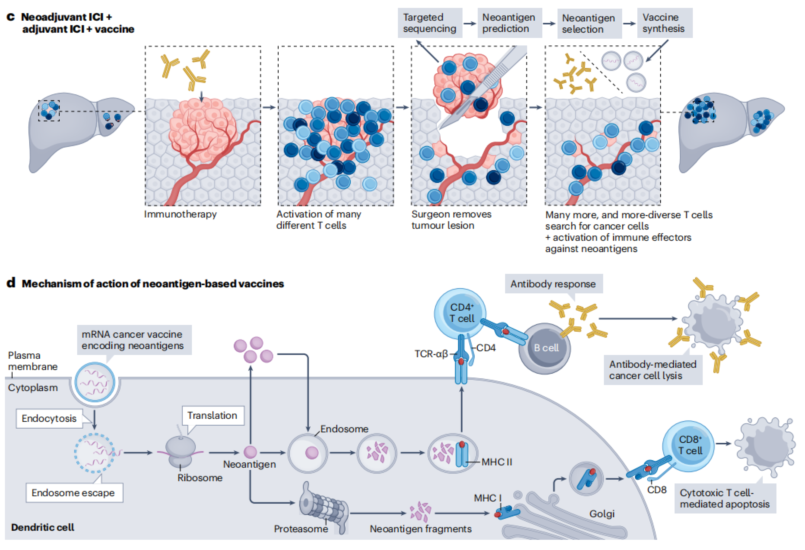
c,过去癌症疫苗在切除后施用。在基于mRNA的抗肿瘤疫苗的开发中,切除的肿瘤组织进行靶向测序以确定特定的肿瘤突变,然后根据其免疫原性选择含有这些突变的肽,选择新抗原作为DNA片段整合到质粒中,随后在体外转录成mRNA。最后,这些mRNA被打包成纳米颗粒。基于疫苗的方法,如基于mRNA或基于树突状细胞(DC)的疫苗,也可以被视为新辅助疗法。
d,新抗原疫苗的作用机制:含有编码选定新抗原的mRNA的纳米颗粒被DC内吞,其中mRNA被核糖体释放并转录,由于它们是新抗原,因此产生的新抗原被蛋白酶体碎片化,并通过主要组织相容性复合体(MHC)I类分子呈现在细胞表面,DC介导的抗原呈递激活CD8+ T细胞,随后导致癌细胞凋亡。或者DC内产生的新抗原可以被其他抗原呈递细胞分泌和内化,在那里它们被降解成片段,随后通过MHC II类分子呈递,激活CD4+细胞并诱导B细胞产生抗体来破坏癌细胞。
KEYNOTE-942研究[13]结果证实,与帕博利珠单抗单药治疗相比,辅助mRNA-4157加帕博利珠单抗可延长切除高危黑色素瘤患者的无复发生存期,并且显示出可控的安全性。这些结果证明基于mRNA的个体化新抗原疗法在辅助治疗中可能是有益的。该疫苗于2023年2月获得FDA的突破性指定,代表着癌症mRNA疫苗时代的里程碑。
需要指出的是,只有一小部分(约20%)的HCC是可切除的。而在接受切除的患者中,70%或更多的患者最终会复发。新辅助和辅助免疫治疗策略都可能提供降低复发风险的可能性,但新辅助免疫治疗还提供了检测疾病生物学行为的可能性,以选择可能从切除中受益的人群,并通过改变疾病生物学和降低局部晚期或不可切除的患者的分期来扩大可切除的人群,可被视为推进癌症免疫治疗的“机会之窗”(图17)[14],这类“机会之窗”临床试验其实在中国已经生根发芽,只是我们不以为然,还没有很好地完善终点指标。
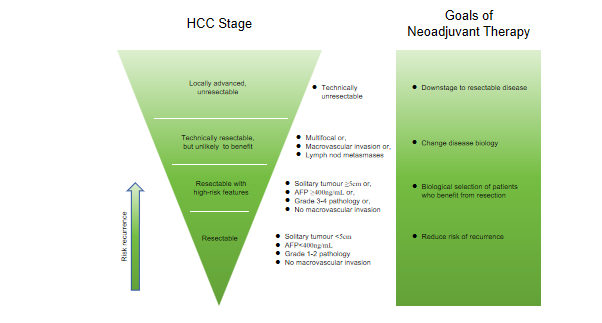
图17-HCC新辅助治疗降级/可切除性策略
参考文献
[1]Xiao-Ping Chen,et al.Updated Safety and Efficacy of ABSK-011 in advanced hepatocellular carcinoma (aHCC) with FGF19 overexpression from a Phase 1 study.2024ESMO.abstract.983P.
[2]Llovet J M, Willoughby C E, Singal A G, et al. Nonalcoholic steatohepatitis-related hepatocellular carcinoma: pathogenesis and treatment[J]. Nature reviews Gastroenterology & hepatology, 2023, 20(8): 487-503.
[3]Suzuki H, Shimose S, Iwamoto H, et al. Changing from NAFLD to MASLD: Similar prognosis of patients with HCC under atezolizumab/bevacizumab treatment between NAFLD and MASLD[J]. Clinical and Molecular Hepatology, 2024, 30(2): 263.
[4]Guan R, Zhang N, Deng M, et al. Patients with hepatocellular carcinoma extrahepatic metastases can benefit from hepatic arterial infusion chemotherapy combined with lenvatinib plus programmed Death-1 inhibitors[J]. International Journal of Surgery, 2024: 10.1097.
[5]Zhou C, Li Y, Li J, et al. A phase 1/2 multicenter randomized trial of local ablation plus toripalimab versus toripalimab alone for previously treated unresectable hepatocellular carcinoma[J]. Clinical Cancer Research, 2023, 29(15): 2816-2825.
[6]Chon Y E, Kim D Y, Kim M N, et al. Sorafenib vs. Lenvatinib in advanced hepatocellular carcinoma after atezolizumab/bevacizumab failure: A real-world study[J]. Clinical and molecular hepatology, 2024, 30(3): 345.
[7]Chan S L, Ryoo B Y, Mo F, et al. Multicentre phase II trial of cabozantinib in patients with hepatocellular carcinoma after immune checkpoint inhibitor treatment[J]. Journal of Hepatology, 2024.
[8]Anthony B El-Khoueiry,et al.2024 ASCO Abstract 4007.
[9]Yang C X, Pan Y X, Ye F, et al. The pattern of tumor progression on first-line immune checkpoint inhibitor-based systemic therapy for Chinese advanced hepatocellular carcinoma–CLEAP 004 study[J]. Frontiers in Immunology, 2024, 15: 1310239.
[10]Cabibbo G, Aghemo A, Lai Q, et al. Optimizing systemic therapy for advanced hepatocellular carcinoma: the key role of liver function[J]. Digestive and Liver Disease, 2022, 54(4): 452-460.
[11]Patel S P, Othus M, Chen Y, et al. Neoadjuvant–adjuvant or adjuvant-only pembrolizumab in advanced melanoma[J]. New England Journal of Medicine, 2023, 388(9): 813-823.
[12]Llovet J M, Pinyol R, Yarchoan M, et al. Adjuvant and neoadjuvant immunotherapies in hepatocellular carcinoma[J]. Nature Reviews Clinical Oncology, 2024, 21(4): 294-311.
[13]Weber J S, Carlino M S, Khattak A, et al. Individualised neoantigen therapy mRNA-4157 (V940) plus pembrolizumab versus pembrolizumab monotherapy in resected melanoma (KEYNOTE-942): a randomised, phase 2b study[J]. The Lancet, 2024, 403(10427): 632-644.
[14]Topalian S L, Forde P M, Emens L A, et al. Neoadjuvant immune checkpoint blockade: a window of opportunity to advance cancer immunotherapy[J]. Cancer cell, 2023, 41(9): 1551-1566.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肝细胞癌# #系统治疗#
39