纤维化肿瘤微环境与免疫治疗
2024-07-30 小药说药 小药说药 发表于上海
整个纤维化反应直接和间接地影响了免疫疗法的治疗反应。纤维化反应的成分、肿瘤细胞和免疫细胞之间的相互作用是复杂的,并且相互关联。
前言
近十年来,肿瘤免疫治疗取得了显著的成功。然而,高响应率只体现在血液系统肿瘤,实体瘤的临床应用也仅限于少数有反应的恶性肿瘤。反应不佳的实体瘤显示出肿瘤细胞和周围微环境(TME)的显著异质性。
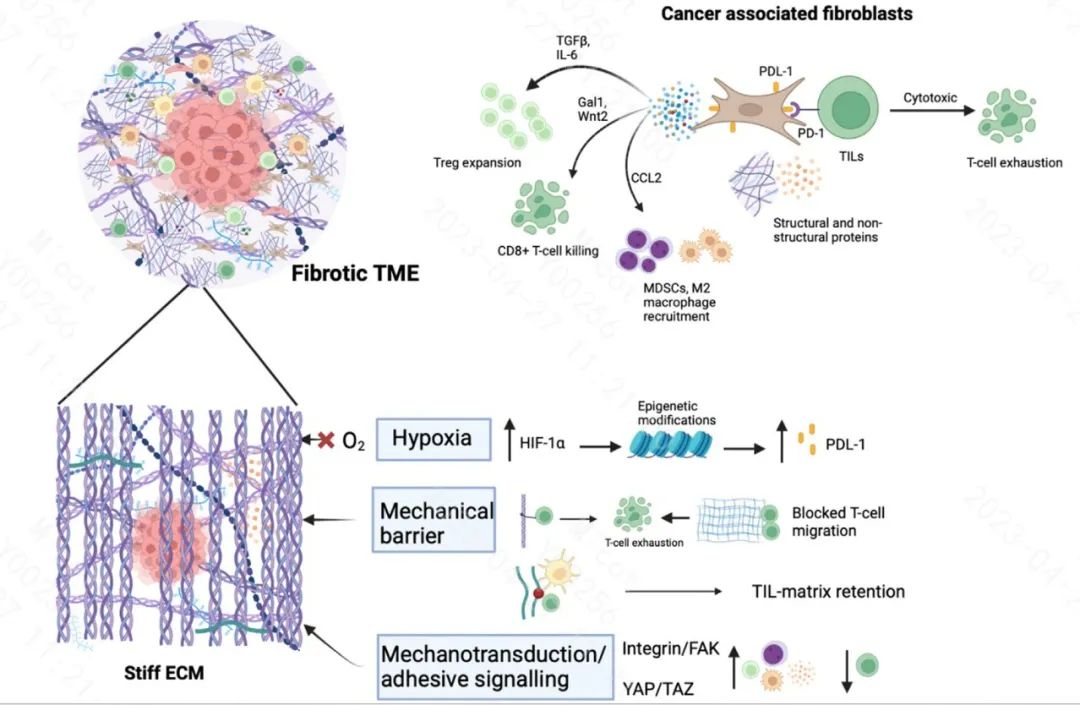
TME内的纤维化基质会产生坚硬的细胞外基质蛋白(ECM)传递强有力的信号,鼓励肿瘤细胞逃避任何免疫治疗的攻击。一些实体瘤类型,特别是与广泛的纤维化肿瘤间质相关的实体瘤类型对免疫疗法反应不佳,例如胰腺导管腺癌(PDAC)。炎症衍生慢性纤维化作为其易感因素的癌症,如肝细胞癌、乳腺癌,对免疫治疗的反应较弱。肿瘤相关纤维化由癌症相关成纤维细胞(CAFs)介导的ECM重塑,从而导致复杂和动态的基质变化。纤维化基质如胶原I和IV、纤连蛋白、层粘连蛋白、透明质酸、弹性蛋白和非结构基质细胞蛋白如CCN家族成员细胞通讯网络因子1(CCN1)和细胞通讯网络因子2(CCN2)、腱糖蛋白C(TNC)的过度沉积,导致基质重塑并随后释放蛋白酶,如金属蛋白酶(MMPs)和组织蛋白酶。此外,肿瘤相关免疫细胞也主要通过合成蛋白酶、细胞因子和一定程度上的ECM蛋白来参与纤维化基质的形成。这些纤维化基质通过多种机制阻碍免疫的效果。
纤维化肿瘤微环境
纤维化是由慢性炎症引起的,导致过度的组织重塑和修复。与正常伤口愈合类似,在肿瘤附近募集的组织驻留成纤维细胞通过TGF-β等细胞因子分化为肌成纤维细胞(⍺-SMA+,FAP+)表型。成纤维细胞被激活成为肌成纤维细胞,并产生过多的ECM成分,如I型胶原。这种由异常ECM硬化定义的组织重塑,由过度活跃的胶原交联酶介导,传递破坏器官正常生理功能的异常线索。换句话说,肿瘤不仅仅是一团转化的细胞,而且还具有纤维化的微环境。事实上,这种纤维化微环境是炎症的产物,不仅富含肌成纤维细胞和坚硬的ECM,而且具有高活性细胞因子和生长因子,它们共同决定了肿瘤对治疗反应的总体行为。
这些分化/激活的肌成纤维细胞被归类为CAF,积极产生纤维细胞外基质蛋白,如胶原蛋白,这些胶原蛋白使用赖氨酰羟化酶2(LH2)和赖氨酰氧化酶(LOXs)交联,产生硬基质。在PDAC中,LOX的mRNA表达增加对TME中CD8+T细胞的浸润产生负面影响。此外,TGF-β信号激活的CAFs还产生基质细胞蛋白,如CCN1、CCN2,以及各种生长因子,如VEGF、PDGF,这些生长因子被证明与抗肿瘤治疗耐药性有关。CAFs是最丰富的基质细胞,在与免疫细胞共存时,它们直接和间接影响肿瘤免疫相互作用。
肿瘤纤维化的类型
肿瘤纤维化反应可以分为2种类型:结缔组织增生(肿瘤周围)和肿瘤内纤维化。
一些实体瘤以纤维化为特征,表现出与病理性纤维化相似而又不同的纤维化特征。这种纤维化间质被称为结缔组织增生,是许多极恶性癌症的标志。它是由生长因子、趋化因子和细胞因子驱动的,这些细胞因子在肿瘤间质中沉积ECM蛋白。这种沉积是在基质细胞的帮助下完成的,例如癌症相关的成纤维细胞和肿瘤相关的巨噬细胞,这两种细胞在整个非恶性细胞库中占主导地位。众所周知,结缔组织增生是干扰药物渗透到肿瘤中的物理屏障。此外,促结缔组织增生性癌症,如BC、PDAC对免疫疗法提出了独特的临床挑战,因为过量的ECM沉积积极促进免疫抑制微环境。
肿瘤内纤维化是指存在于肿瘤边界内的纤维间质。它被视为一种组织学表现,影响肾细胞癌(RCC)、BC、肺癌、结直肠癌等纤维化实体瘤的预后。当肿瘤内的胶原以可区分的轮辐状模式排列时,称为纤维化病灶(FF)。纤维灶是胶原生物合成的一个位点,存在于被癌细胞包围的肿瘤中心。肿瘤内的这种纤维化区域代表了慢性伤口愈合反应,在许多实体瘤中与化疗耐药性有关。此外,肿瘤内纤维化被认为在肿瘤中施加机械力,肿瘤内的物理压力增加导致血管渗漏,最终阻碍治疗药物的输送——这是成功免疫治疗的另一个可能障碍。
另一种观察到的肿瘤内纤维化是“肿瘤基质轨道”,它将肿瘤细胞分离成聚集体或“巢”和叉指状基质。这些轨迹主要存在于早期肿瘤中,但随着肿瘤成熟也会保留,并参与肿瘤血管生成和转移。这些基质轨道在基底膜排列,由纤连蛋白、XII型胶原、TNC分子以及含有波形蛋白和SMA的成纤维细胞组成。
纤维化TME如何影响免疫治疗
在肿瘤相关纤维化中,细胞和非细胞成分作为一个整体或单独对免疫治疗剂进行累积干扰。
CAFs
CAFs是肿瘤微环境中存在的最丰富的基质细胞,间质内存在的CAFs表现出复杂的功能和表型异质性。CAFs在修饰免疫TME中的作用已有广泛研究,表达MHC-II的抗原递呈CAFs(apCAFs)直接将幼稚的CD4+T细胞诱导为Tregs,从而抑制细胞毒性CD8+T细胞的增殖。CAFs的免疫调节分泌,包括CXCL8-10、TGF-β、IL-6、IL-10等,调节先天免疫反应。此外,CAFs还通过诱导TME中TAM和MDSC的活性来促进免疫抑制。此外,CAFs还具有PD-L1等免疫检查点分子,诱导T细胞耗竭。
总之,CAFs通过多种机制干扰免疫疗法反应,最终导致免疫抑制微环境的形成。因此,CAFs也成为改善免疫疗法整体治疗反应的潜在靶点。
ECM
免疫疗法的治疗结果取决于T淋巴细胞能否成功浸润到肿瘤区域。ECM的结构,特别是高度交联的胶原基质,被认为与确定这些TIL迁移到肿瘤中的程度有关。例如,在PDAC中,具有高ECM的肿瘤细胞中T细胞浸润较少。最近使用3D培养技术显示,TIL的活性,特别是CD8+TIL的活性,很大程度上受三阴性乳腺癌(TNBC)肿瘤标本中胶原密度的影响。当使用赖氨酰氧化酶抑制剂攻击胶原交联时,它缓解了PDAC临床前肿瘤模型中的肿瘤硬化,改善了T细胞迁移和PD-1免疫治疗。
ECM介导的缺氧
肿瘤相关纤维化导致的硬化ECM在TME内及其周围产生缺氧条件。缺氧被证明是导致癌症进展、转移以及治疗失败的原因之一。在免疫疗法的背景下,缺氧与产生高度免疫抑制的微环境有关。
缺氧的主要标志物是缺氧诱导因子(HIF)-1⍺,当其稳定时可促进血管生成。缺氧作为一种整体现象,最近被证明与头颈部癌症对PD-1阻断免疫治疗的耐药性有关。一种理论是,HIF-1⍺直接上调PDL-1免疫检查点分子,从而干扰治疗效]。另一种理论是,HIF1⍺通过进行表观遗传学修饰来抑制效应T细胞和NK细胞的活性,从而调节抗肿瘤免疫疗法。
机械传递导致免疫功能障碍
在肿瘤中,坚硬的ECM功能不仅作为肿瘤细胞组织的支架,而且还提供激活各种免疫抑制途径的关键机械传递。最常见的激活途径通过整合素,整合素作为机械传感器,对CAFs、肿瘤和免疫细胞具有功能活性,主要介导粘附信号通路。在免疫治疗方面,整合素通过TGFβ-SOX4途径激活肿瘤免疫逃逸,限制T细胞介导的肿瘤杀伤。此外,在多种癌症中,活化的整合素TGF-β信号级联也与降低CD8+T细胞的肿瘤杀伤能力有关。
另一个因ECM硬度而被激活的重要信号轴是YAP/TAZ机械转导通路,也称为Hippo信号通路。活化YAP/TAZ的存在对免疫细胞,特别是T细胞的功能和活性有多种影响。在黑色素瘤中,YAP表达升高增强了Treg细胞的免疫抑制活性,也增加了PD-L1的表达。YAP还参与调节肿瘤微环境中效应T细胞、TMAs和MDSCs的功能。
小结
总的来说,整个纤维化反应直接和间接地影响了免疫疗法的治疗反应。纤维化反应的成分、肿瘤细胞和免疫细胞之间的相互作用是复杂的,并且相互关联。在任何情况下,肿瘤相关纤维化是否阻断细胞毒性免疫细胞的活性或增强免疫抑制调节免疫细胞的活动,是免疫治疗方案成功还是失败的最终决定因素。
参考文献:
1. Tumor-Associated Fibrosis Impairs the Response to Immunotherapy. Matrix Biol.2023 Apr 18;S0945-053X(23)00050-1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#免疫治疗# #纤维化# #肿瘤微环境#
76