指南更新 | 瑞波西利辅助治疗写入乳腺癌NCCN指南(2024.V5)
2024-10-18 e路新干线 e路新干线 发表于上海
2024年10月15日,乳腺癌NCCN指南更新至2024.V5,此次药物治疗更新的主要内容为HR阳性/HER2阴性乳腺癌辅助治疗新增瑞波西利推荐。

2024.V5-2024.10.15
乳腺癌
NCCN指南
2024年10月15日,乳腺癌NCCN指南更新至2024.V5,此次药物治疗更新的主要内容为HR阳性/HER2阴性乳腺癌辅助治疗新增瑞波西利推荐。详细更新内容如下:
01 更新内容
全身辅助治疗:HR阳性/HER2阴性疾病
pT1–3且pN0或pN+肿瘤绝经后患者
🔹中间路径,所有节点新增选项:考虑使用辅助阿贝西利或瑞波西利治疗符合条件的患者。参见BINV-K 2/3以获取适用标准
🔹底部路径,新增选项:特定患者可能适用于辅助阿贝西利或瑞波西利治疗和/或如果具有胚系BRCA1/2突变,可能适用于辅助奥拉帕利治疗。参见BINV-K 2/3和BINV-L以获取适用标准
🔹脚注kk移除:对于HR阳性/HER2阴性、高危乳腺癌患者,可以考虑使用2年辅助阿贝西利联合内分泌治疗的方案(参见(BINV-K)中的适用标准)。对于均适用于辅助奥拉帕利和阿贝西利治疗的患者,其最佳治疗选择和顺序尚不明确
🔹脚注oo修改:对于完成辅助化疗的具有胚系BRCA1/2突变的特定患者,加用1年辅助奥拉帕利治疗是一种选择。参见BINV-L。在适用于辅助奥拉帕利和阿贝西利或瑞波西利治疗的患者中,其最佳顺序尚不明确。(也适用于后续页面)

pT1–3且pN0肿瘤绝经前患者
🔹底部路径,新增选项:考虑使用辅助瑞波西利治疗符合条件的患者。参见BINV-K 2/3以获取适用标准

pT1–3且pN+肿瘤绝经前患者
🔹所有路径,新增选项:考虑使用辅助阿贝西利或瑞波西利治疗符合条件的患者。参见BINV-K 2/3以获取适用标准或参见BINV-K 2/3和BINV-L以获取适用标准

术前全身治疗后辅助全身治疗
🔹HR阳性/HER2阴性,ypT1-4,N0或ypN≥1路径修改:辅助内分泌治疗(1类)+如果具有胚系BRCA1/2突变CPS+EG评分≥3且具有残留病灶,辅助奥拉帕利治疗(1类)。参见BINV-L 1/9以获取适用标准。考虑使用辅助阿贝西利或瑞波西利治疗符合条件的患者。参见BINV-K 2/3以获取适用标准

放疗原则
放疗联合术前或辅助全身治疗
🔹条例修改:阿贝西利或瑞波西利应在手术/放疗/化疗完成后开始,同时进行内分泌治疗

辅助内分泌治疗原则
🔹名称修改:辅助内分泌±CDK4/6抑制剂治疗
🔹路径修改,以纳入考虑使用辅助阿贝西利治疗符合条件的患者,或考虑使用辅助阿贝西利或瑞波西利治疗符合条件的患者


02 新增依据
瑞波西利辅助治疗方案的新增基于一项全球多中心、随机对照、Ⅲ期研究(NATALEE研究;NCT03701334),该研究旨在评估瑞波西利+非甾体芳香化酶抑制剂(NSAI)vs. 单独NSAI辅助治疗Ⅱ期和Ⅲ期HR阳性/HER2阴性乳腺癌患者的疗效和安全性。
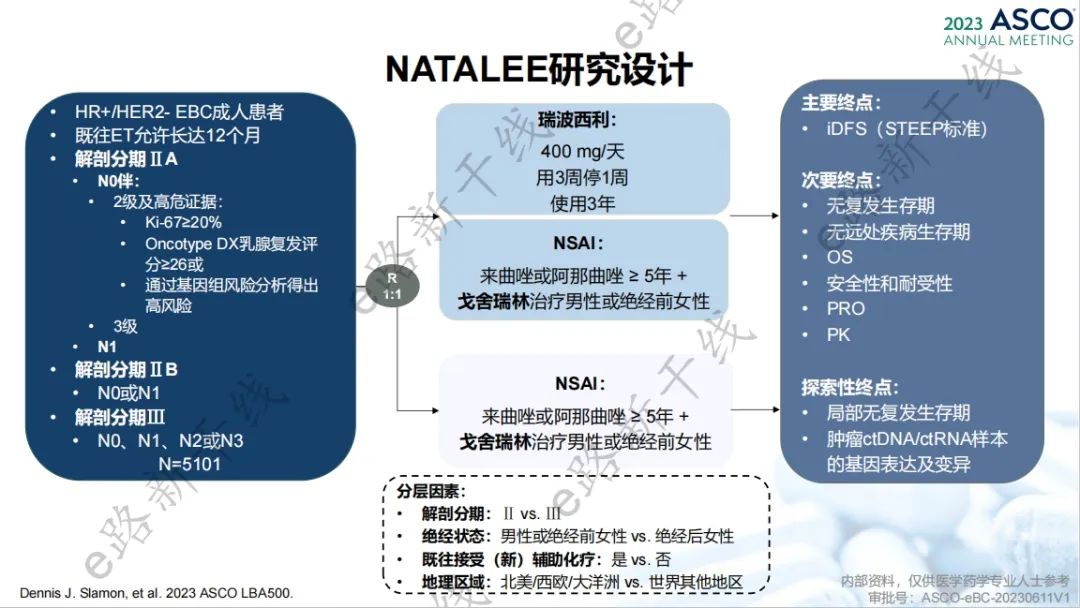
研究设计
2023年美国临床肿瘤学会(ASCO)年会报告了该研究第二次期中分析结果1,研究结果显示,中位随访27.7个月时,NATALEE研究达到了主要终点,与单独NSAI组相比,瑞波西利+NSAI组iDFS显示出具有统计学意义和临床意义的改善(3年iDFS率:90.4% vs. 87.1%,绝对获益率为3.3%),侵袭性疾病复发风险降低25.2%(HR,0.748;P=0.0014)。瑞波西利+NSAI组相比于单独NSAI组DDFS一致改善(3年DDFS率:90.8% vs. 88.6%;HR,0.739;P=0.0017),OS显示获益趋势(HR,0.759;P=0.0563)。
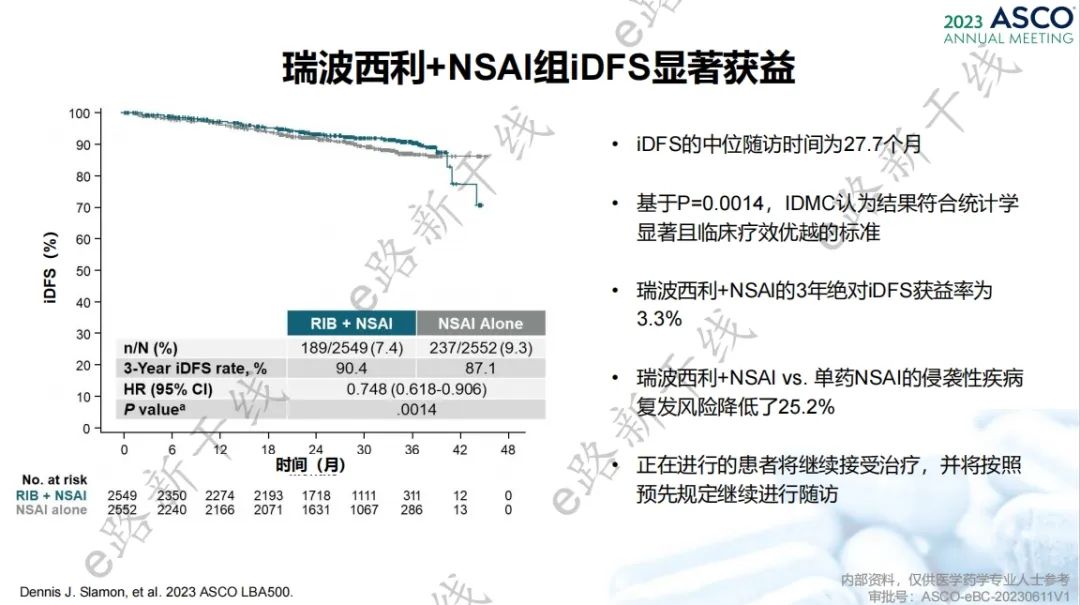
iDFS结果(第二次期中分析)

DDFS结果(第二次期中分析)

OS结果(第二次期中分析)
安全性方面,中性粒细胞减少症(62.1% vs. 4.5%)、关节痛(36.5% vs. 42.5%)和肝脏相关AE(25.4% vs. 10.6%)是瑞波西利+NSAI组和单独NSAI组最常见的任何级别AE,同时这些事件也是最常见的≥3级AE(发生率分别为43.8% vs. 0.8%、1.0% vs. 1.3%、8.3% vs. 1.5%)。瑞波西利+NSAI安全且耐受性良好。
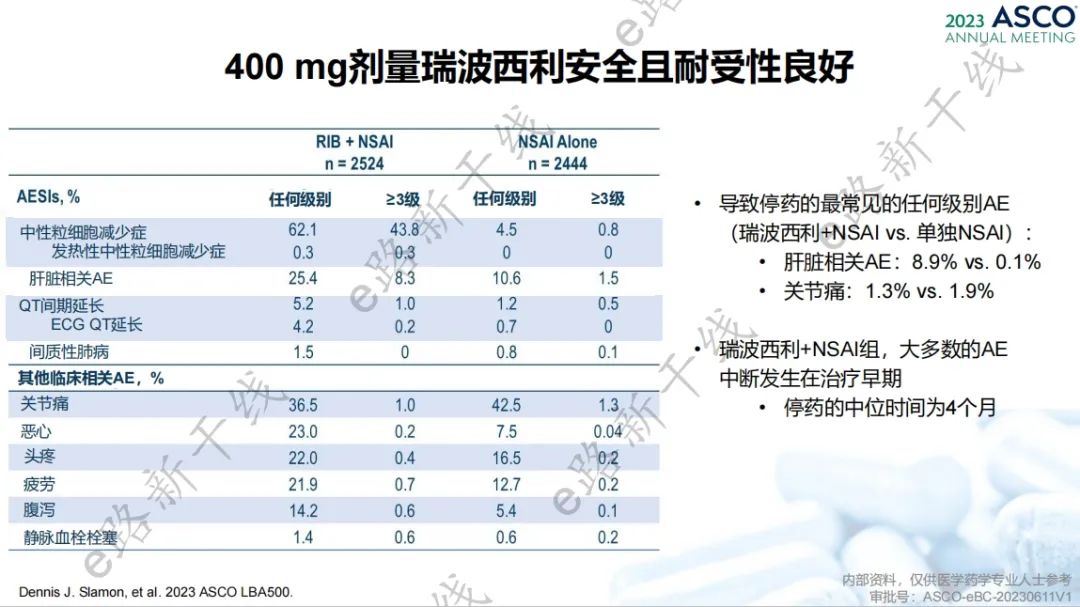
安全性结果(第二次期中分析)
以上结果于2024年3月刊登于《新英格兰医学杂志》2。
2023年圣安东尼奥乳腺癌研讨会(SABCS)报告了最终iDFS分析结果3,研究结果显示,中位随访33.3个月时,与单独NSAI组相比,瑞波西利+NSAI组iDFS继续显示出具有统计学意义和临床意义的改善(3年iDFS率:90.7% vs. 87.6%,绝对获益率为3.1%),侵袭性疾病复发风险降低25.1%(HR,0.749;名义P值=0.0006)。
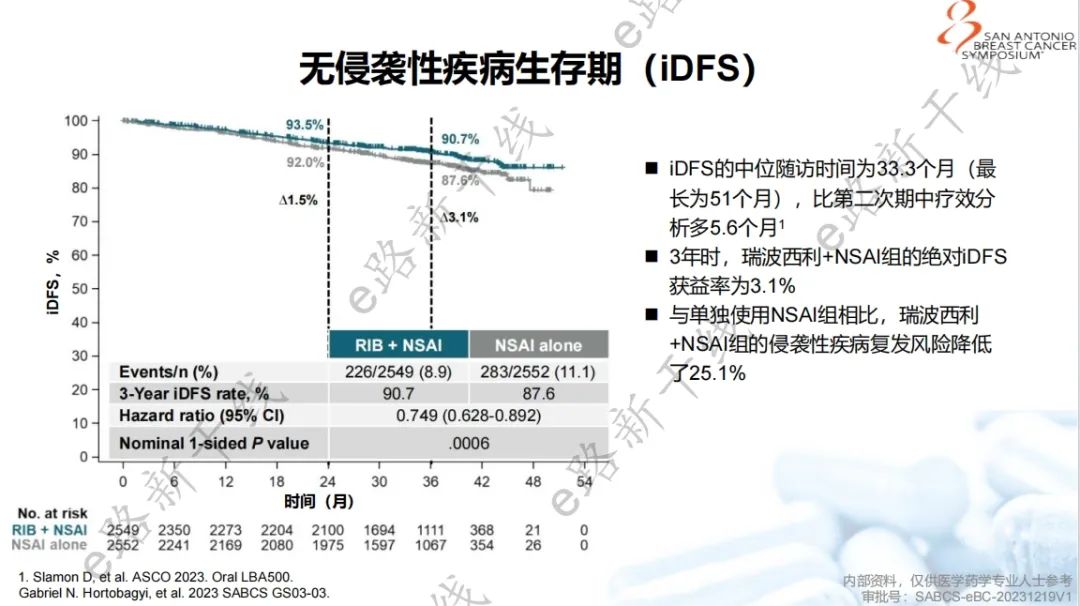
iDFS结果(最终iDFS分析)
Ⅱ期和Ⅲ期HR阳性/HER2阴性早期乳腺癌患者无论淋巴结是否受累均存在复发风险。2024年ASCO年会报告了NATALEE研究N0亚组疗效结果4,结果显示,与单独NSAI相比,瑞波西利+NSAI改善了iDFS(3年iDFS率:93.2% vs. 90.6%;HR,0.723),并且在DDFS和DRFS方面观察到一致获益。

N0亚组生存结果
2024年欧洲肿瘤内科学会(ESMO)年会报告了研究4年结局5,结果显示,中位随访44.2个月时,与单独NSAI组相比,瑞波西利+NSAI组iDFS获益进一步扩大(4年iDFS率:88.5% vs. 83.6%,绝对获益率为4.9%),侵袭性疾病复发风险降低28.5%(HR,0.715;名义P值<0.0001)。瑞波西利+NSAI继续改善DDFS(HR,0.715;名义P值<0.0001),并显示出OS的积极获益趋势(HR,0.827;名义P值=0.0766)。
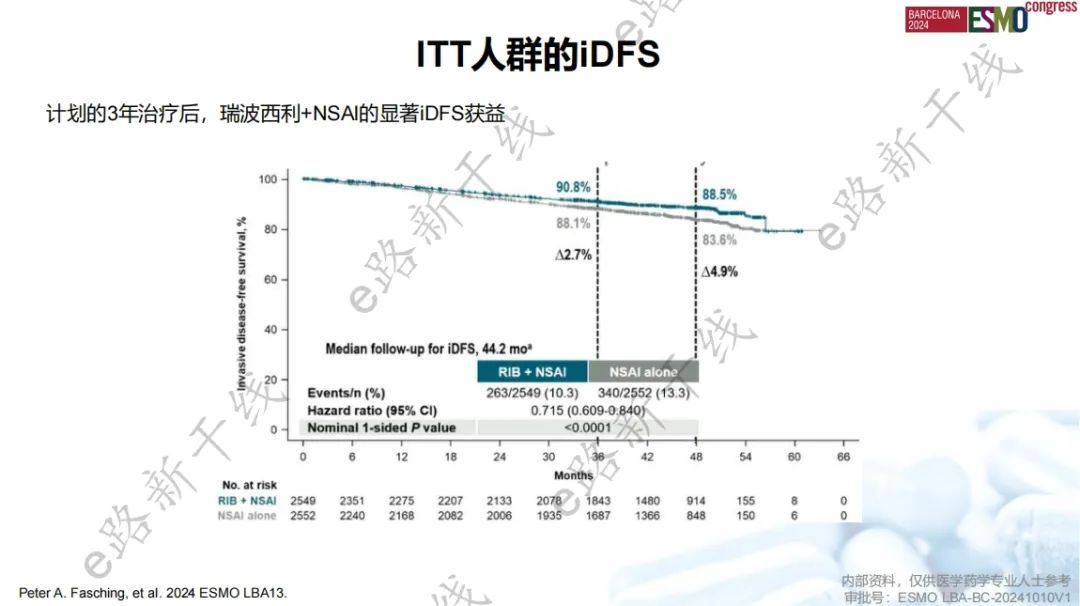
iDFS结果(4年landmark分析)
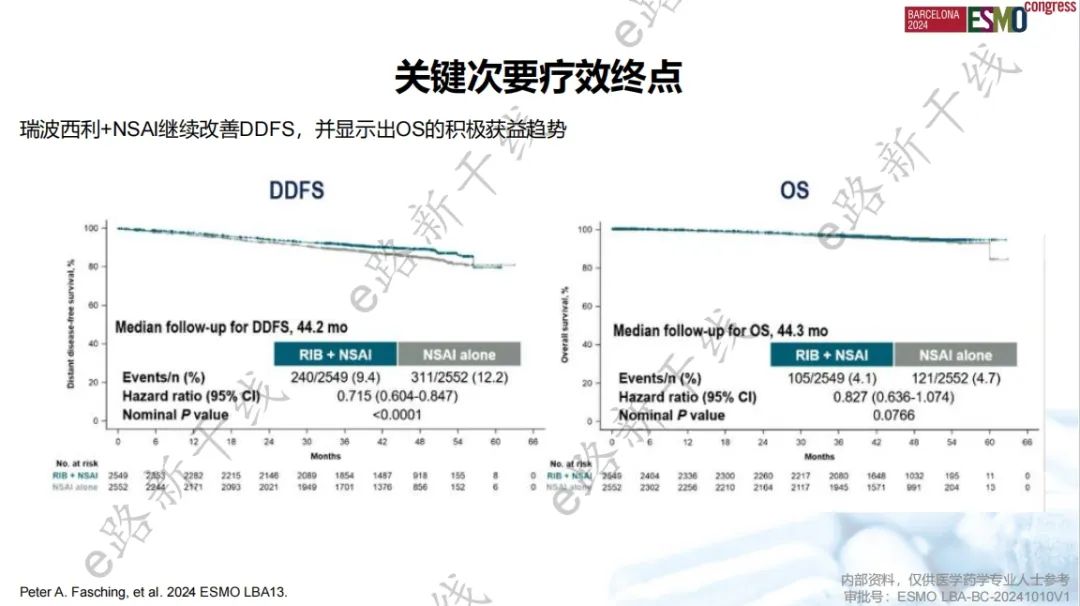
DDFS和OS结果(4年landmark分析)
2024年9月17日,基于NATALEE研究的积极结果,FDA批准了瑞波西利联合芳香化酶抑制剂用于HR阳性/HER2阴性Ⅱ期和Ⅲ期、具有高复发风险的早期乳腺癌成人患者的辅助治疗。

FDA关于瑞波西利联合芳香化酶抑制剂辅助治疗获批的公告
03 总结
CDK4/6抑制剂作为乳腺癌领域的创新靶向治疗药物,已经成为HR阳性/HER2阴性乳腺癌患者内分泌治疗联合用药的一个重要选择。近年来,CDK4/6抑制剂在HR阳性/HER2阴性早期乳腺癌辅助治疗领域的monarchE(阿贝西利)、NATALEE研究相继取得了积极的结果。不过monarchE研究入组患者更多为Ⅲ期且要求存在淋巴结转移,而NATALEE研究则纳入了更广泛的Ⅱ期和Ⅲ期患者,包括伴有高危因素的N0患者,为HR阳性/HER2阴性早期乳腺癌患者提供了iDFS、DDFS和OS等方面的生存获益。
参考文献:
1. Dennis J. Slamon, et al. 2023 ASCO LBA500.
2. Dennis J. Slamon, et al. N Engl J Med. 2024 Mar 21;390(12):1080-1091.
3. Gabriel N. Hortobagyi, et al. 2023 SABCS GS03-03.
4. Denise A. Yardley, et al. 2024 ASCO 512RO.
5. Peter A. Fasching, et al. 2024 ESMO LBA13.
6. NCCN指南:乳腺癌(2024.V5).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#乳腺癌# #瑞波西利#
21