【Haematologica】综述:MDS的诊断
2024-11-14 聊聊血液 聊聊血液 发表于江苏省
《Haematologica》近日发表综述,总结了目前针对疑似MDS患者的诊断方法所采取的步骤,提供了MDS诊断的步骤,还描述了利用无创诊断技术的新概念,尤其是数字方法以及外周血遗传学。
MDS的诊断
骨髓增生异常综合征(MDS)是一组异质性的克隆性骨髓(BM)干细胞髓系肿瘤,其特征为骨髓异常、大细胞性贫血或血细胞减少,且有白血病转化的倾向。MDS 患者通过多种评分系统之一进行分类,大多数患者为较低危(LR)或较高危(HR);虽然这些分类可能有助于诊断,但它们主要用于预后和指导治疗。MDS 的怀疑是由典型的但非特异性的临床表现和常规实验室检查所引起,但 诊断金标准仍是骨髓检查,包括存在单系或多系发育异常(dysplasia)及原始细胞比例,同时排除其他诱因。细胞遗传学也是诊断过程的一部分,流式细胞术和遗传学检查有助于诊断,但并非强制要求。
《Haematologica》近日发表综述,总结了目前针对疑似MDS患者的诊断方法所采取的步骤,提供了MDS诊断的步骤,还描述了利用无创诊断技术的新概念,尤其是数字方法以及外周血遗传学,随着这些方法的逐渐成熟并引入临床实践,或许会在部分情况下取代有创的骨髓活检。

由于MDS包含一组异质性疾病,其诊断过程基于临床和实验室特征的组合以及其他疾病的排除,不存在单一的特异性诊断检查,也没有明确的诊断标准。
哪些情况需要怀疑MDS
当出现适当的临床和实验室检查结果时,尤其是老年人,应怀疑MDS。MDS 的症状不具特异性,从无症状到虚弱和疲劳不等。由于常发现贫血(表 1a),可能会有心脏并发症,中性粒细胞计数降低可能与反复感染有关。如果患者血小板计数低或血小板功能不正常,可能会出现鼻出血、牙龈出血或容易瘀伤的情况。
需要仔细询问病史,必须首先排除其他可能导致贫血或其他血细胞减少的诱因,包括营养缺乏(叶酸和维生素 B12,尤其是对于素食者)、药物、酒精及烟草或病毒感染;患者的病史也可能会揭示其之前接受过放疗或化疗,或者家族中有患血液病的倾向。全面的病史有助于排除诸如阵发性睡眠性血红蛋白尿、再生障碍性贫血以及临床上可能类似MDS的骨髓增殖性肿瘤(MPN)等疾病。
体格检查通常无特异性,且无异常结果。详情见表 1b 。
实验室检查结果:表1c为MDS患者常见的实验室异常,但这些异常并非特异性。CRP和红细胞沉降率(ESR)可能升高。至少90%的MDS患者会出现贫血,其中约50%的患者血红蛋白(Hb)低于10g/dl。贫血通常为轻度大细胞性,伴红细胞分布宽度(RDW)扩大。与溶血性贫血患者不同,MDS患者通常不会出现网织红细胞计数增加。其他实验室检查结果见表1c。
除非伴有贫血的共病,否则血清化学指标通常为正常。在铁粒幼红细胞型中,血清铁、铁饱和度和血清铁蛋白可能升高。排除营养缺乏很重要,尤其是叶酸和维生素 B12缺乏,这两种缺乏都会导致大细胞性贫血。血液化学指标还可以排除潜在的肝脏或肾脏疾病。此外必须排除乙型和丙型肝炎、巨细胞病毒、艾滋病毒和细小病毒 B19 感染。
外周血(PB)涂片通常不具特异性,但可能会有与疾病相符的发现。例如,红细胞(RBC)可能大小不均或畸形,有时可能会存在有核红细胞。白白细胞可出现未成熟髓样细胞(“左移”)数量增加,伴hypolobulation(“Pelger”样细胞)和hypogranulation。外周血血小板可能会变形、聚集、增大(巨血小板),此外数量可能较少。持续性单核细胞增多提示慢性粒单核细胞白血病(CMML),前提是已排除单核细胞增多的其他诱因。外周血涂片尤其有帮助,因为它可能发现MDS之外的其他疾病,或在MDS的基础上发现其他疾病。例如血小板增多或白细胞增多可提示MPN,或者至少是MDS/MPN。
总之结合症状和实验室检查结果,再加上排除其他导致贫血/血细胞减少的诱因,可提高对MDS的怀疑(表1a、c),但确诊 MDS 还需要其他手段。
骨髓检查——诊断MDS的金标准
不明原因的贫血(或血细胞减少)的下一步检查是骨髓(BM)检查,其仍是诊断MDS的金标准(表1d)。
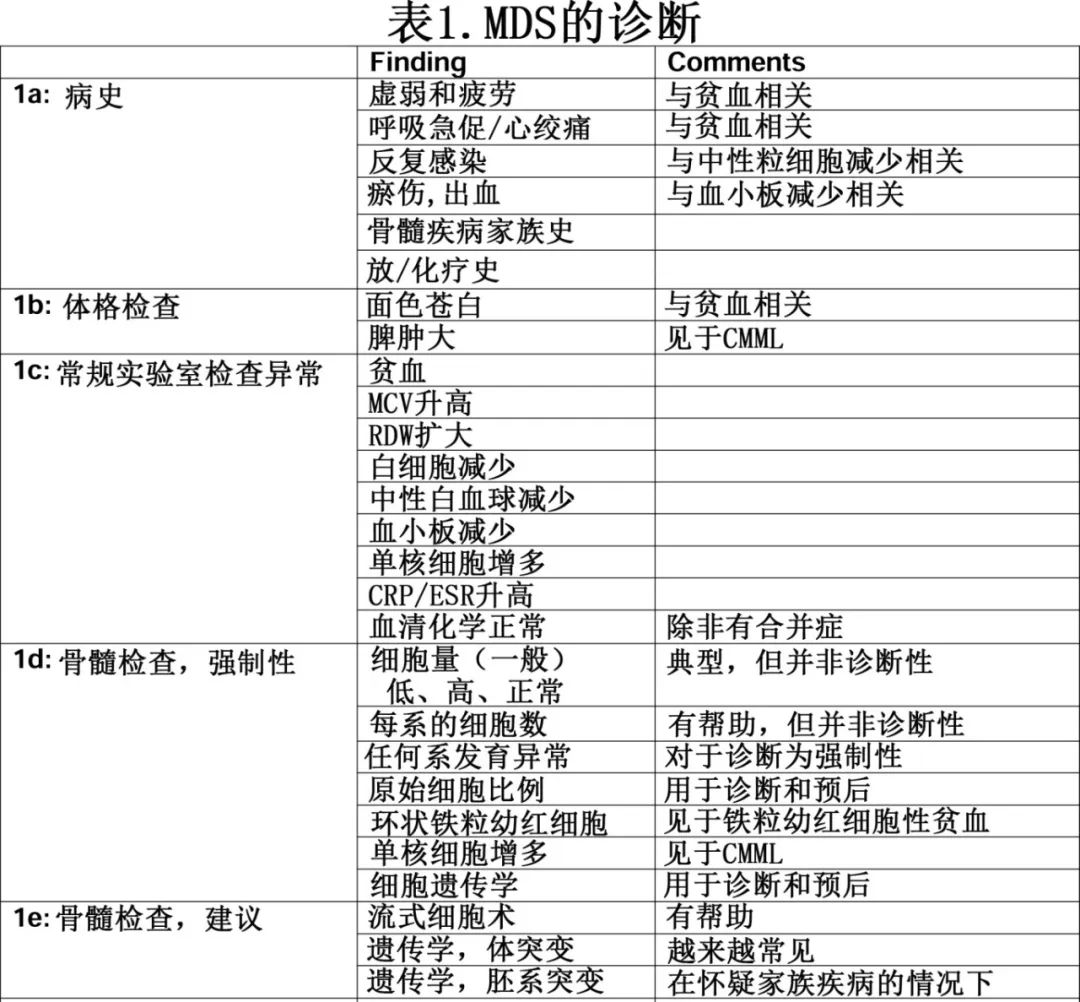
骨髓穿刺:骨髓穿刺(May-Grunwald-Giemsa 染色)对于评估单个细胞的形态至关重要。骨髓穿刺中的MDS典型发现包括任何谱系的发育不良以及可能的高增生(hyperplasia)或低增生(hypoplasia)。但细胞量(cellularity)最好用活检来评估。原始细胞可能有颗粒或奥瑞氏小体,它们会被计数并报告为有核骨髓细胞的比例。图片也会进行铁染色(普鲁士蓝染色)以评估环状铁粒幼红细胞(RS)的存在。骨髓穿刺也是排除 MDS 及确立其他血液系统疾病诊断的特殊检测的基础。下图为 MDS 中骨髓异常的图片。
骨髓环钻活检:骨髓活检对于评估骨髓细胞及其微环境非常重要,也可以更准确地评估细胞量(Cellularity),尽管该参数对MDS的诊断或预后并不重要。骨髓活检还可能发现纤维化,其在伴有骨髓纤维化的 MDS 中可见,即 MDS-f亚型(WHO标准)。但骨髓活检在评估单个细胞的形态学或评估原始细胞计数方面不如骨髓穿刺可靠。重要的是,骨髓组织学检查可提示非造血恶性肿瘤的转移性疾病,以及提示结节病或感染过程的肉芽肿。
总之,骨髓检查,尤其是发育异常特征和原始细胞比例,对于确诊MDS必不可少。此外一旦确诊,这些骨髓检查结果(尤其是原始细胞比例)还有助于根据各种分类对患者的预后进行分类和预测。最后,原始细胞比例可区分HR-MDS和急性白血病,但两者之间的界限最近变得模糊,因为根据基因特征,急性白血病的原始细胞计数可能在 10%至 30%之间才可确诊。
尽管在 2024 年,骨髓形态学和特异性染色仍是诊断MDS的金标准,但该诊断方法也存在一些局限性。它具有主观性,取决于解读的人员(血液学家/病理学家)。此外,由于骨髓并非在整个样本中均一,诊断的质量取决于骨髓的采样位置(采样误差)。因此,必须从骨髓检查中收集额外的数据,包括流式细胞术、细胞遗传学和遗传学。此外,越来越多的证据表明外周血可用于 MDS 的诊断。
多参数流式细胞术
骨髓多参数流式细胞术(MFC)有助于优化和完善髓系肿瘤的诊断和分类,MFC 能够评估与正常情况不同的分化抗原特征,其体现在细胞亚群的分布改变或抗原表达水平改变上。异常的抗原表达包括过度或不足表达、表达的获得或缺失、谱系失真(lineage infidelity)、分化标志物的不同步表达。专注于MDS中 MFC 标准化的国际和欧洲白血病网络工作组(iMDSFlow)近期发表了多篇综述和指南。
MDS诊断中最重要的标志物包括CD45、CD34、HLA-DR、CD117、CD13、CD33、CD10、CD11b、CD16、CD15、CD14、CD64、CD123、CD7、CD19、CD56 和 CD71,以及光散(light scatter)特性,即前向散射和侧向散射光(forward scatter and side scatter,SSC)(见表 2)。对髓系和单核细胞谱系的分析包括髓系祖细胞(MyPC)、中性粒细胞和单核细胞,MyPC的比例是骨髓和/或外周血样本MFC评估中的诊断参数之一。在 MDS 中,MyPC通常占总有核骨髓细胞的比例超过 2%。通过 MFC 检测,MyPC细胞超过 3%的cutoff水平极为重要,高于3%则多为MDS或MDS/MPN。
MDS粒细胞的一个关键特征为颗粒减少(hypogranulation),表现为SSC降低。从MyPC向中性核分叶粒细胞(segmented neutrophils)的成熟过程可以通过 HLA-DR、CD117、CD13、CD11b 和 CD16 的表达水平来追踪,从而区分异常和紊乱的中性粒细胞分化。MDS的中性粒细胞可能会异常表达 CD14、CD56 和 CD71 等标志物;中性粒细胞上 CD56 的表达往往与单核细胞上的一致。由于这些细胞中的发育异常难以通过形态学来识别,因此对MDS和MDS/MPN中单核细胞系的单核细胞功能分析可能有较大帮助。CD11b 和 HLA-DR 抗体组合,或者 CD14 或 CD300e 与 CD36 和/或 CD64 的组合有助于区分单核细胞的不成熟和成熟阶段。由于存在阵发性睡眠性血红蛋白尿(PNH)克隆,CD14 可能会(部分)缺失。单核细胞的异常也可能涉及 CD13 的均匀增加或缺失以及 CD2 和 CD56 的存在。在CMML中,对于单核细胞数量超过 1.109/L的患者,将外周血CD14+CD16-细胞经典型单核细胞≥94%作为诊断标准;该标准可能会受到炎症状况的影响,这种情况下,非经典型核细胞(CD14dimCD16+)或 slan+单核细胞的比例分别低于 2.5%和 1.7%可能仍提示CMML的诊断。骨髓中的单核细胞亚群通常与血液中相似,但只有血液中的结果才视为具有诊断意义。红系细胞是根据其 CD45neg-to-dim、低/中等 SSC 特征以及缺乏髓系标志物而选择的。在MDS中,红系发育异常可能是有核红细胞数量增加、红系分化阶段比例异常以及 CD36、CD71 和 CD105 表达水平改变。在伴有环状铁粒幼红细胞的 MDS 中,最常观察到红系干细胞增加。通过MFC评估巨核细胞系发育异常的意义有限,因为巨核细胞太大且太不常见,难以进行可靠的分析。
四参数流式诊断评分也称Ogata评分,是为MDS的MFC检测而设计的,由四个参数组成:CD34+髓系祖细胞比例≥2%、B祖细胞占CD34+细胞比例≤5%、CD34+髓系祖细胞CD45/Ly CD45(≤4.5或≥7)、粒系SSC/Ly SSC≤6;每一个异常积分为1,≥2诊断为MDS;特异性和敏感性分别约为93%和70%。在MyPC上增加CD7和/或CD56的表达,和/或在单核细胞上增加CD56的表达,可能会增加灵敏度,而特异性保持相似。综合流式评分(iFS)将Ogata评分与未成熟和成熟髓系细胞的MFC异常以及未成熟和成熟红系细胞的异常结合起来,进一步提高MDS的诊断效用。该模型分为三个评分,即A、B或C,分别代表无MFC异常、不足以考虑为MDS的最小MFC异常伴MDS异常。iFS是迄今为止最灵敏和特异的诊断评分模型。近期一项iMDSFlow多中心研究显示,对MDS诊断最有信息价值的异常包括:i) MyPC比例异常,CD45、CD117、HLA-DR 表达水平异常,CD13 表达异常,以及 CD5、CD7 和/或 CD56 表达异常;ii)粒细胞比例异常(对比淋巴细胞),SSC、CD33 低表达以及 CD13/CD16 模式;iii) 单核细胞比例异常,SSC、CD13 和 CD56 表达以及 HLA-DR/CD11b 比值;iv) 红系细胞中 CD71 表达异常。其中≥3项或异常与MDS的诊断相关。
在MDS的诊断报告中报告MFC的结果应以综合诊断报告的形式进行。iMDSFlow 小组提供了一种算法,用于对提示髓系肿瘤的血细胞减少症患者进行检查,该算法易于在日常实验室实践中实施。在未决病例中,或者在涂片质量差的情况下,将骨髓细胞学结果与细胞形态学相结合,可以支持对MDS的诊断,并建议进行全面的临床随访。
细胞遗传学:细胞遗传学是通过 G 显带和 FISH 技术相结合来进行的,虽然它可能不是诊断MDS所必需的,但不进行该检查就无法完成诊断(表 1d),应至少检查 20细胞的中期分裂象。应用细胞遗传学以及典型染色体异常有助于诊断。MDS 常见的细胞遗传学发现为 5 号和 7 号染色体部分或完全缺失,以及 8 号染色体三体性。细胞遗传学在预测预后方面更为重要。在 2016 年WHS对 MDS 的分类中,细胞遗传学的应用对于诊断至关重要,尤其是在根本未观察到发育异常、所有细胞系中的发育异常少于 10%或结果不明确的情况下。这类患者随后被视为无法分类的MDS患者,而在当前的分类系统中已被意义未明的克隆性血细胞减少症(CCUS)所取代,但原则是相同的。
遗传学:在过去几十年中人们逐渐认识到,与其他恶性肿瘤一样,基因突变是MDS中恶性克隆发展的罪魁祸首,这些基因特征控制着疾病的进程(表1e)。90%的MDS患者存在髓系突变,平均每例患者在MDS诊断时存在2-3个突变。MDS中有许多基因突变,但至少有7个基因与超过10%的MDS患者有关:SF3B1、TET2、SRSF2、ASXL1、DNMT3A、RUNX1和TP53。与其他血液系统肿瘤(如慢性髓性白血病或慢性淋巴细胞白血病)相比,将遗传学应用于临床实践(诊断和预后)仍处于起步阶段。有几个棘手的障碍仍然阻碍着广泛的遗传学应用。并非所有的突变都是平等的,有些驱动突变具有更大的临床重要性,而其他突变只是乘客(passengers)突变。变异等位基因频率(VAF)和突变热点似乎很重要,而突变的功能以及共突变和基因-基因相互作用的发生机制仍未完全阐明。
在某些情况下,基因特征在诊断中非常重要。例如,SF3B1 基因突变可确定伴有环状铁粒幼红细胞的MDS。此外,NPM1 或 FLT3 基因突变可将急性髓系白血病(AML)与 MDS 区分开来。近期关于 MDS 分类学的工作可能会进一步描述 MDS 亚组及其与特定基因特征的相关性。
在大多数其他情况下,尚未发现任何突变是MDS所独有的或具有诊断性的。此外,这些突变也出现在健康的老年人中,而他们中的大多数永远不会发展成髓系肿瘤,该现象称为年龄相关性克隆性造血(ARCH)或潜能未定的克隆性造血(CHIP)。值得注意的是,在 CHIP 中,常见的突变基因为 DNMT3A、TET2 和 ASXL1,而剪接基因(SF3B1、SRSF2、U2AF1)的突变在 CHIP 中不太常见。
MDS中的胚系突变是一个相对较新的领域。直到几年前业内还认为胚系突变是儿童问题,但现在人们认识到,一些此类突变(例如 DDX41、RUNX1、ANKRD26、ETV6、GATA2)可能导致一种只有在成年后才发现的临床表型,例如伴 DDX41 的MDS患者的中位年龄约为 65 岁。现在面临的挑战在于如何检测到这些个体,如何跟踪和管理他们,最重要的是要筛查哪些家庭成员。
总之,遗传学在诊断以及发病机制和预后方面的作用不容小觑,但2024 年仍处于这个时代的开端,尽管基因图谱在世界许多地区已常规开展,但在诊断工作中仍非强制性。二代测序(NGS)的成本逐渐下降,但并非所有人都能负担得起;该问题以及具备进行此类分析专业技能的人员相对稀缺进一步阻碍了其广泛应用。
应当指出的是,MDS中发现的部分突变已经成为治疗的靶点和治疗反应的标志物。例如,针对突变型 TP53 的 APR-246,IDH1/2 抑制剂,以及针对 SF3B1 突变患者的罗特西普。
关于遗传学和MDS的更多详细信息可参考综述(Cazzola M, Malcovati L. Genome Sequencing in the Management of Myelodysplastic Syndromes and Related Disorders. Haematologica)。
MDS前驱状态
多项证据表明,MDS是随着时间推移而发展的,恶性克隆在临床疾病诊断之前就已演变。在健康个体中出现髓系突变且进一步发展为髓系疾病(尤其是 MDS)的倾向较高,这进一步支持了该概念。与其他血液系统肿瘤(如多发性骨髓瘤与意义未明的单克隆丙种病和慢性淋巴细胞白血病与单克隆B淋巴细胞增多症)一样,MDS也有前驱状态,包括意义未明的特发性血细胞减少症(ICUS),其中许多患者最终被归类为意义未明的克隆性血细胞减少症(CCUS)。CCUS 的特征为学细胞减少症,病因不明,且不符合确诊MDS的最低标准。CCUS 中存在克隆性髓系突变,与ARCH和CHIP有部分重叠,但仍无法定义为 MDS。此外还可能存在意义未明的特发性血细胞发育不良(IDUS),以及无血细胞减少症的骨髓克隆性改变。
诊断这些MDS前驱状态是有意义的。尽管目前尚无治疗干预措施,但可以预见未来无创性生物技术将进入临床。建立MDS前驱状态的诊断和风险分层需要进行基因检查,包括鉴定胚系突变,但也不能忽视该检测所涉及的社会、伦理和经济方面的考虑因素。
诊断MDS的新方法(以及避免骨髓检查)
骨髓形态学仍是诊断MDS的金标准,包括形态学和原始细胞比例在内的信息目前无法被任何其他检查所取代,但它们也存在显著的局限性。这种检查具有侵入性和疼痛性,而且形态学评估在一定程度上为主观性,观察者之间的差异较大。有时骨髓穿刺液为“干抽”,只能评估活检样本,有时需要再次尝试。出于所有这些原因,在不降低诊断准确性的前提下,替代骨髓评估的诊断方法是当务之急。目前,尽管新兴方法很有前景,但这些技术仍为研究性的,例如:1)利用容易获取的患者数据进行建模,2)对外周血涂片进行自动形态学评估,3)从外周血获取的遗传信息。它们仍处于研究阶段,并非标准诊断手段,但很可能会减少甚至消除许多患者对骨髓评估的需求。
总结
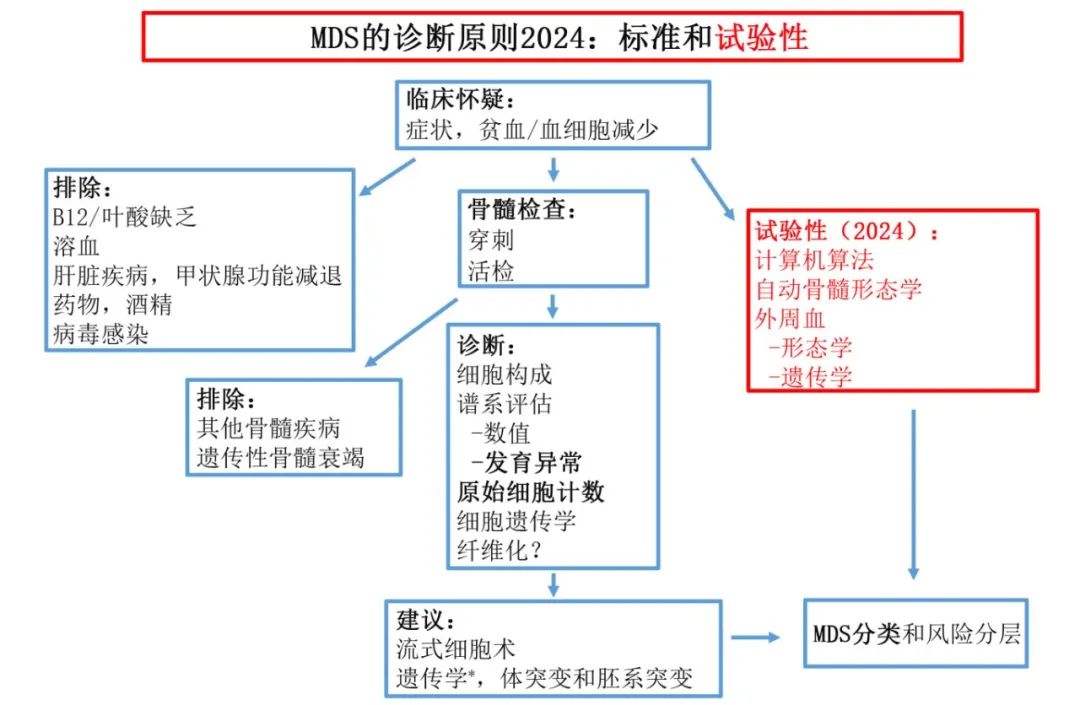
为了确诊MDS,某些检查是强制性的,尤其是骨髓检查(穿刺和/或活检),以确定是否存在一个或多个细胞系的发育异常。原始细胞计数也很重要,以及排除导致贫血/血细胞减少的其他原因。细胞遗传学也是诊断过程中必不可少的一部分。可疑的临床表现、大细胞性贫血(或血细胞减少)、外周血异常、骨髓环状铁粒幼红细胞、特征性流式细胞术及髓系体细胞突变和其他基因检测均有助于且推荐用于MDS的诊断,但它们并非诊断的关键。下图总结了诊断MDS所需(和推荐)的步骤,并总结了检测手段。在未来不久的将来,无创技术如诊断建模、数字计算分析和全基因组测序(单独或结合使用)很可能会成为MDS诊断的常规做法。
参考文献
Howard S. Oster, Arjan A. van de Loosdrecht, and Moshe Mittelman.Diagnosis of myelodysplastic syndromes: the classic and the novel.Haematologica. 2024 Oct 24. doi: 10.3324/haematol.2023.284937
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





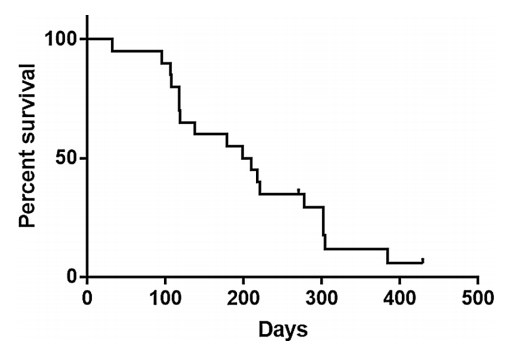











#MDS# #骨髓增生异常综合征#
0