【Leukemia】在大样本MDS中验证原始细胞计数的独立预后性能
2024-08-15 聊聊血液 聊聊血液 发表于上海
《Leukemia》近日发表研究,作者通过在独立的患者队列中确定基于遗传的MLLclass是否优于IPSS-M,旨在评估MDS病例中原始细胞量化的必要性。
MDS中原始细胞计数
骨髓增生异常综合征(MDS)是一种异质性的血液系统恶性肿瘤,从历史上看,原始细胞计数在MDS亚型中具有重要意义,常规细胞形态学是金标准。对于French-American-British和世界卫生组织(WHO)血液恶性肿瘤分类的第3版和第4版,原始细胞百分比是MDS分类的组成部分,并且原始细胞百分比是纳入初始和修订的国际预后评分系统(IPSS)的变量之一,临床上用于将MDS患者分为不同的风险组。
随着相对低成本的高通量测序技术的出现,MDS的突变检测已纳入临床实践。包含突变数据的更新IPSS模型(IPSS-M)进一步完善了IPSS模式,在其风险模型中保留了原始细胞百分比,但作为连续而非分类风险变量。
最近提出了完全独立于原始细胞细胞计数的、基于遗传学的MDS分类,例如遗传学分层系统(以下简称MLLclass)的研究证实原始细胞百分比对总生存率不再具有显著性,因此提出在具有遗传学特征的病例中,不再需要对原始细胞进行量化。此外与原始细胞计数相关的挑战有很多,包括准确性、可重复性、观察者之间的可变性以及与标本质量和血液稀释相关的限制,而基于较少主观因素(如突变谱)的MDS分类可能更具有临床意义。
《Leukemia》近日发表研究,作者通过在独立的患者队列中确定基于遗传的MLLclass是否优于IPSS-M,旨在评估MDS病例中原始细胞量化的必要性。

研究结果
研究纳入具有二代测序(NGS)数据的377例MDS患者,使用现行的WHO5和ICC标准对患者进行重新分类,然后应用IPSS-M和MLLclass分层,并评估它们与总生存期的关系。使用两种病理分类以及 IPSS-M 和 MLLclass模型的患者人口统计学信息和分类的特征如下。使用所有四种分类系统检测到与总生存期显著相关,在单因素分析中,原始细胞百分比作为连续风险变量和使用传统原始细胞类别时均与结局高度相关。
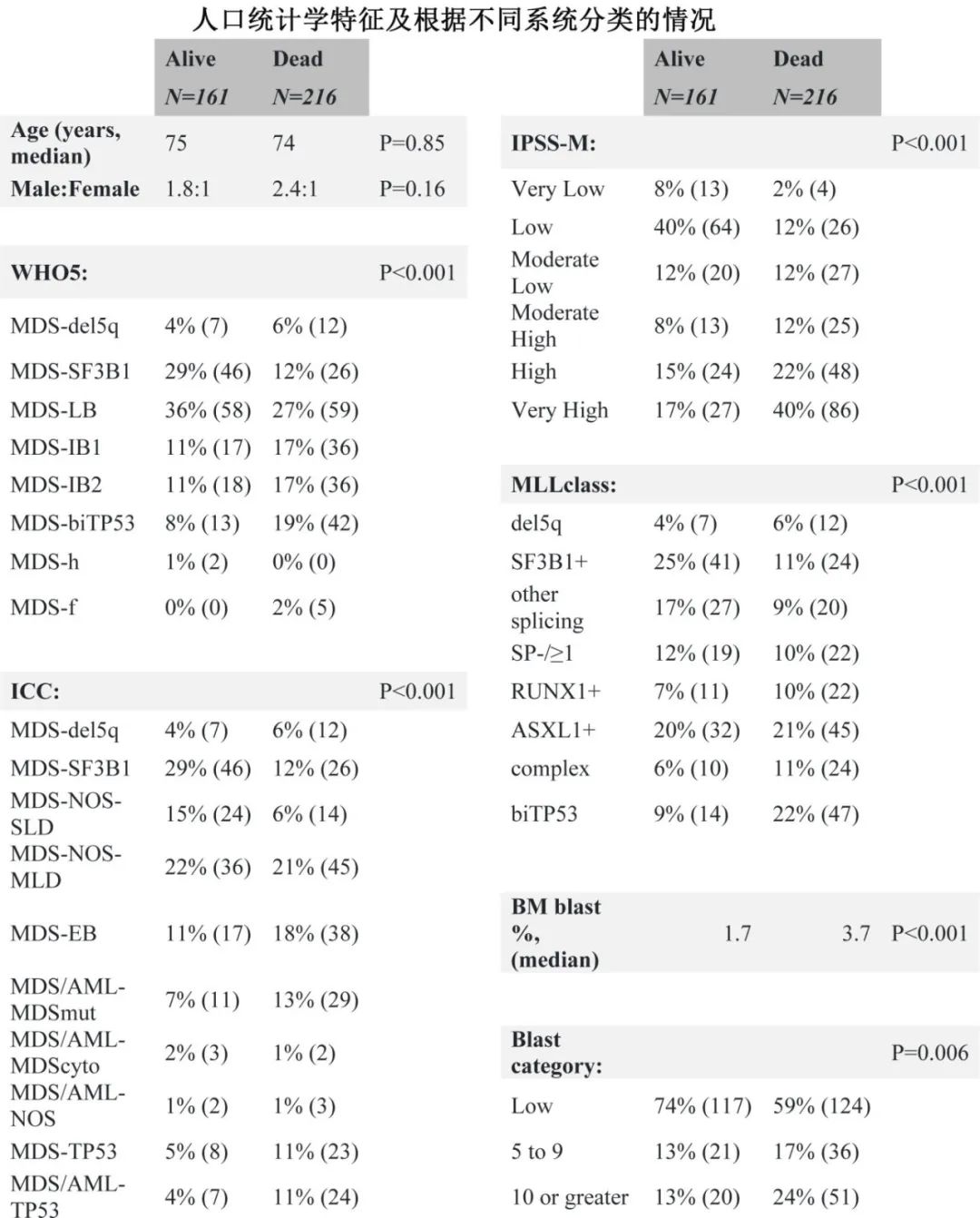
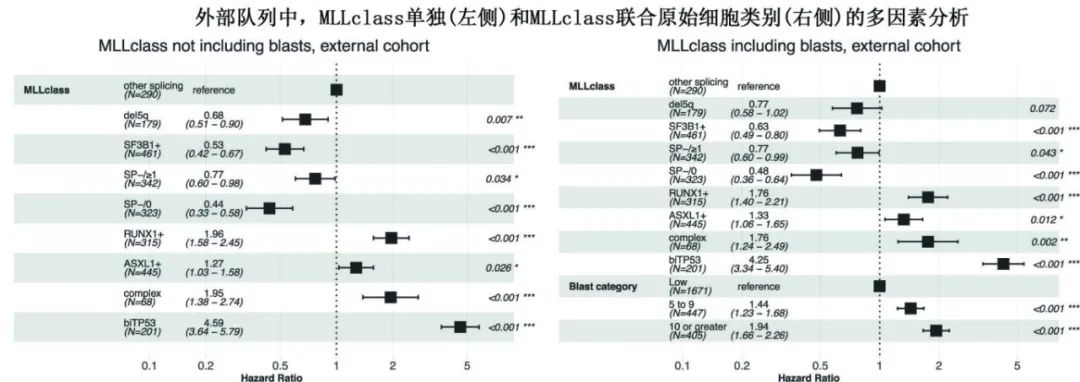
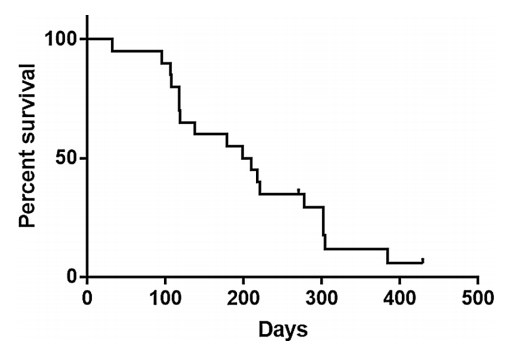
Kaplan-Meier 曲线证明, SF3B1突变患者具有相对有利的生存率,而双等位基因 TP53 失活患者临床结局较差。进一步比较 MLLclass 和 IPSS-M 模型的生存曲线发现,虽然两者均与总生存期相关,但 IPSS-M 模型表现出更清晰的组间分离,与 MLL class相比,Harrell一致性指数更优,为0.72 vs.0.66。
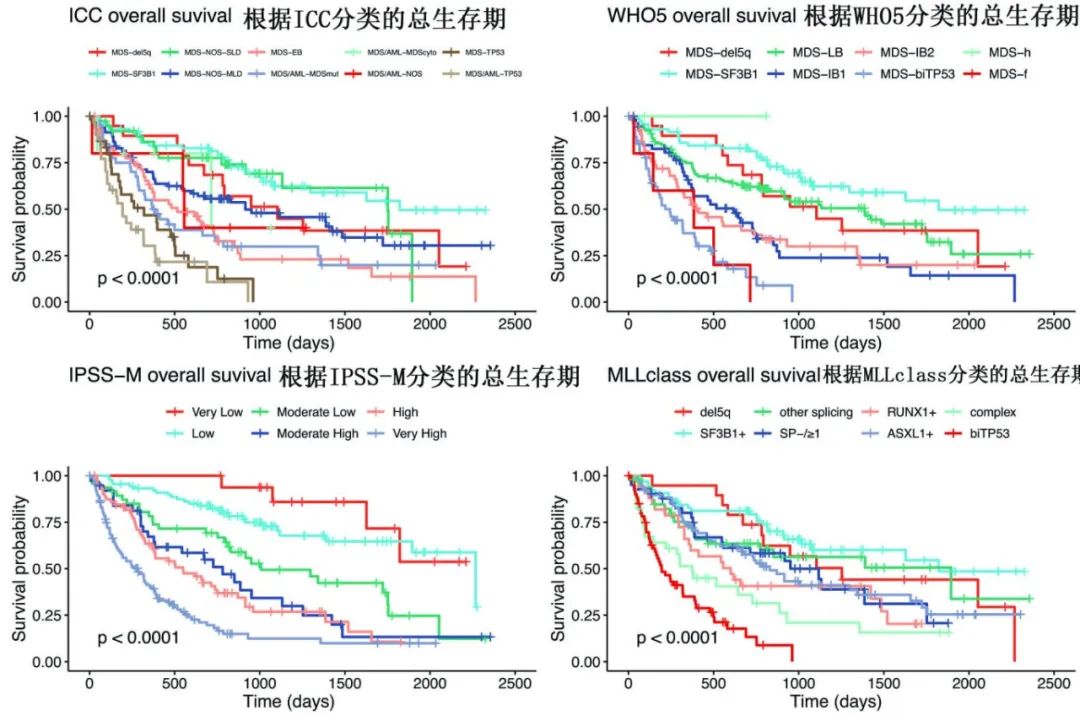
为了更好地理解IPSS-M相对于MLLclass的优越性能是否至少部分归因于IPSS-M模型中包含的原始细胞百分比(该模型还包括血红蛋白浓度、血小板计数和MLLclass未考虑的细胞遗传学异常),进一步在内部队列中评估了在多因素分析中加入MLLclass后,原始细胞是否仍保持独立显著性。使用Cox比例风险模型,在多因素分析中,当患者根据MLLclass分类时,原始细胞≥10%与的风险比增加相关(1.58,P=0.014);原始细胞在5%至9%之间未达到统计学意义,但也显示出风险比升高的趋势。
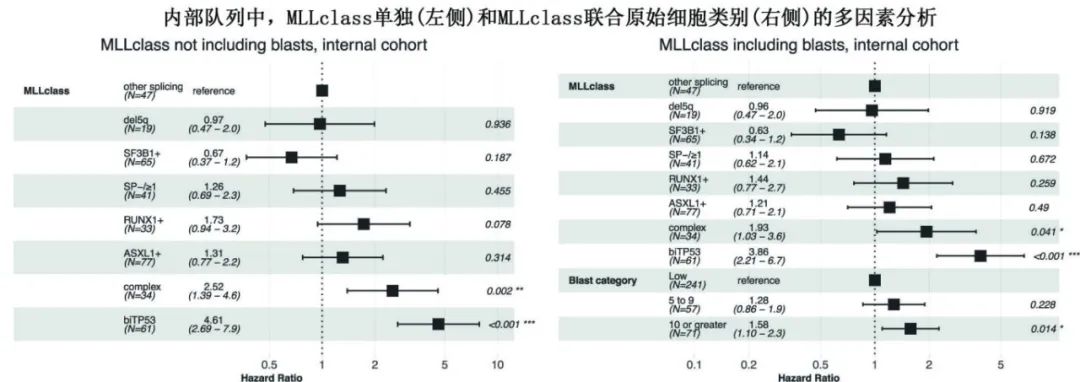
为证实和扩展该研究结果,将MLLclass应用于大型公开可用的IPSS-M数据集(含2624例MDS患者),并评估了在将MLLclass应用于该数据集后,原始百分比是否可为外部队列提供附加的预后信息。该大型外部队列与内部队列结果一样,在包括MLLclass在内的多因素分析中,原始细胞增加仍与结局显著相关。并且该数据集足够大,可以清楚地表明,原始细胞5-9%与不良结局显著相关。
此外将原始细胞百分比视为连续变量时,在多因素分析中,内部和外部队列中原始细胞百分比均与生存期显著相关。

总结
该研究强调,即使考虑遗传信息,目前仍需要继续将原始细胞量化纳入MDS的分类中。MDS患者的骨髓原始细胞百分比可能反映出遗传学和表观遗传学变化的积累,而目前的测序panel并未完全捕捉到这些变化。然而,在某些MDS遗传亚型(如TP53失活亚型)中,考虑到这些患者在当前治疗方案下的基准结局非常差,原始细胞细胞百分比的实际重要性可能极低。
事实上,临床实践中原始细胞的准确定量仍存在非常现实的问题,继续探索更准确的定量方法也很重要。此外,虽然该研究表明在基于人群的研究中原始细胞分类阈值仍然很重要,但当原始细胞百分比接近这些阈值时,精确确定单个患者的原始细胞类别实际上是不可能的。广泛采用IPSS-M之类的将原始细胞视为连续风险变量的风险模型,将有助于改善MDS患者的治疗。
参考文献
Amri RA,et al.Validation of independent prognostic significance of blast count in a large cohort of MDS patients. Leukemia. 2024 Jul 16. doi: 10.1038/s41375-024-02348-x.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#MDS# #骨髓增生异常综合征#
48