浙江大学申有青/相佳佳ACS Nano:口服纳米药物新突破—OPDOX与IOX1携手抗击肿瘤
13小时前 BioMed科技 BioMed科技 发表于陕西省
浙大申有青等提出口服转胞运纳米药物 OPDOX 与 IOX1 结合用于癌症化学免疫治疗,介绍胶束制备、口服吸收、转胞运等方面研究及体内抗肿瘤活性,凸显联合疗法的广阔前景。
【研究背景】
口服纳米药物在提高患者依从性、简化给药方式以及降低侵入性等方面具有显著优势,是癌症免疫治疗极具潜力的新途径,然而,口服纳米药物的疗效常常受到体内诸多生理屏障的制约。其一为胃肠道吸收难题,包括肠粘液和上皮细胞的阻碍;其二是肿瘤生理病理屏障,如肿瘤血管上皮细胞和致密瘤内基质的阻挡;其三则是免疫逃避机制,也就是免疫抑制微环境的影响。因此,研发高效的口服纳米药物来实现癌症靶向免疫治疗,仍然是一项艰巨的挑战。

鉴于此,浙江大学申有青教授和相佳佳研究员提出一种将口服转胞运多柔比星(DOX)纳米药物与组蛋白去甲基化酶抑制剂5-羧基-8-羟基喹啉(IOX1)相结合的方法,以实现协同化学免疫疗法(如示意图所示)。研究表明,IOX1显著增强了负载DOX的聚(2-(N-氧化物-N,N-二乙氨基)甲基丙烯酸乙酯)-聚(ε-己内酯)胶束(OPDOX)的转胞运能力,促进了其在各种细胞屏障(如绒毛、内皮细胞及肿瘤细胞)上的跨细胞转运,进而提高了口服吸收、血管外渗和肿瘤渗透性。此外,IOX1通过促进化疗敏感性,增强DOX诱导的免疫原性细胞死亡(ICD),并下调PD-L1,从而破坏免疫检查点机制,协同增强抗肿瘤免疫反应。因此,口服OPDOX与IOX1的联合使用能够有效抑制CT26肿瘤的生长,凸显了该口服纳米药物在癌症化学免疫治疗中的巨大潜力。该工作以《Synergistic Combination of Oral Transcytotic Nanomedicine and Histone Demethylase Inhibitor for Enhanced Cancer Chemoimmunotherapy》为题发表在《ACS Nano》上。
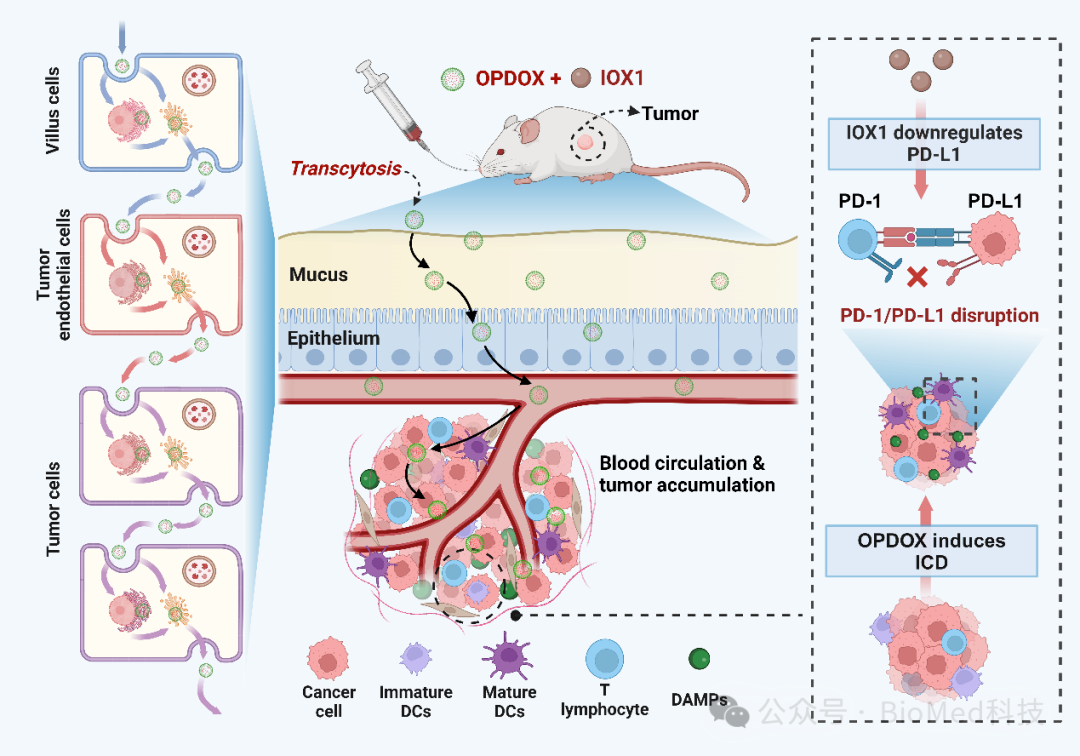
示意图. 通过将口服转胞运纳米药物OPDOX与IOX1相结合实现协同癌症化学免疫疗法
【文章要点】
1、胶束的制备和理化表征
采用ATRP法合成了两亲性聚合物载体OP-PCL,每个嵌段的分子量约为5 kDa。通过纳米沉淀法负载DOX后获得平均直径为49 nm、zeta电位为-7.32 mV的均匀球形OPDOX胶束。该胶束在去离子水、PBS、培养基、模拟胃液(SGF)和模拟肠液(SIF)中均表现出良好的稳定性。与PEG化载药胶束PDOX胶束相比,OPDOX胶束表现出增强的细胞毒性,特别是与IOX1共同给药(IOX1的质量为DOX的1.5倍)时,表明IOX1与DOX之间存在协同作用,这在CT26、MDA-MB-231、4T1、HCT116细胞和BxPC-3肿瘤球上得到了验证。
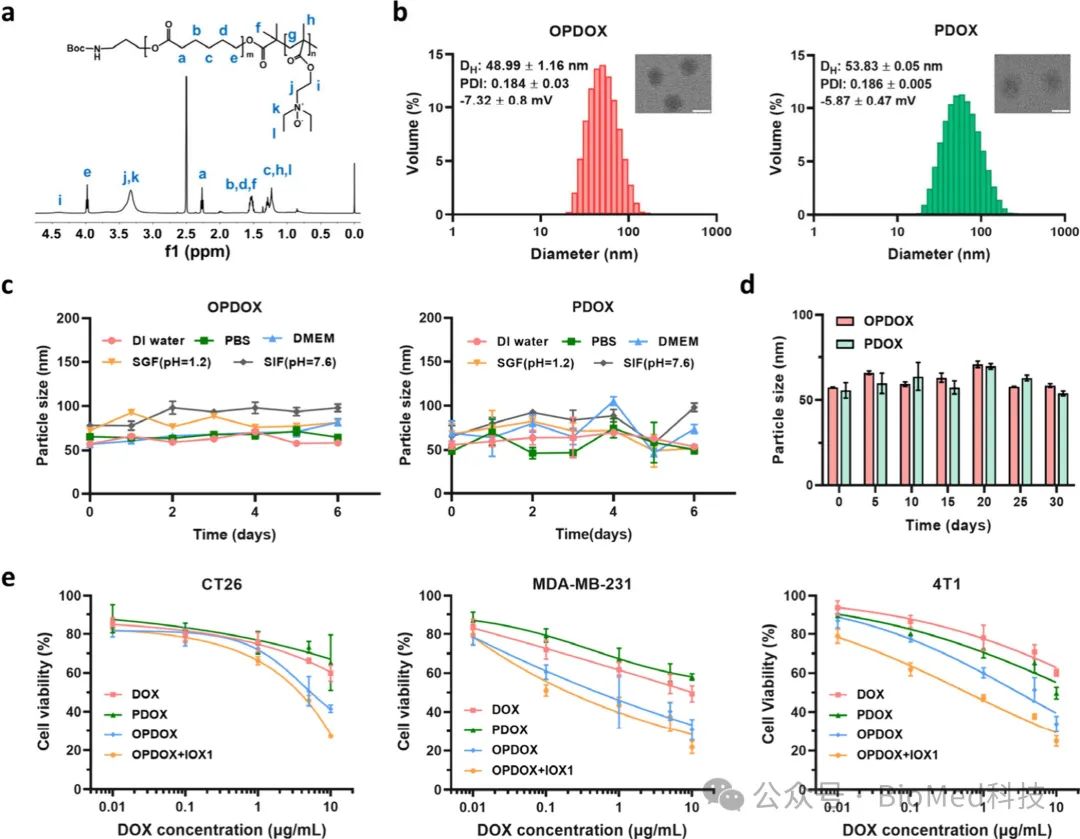
图1. 胶束的制备以及表征
2、口服吸收和跨上皮转运
口服胶束的生物利用度取决于其穿越肠上皮进入体循环的能力。作者用Caco-2细胞评估OPDOX胶束的转运。结果表明,OPDOX胶束通过巨胞饮途径快速进入Caco-2细胞,入胞后主要定位于内质网和高尔基体,与溶酶体共定位较少,说明其绕过溶酶体降解,经内质网/高尔基体途径运输。IOX1显著增强OPDOX胶束的细胞摄取,进一步提高其在内质网和高尔基体的定位,加快胞吐速率。因此,OPDOX胶束能有效跨越Caco-2单细胞层转运,且IOX1进一步加速了这一过程。转运后的胶束仍保持较高的药物包封效率和稳定性。OPDOX与IOX1协同使用,获得更高更快的血药浓度峰值和更高的口服生物利用度。
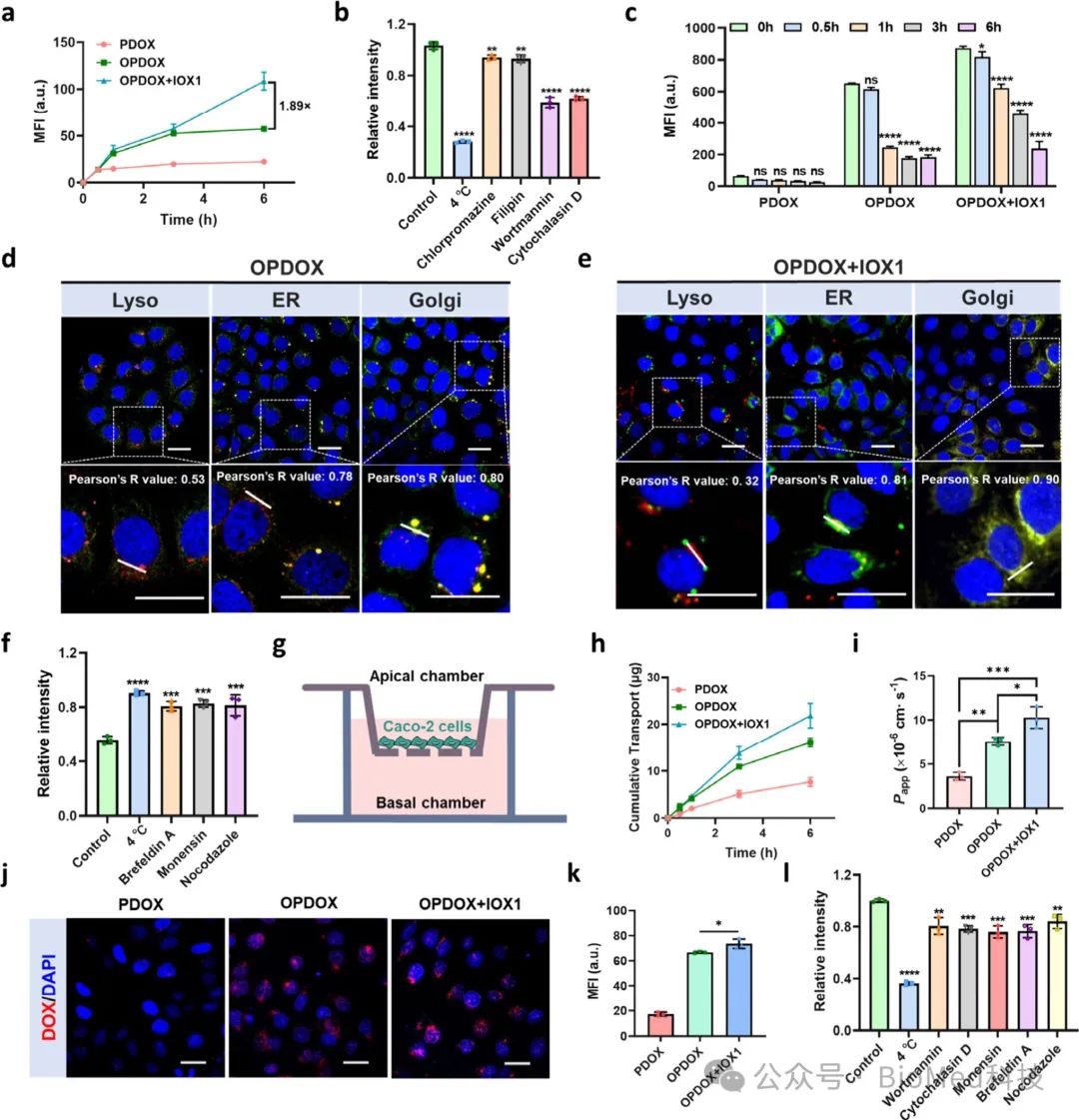
图2. 胶束的口服吸收和跨上皮转运
3、胶束的转胞运作用和肿瘤渗透
胶束从肿瘤血管外渗是其在肿瘤组织有效积累的关键。作者构建双侧细胞Transwell模型,顶侧为肝癌衍生内皮细胞(ECDHCC-1)构成的单细胞层,基底侧种植CT26肿瘤细胞。研究发现,OPDOX胶束能通过巨胞饮介导的内吞和内质网/高尔基体转运途径快速跨越ECDHCC-1细胞层,并被基底侧CT26细胞摄取,IOX1可加速这一过程。OPDOX与IOX1口服给药后,瘤内药物富集显著高于单独OPDOX或PDOX。这表明OPDOX胶束能克服肿瘤血管内皮屏障进入肿瘤富集。细胞感染实验和三维肿瘤球渗透实验表明,OPDOX胶束能通过转胞运作用在肿瘤细胞间有效传递,实现瘤内深渗透。IOX1的联合使用进一步增强了OPDOX对血管内皮层和肿瘤组织的渗透性。
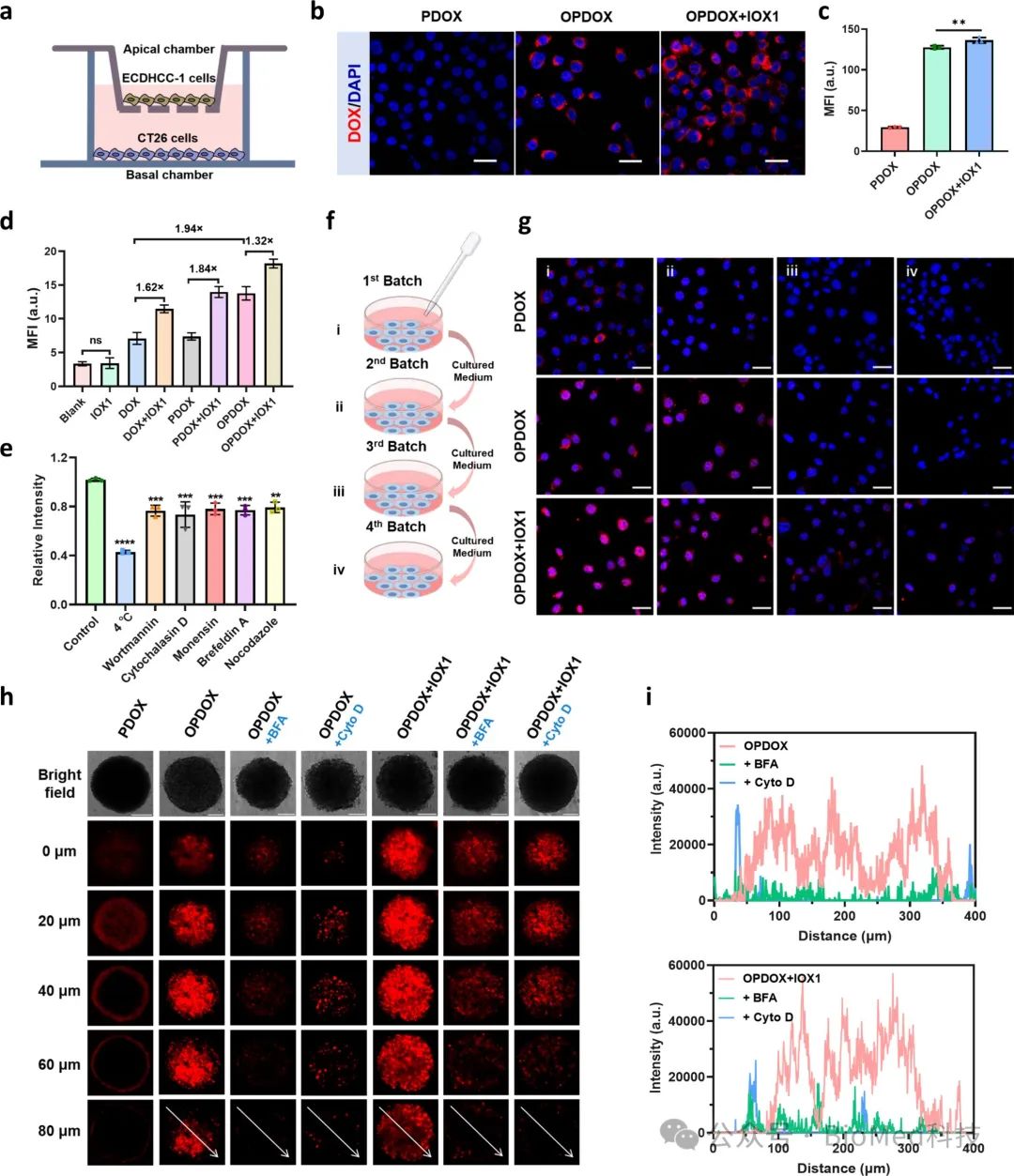
图3. 胶束的转胞运作用和肿瘤渗透
4、PD-L1下调和ICD诱导
PD-L1免疫检查点与PD-1结合,抑制T细胞增殖与激活,削弱抗肿瘤免疫反应。肿瘤细胞过表达PD-L1会致T细胞功能障碍,促进免疫抑制微环境,降低免疫治疗效果。DOX化疗显著上调CT26细胞的PD-L1表达,OPDOX胶束因更有效的细胞内化作用进一步增强PD-L1表达。作为组蛋白去甲基化酶抑制剂,IOX1通过抑制JMJD1A/β-catenin/PD-L1通路特异性抑制PD-L1表达。单独使用IOX1或与不同DOX制剂联合使用,均能显著下调肿瘤细胞的PD-L1表达。
DOX通过损伤相关分子模式(DAMP)诱导肿瘤细胞ICD,表现为CRT迁移增加、HMGB1减少和ATP释放增加。OPDOX胶束通过增强细胞摄取进一步强化这些ICD标志物表达。IOX1单独使用不诱导ICD,但能增强DOX效果,此协同作用可能与IOX1抑制多药耐药性并增加细胞内DOX积累有关。ICD的诱导与内质网应激密切相关,Western blot分析发现,OPDOX或其与IOX1联合使用后,p-PERK和p-eIF2α水平显著升高,表明内质网应激通路被激活。与IOX1联合使用时,各DOX制剂促进DC熟化的效果进一步增强,尤其是OPDOX+IOX1组合。这些结果证明了OPDOX与IOX1联合使用在增强化学免疫治疗方面的巨大潜力。
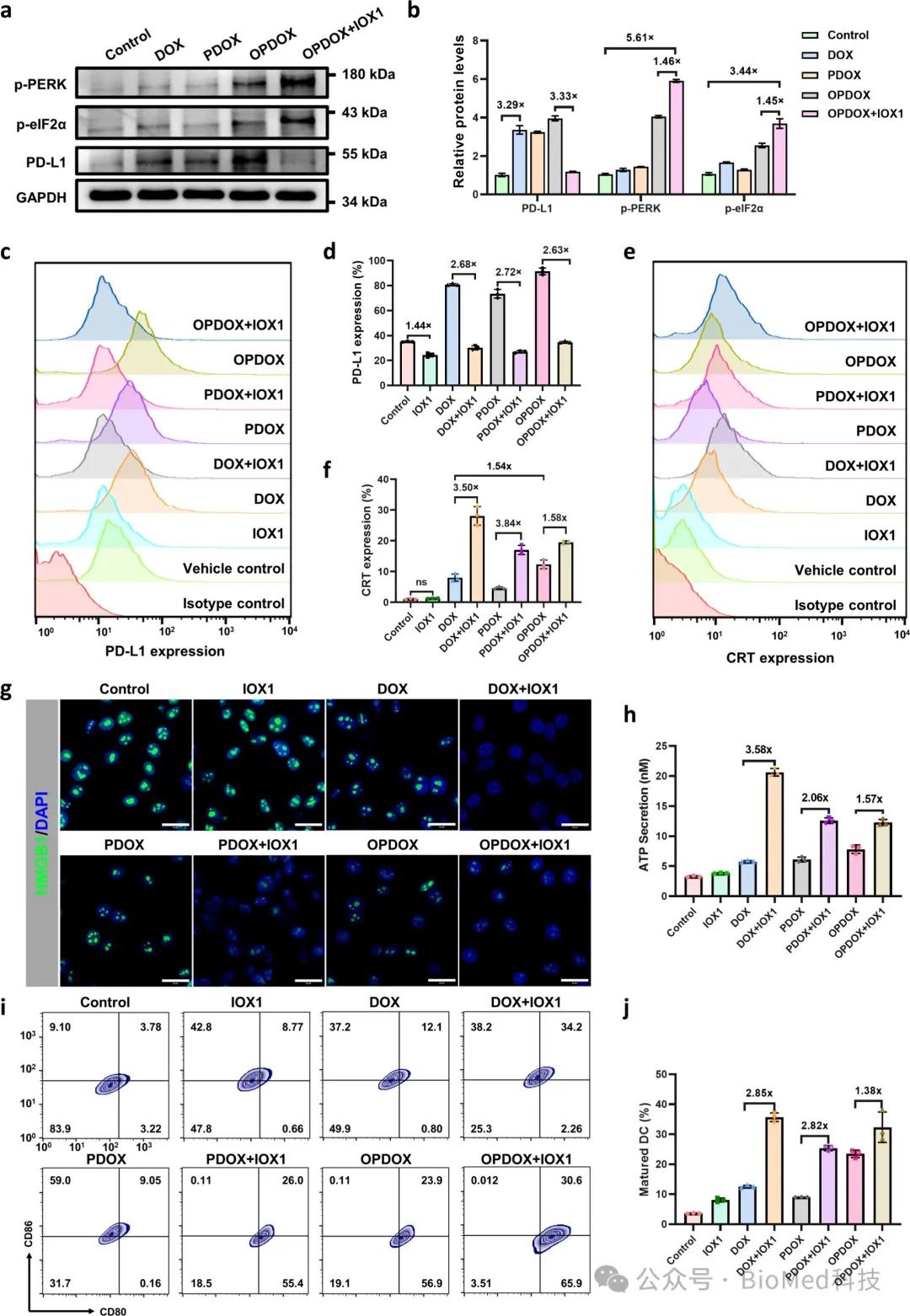
图4. PD-L1下调和ICD的诱导
5、体内抗肿瘤活性研究
在皮下CT26肿瘤模型中,评估不同口服制剂的治疗效果。将约80 mm3肿瘤的BALB/c小鼠分为四组(n=5),通过管饲法五天连续口服PBS、DOX、PDOX、OPDOX或OPDOX+IOX1。结果表明,OPDOX显著减缓肿瘤生长,肿瘤抑制率(TIR)为69.4%,而PDOX的TIR为35.8%。而OPDOX与IOX1联合治疗展现出最强的抗肿瘤效果,显著抑制肿瘤生长并诱导肿瘤消退,TIR高达92.3%,优于单一治疗。所有治疗组的小鼠体重均有所增加,说明该治疗方案安全性良好。这些结果显示,OPDOX+IOX1联合疗法具有作为协同癌症治疗的潜力。
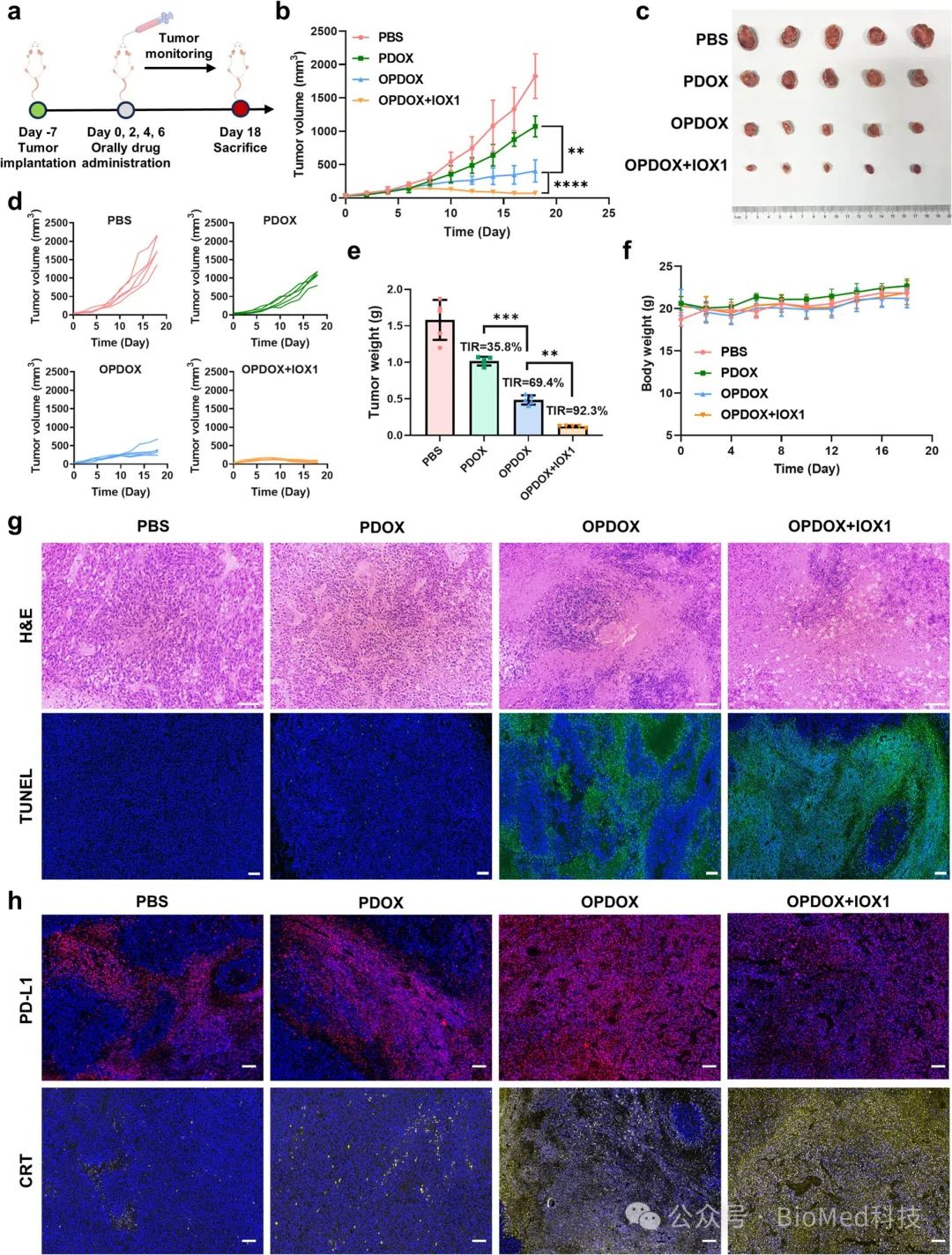
图5. 体内抗肿瘤活性研究
【小结】
作者开发出一种口服递药系统,协同使用转胞运纳米药物OPDOX与组蛋白去甲基化酶抑制剂IOX1用于化学免疫治疗。OPDOX具备优异的胃肠道稳定性,能有效诱导绒毛细胞、肿瘤内皮细胞及肿瘤细胞的转胞运作用,与IOX1联合使用时效果更佳。口服OPDOX可有效被血液吸收,从肿瘤毛细血管外渗并深入肿瘤组织。此外,IOX1增强了OPDOX诱导ICD及下调肿瘤PD-L1表达的能力,重塑免疫抑制性肿瘤微环境并破坏PD-1/PD-L1相互作用,二者组合协同激活抗肿瘤免疫反应。OPDOX与IOX1联合疗法在CT26肿瘤模型中展现出卓越的抗肿瘤疗效,这种口服联合治疗策略为癌症化学免疫疗法带来广阔前景。
原文链接:
https://doi.org/10.1021/acsnano.4c14816
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#化学免疫疗法# #口服纳米药物#
4