J Thorac Oncol | 帕博利珠单抗伴或不伴仑伐替尼一线治疗PD-L1 TPS≥1%的转移性非小细胞肺癌(LEAP-007):一项随机、双盲、3期临床试验
2024-02-29 daikun MedSci原创 发表于上海
该研究旨在评估帕博利珠单抗伴或不伴仑伐替尼一线治疗PD-L1 TPS≥1%的转移性非小细胞肺癌的疗效和安全性,联合治疗显示出抗肿瘤活性,但与帕博利珠单抗相比,其获益-风险比并不占优势。
帕博利珠单抗是EGFR/ALK野生型初治转移性NSCLC的一线标准治疗,但在大多数患者中仍会死亡,因此需要新的疗法来提高免疫疗法的临床效益,扩大获益人群,并进一步提高治疗响应率和生存率,初步研究显示仑伐替尼+帕博利珠单抗在晚期NSCLC中具有抗肿瘤活性和可管理的安全性,仑伐替尼的抗血管生成和抗增殖效应可能增强帕博利珠单抗的抗肿瘤活性,为了评估仑伐替尼+帕博利珠单抗在PD-L1肿瘤比例评分至少为1%的初治转移性NSCLC患者中的疗效和安全性,进行了LEAP-007研究。

方法
该研究入组对象为18岁及以上、未经治疗的IV期NSCLC患者,且满足PD-L1 TPS至少为1%、ECOG体能状态0或1,计划入组的620例患者按1:1比例随机分配至仑伐替尼+帕博利珠单抗组和安慰剂+帕博利珠单抗组,分组采用地理区域、ECOG体能状态、PD-L1 TPS等分层因素,仑伐替尼+帕博利珠单抗组接受仑伐替尼20mg qd口服,帕博利珠单抗200mg q3w静脉注射;安慰剂+帕博利珠单抗组接受安慰剂口服,帕博利珠单抗200mg q3w静脉注射,治疗周期为最多35周期,主要研究终点为总生存期(OS)和无进展生存期(PFS)。

研究结果
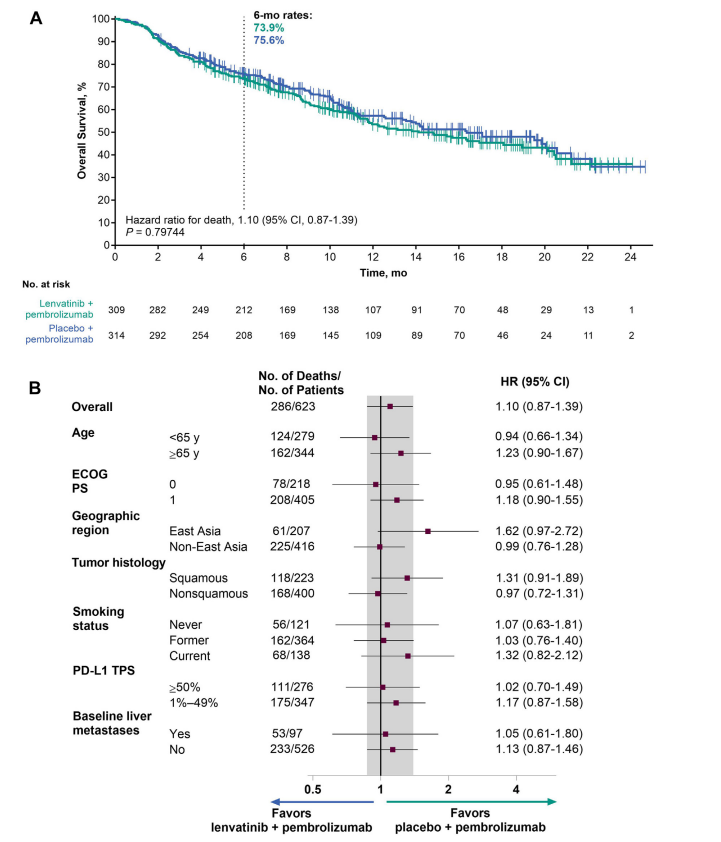
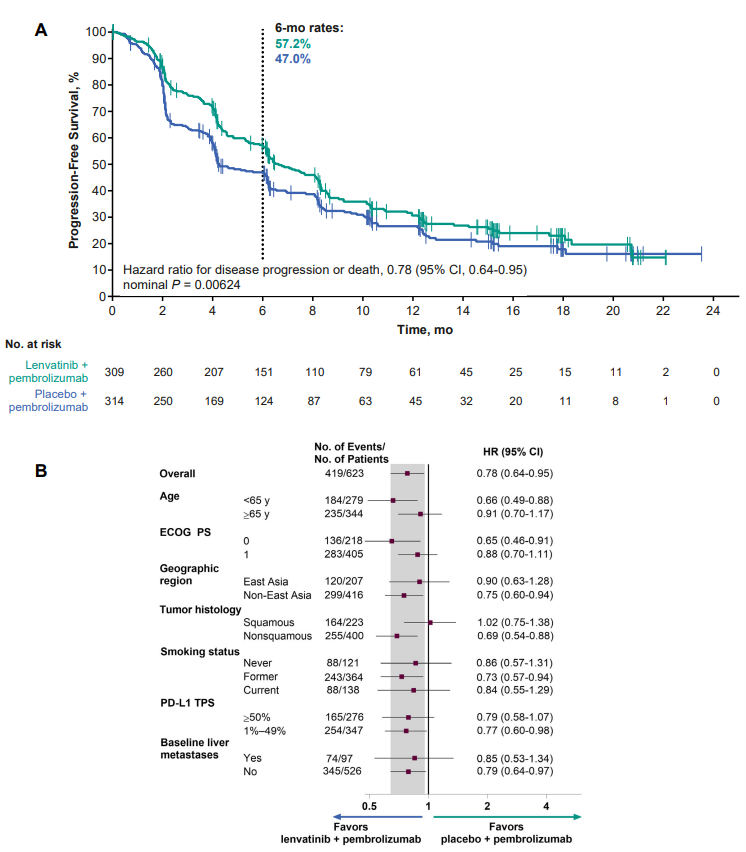
总生存期(OS):仑伐替尼+帕博利珠单抗组OS中位数为14.1个月,安慰剂+帕博利珠单抗组为16.4个月,风险比HR=1.10,p=0.7974,OS HR在各亚组中相似,但在东亚患者和鳞癌患者亚组中,仑伐替尼+帕博利珠单抗组OS HR略高。无进展生存期(PFS):仑伐替尼+帕博利珠单抗组PFS中位数为6.6个月,安慰剂+帕博利珠单抗组为4.2个月,HR=0.78,p=0.0062,PFS HR在各亚组中相似。客观响应率(ORR):仑伐替尼+帕博利珠单抗组ORR为40.5%,安慰剂+帕博利珠单抗组为27.7%,两组ORR差异为12.8%,p=0.00037。
安全性
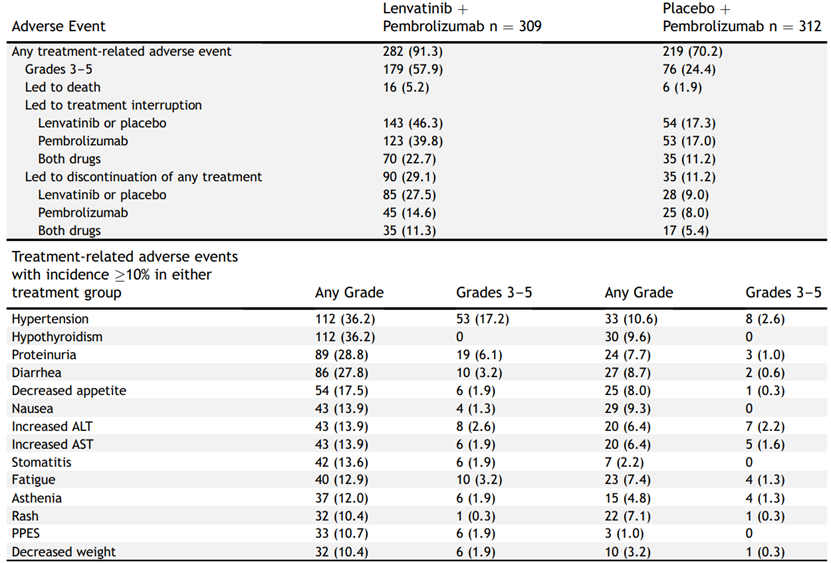
仑伐替尼+帕博利珠单抗组的治疗相关3-5级不良事件发生率高达57.9%,而安慰剂+帕博利珠单抗组为24.4%,前者的发生率明显高于后者,仑伐替尼+帕博利珠单抗组的治疗相关不良事件导致死亡的患者有16例,主要死因包括咯血、肺炎和肺出血,而安慰剂+帕博利珠单抗组导致死亡的不良事件包括肺炎、脑卒中、死亡、QT延长、免疫介导的肺病和呼吸衰竭,仑伐替尼+帕博利珠单抗组的治疗相关不良事件导致治疗中断的患者有70例,导致仑伐替尼或安慰剂中断的患者有143例,仅导致帕博利珠单抗中断的患者有123例,仑伐替尼+帕博利珠单抗组的治疗相关不良事件导致停用任何治疗的患者有90例,而安慰剂+帕博利珠单抗组有35例。
结论
虽然仑伐替尼+帕博利珠单抗在PD-L1 TPS至少为1%的初治转移性NSCLC患者中显示出抗肿瘤活性,但与帕博利珠单抗相比,其获益-风险比并不占优势,因此,帕博利珠单抗单药治疗仍然是许多地区PD-L1 TPS至少为1%且无EGFR/ALK突变初治转移性NSCLC的一线标准治疗,尽管仑伐替尼+帕博利珠单抗的ORR令人鼓舞,支持进一步评估VEGF抑制剂和帕博利珠单抗的组合,但目前仍需要更深入的研究来确定哪些患者群体可能从这种治疗组合中获益最多。
原始出处
Yang JC-H, et al. 2023. Pembrolizumab With or Without Lenvatinib for First-Line Metastatic NSCLC With Programmed Cell Death-Ligand 1 Tumor Proportion Score of at least 1% (LEAP-007): A Randomized, Double-Blind, Phase 3 Trial. Journal of Thoracic Oncology.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#转移性非小细胞肺癌# #仑伐替尼# #帕博利珠单抗#
28