【BJH】CAR-T治疗血液恶性肿瘤:从基础/转化研究到临床实践
2024-09-26 聊聊血液 聊聊血液 发表于上海
概述了哪些患者和白血病相关特征适合靶向治疗,并阐述了在未来5年内可能成为标准治疗的新型方案,包括介绍了MD安德森癌症中心的治疗经验。
随着对急性髓系白血病(AML)分子病理学的不断认识,也促进了治疗靶点的确定和相应的新型靶向治疗的发展。AML领域进展非常快,治疗选择也非常多,自2017年以来,至少已有12种药物获批用于治疗AML。
MD安德森癌症中心Hagop Kantarjian教授等近日于《Blood Cancer Journal》发文,概述了哪些患者和白血病相关特征适合靶向治疗,并阐述了在未来5年内可能成为标准治疗的新型方案,包括介绍了MD安德森癌症中心的治疗经验。

AML的治疗
AML 需要根据具体亚群严谨地选择治疗方案。图1A、B为1980年至2023年 MD 安德森按年龄列出的接受方案治疗的患者中de novo AML(不包括 APL 和CBF AML)的结局,显示几十年来生存率稳步改善,且在年轻患者和过去十年中更明显。图1C、D为接受方案治疗或方案外治疗的患者结局,显示总体结局略微差一些。方案外治疗可能由多种原因导致,包括患者要求、社会经济原因、距离 MD 安德森较远的地区需要在离家较近的地方继续治疗、保险问题和网络、器官功能障碍(心脏、肺、肝、肾)和其他。
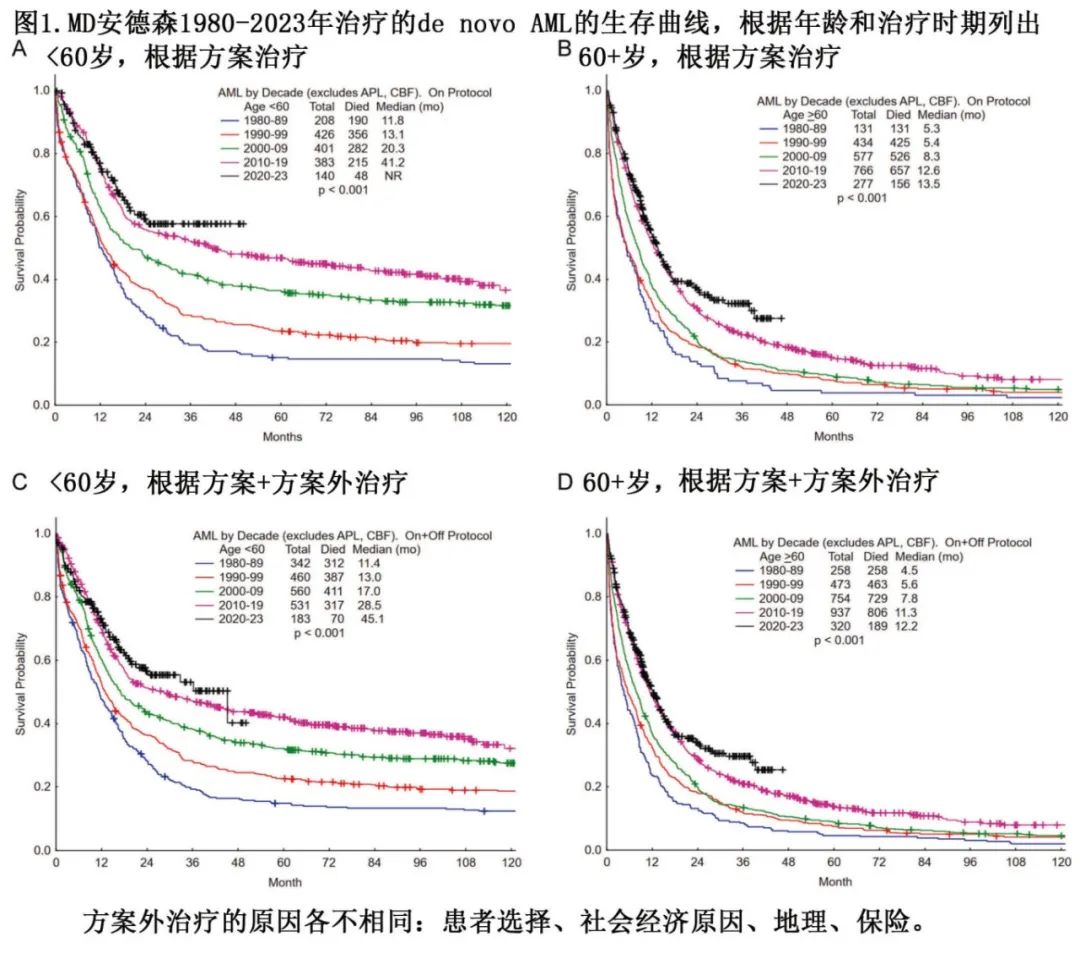
下文分为四种治疗策略:(1)高度可治愈的白血病的治疗方案:APL和 CBF AML;(2)年轻/fit AML患者的强化疗方案;(3)老年 AML患者的减低强度治疗方案(无论是否适合强化疗),包括强化疗下治愈率较低的年轻/fit患者,;(4)在标准治疗方案中加入靶向治疗(维奈克拉、FLT3抑制剂、IDH抑制剂、menin抑制剂)。
急性早幼粒细胞白血病
急性早幼粒细胞白血病(APL)约占 AML的5-10%,由细胞遗传学异常t(15;17)定义,导致 PML-RARa融合癌基因及编码癌蛋白。PML-RARa癌蛋白作为野生型 RARa的显性负性抑制剂,导致 APL的成熟阻滞和临床病理学表现。
在20世纪70年代,蒽环类药物单药治疗或联合阿糖胞苷治疗的治愈率为30-40%,但弥散性血管内凝血病(DIC)和出血导致的早期死亡率显著,高达10–20%。目前最有效的抗 APL药物为三氧化二砷,其次为全反式维甲酸(ATRA)、gemtuzumab ozogamicin (GO)和蒽环类药物;大剂量阿糖胞苷和化疗维持(POMP)具有适度抗 APL疗效。
基于ATRA和三氧化二砷在 APL中的单药疗效,将其联合标准化疗用于诱导和巩固治疗,结果显示总生存期(OS)和无事件生存期(EFS)改善。20世纪90年代末,ATRA联合伊达比星(AIDA方案)或其他蒽环类药物成为新的标准治疗。
无化疗方案:ATRA和三氧化二砷
2001年MD安德森首次对ATRA、三氧化二砷和 GO 的非化疗方案进行研究,并报告高度有效。随后在意大利/德国、英国、美国的随机试验以及法国和欧洲的数据库中,证实其在高危和低危 APL 中比 AIDA 或其他标准方案更有效。在长期随访研究中,ATRA-砷剂的10年生存率为90%以上,而 AIDA 为75%。目前诱导治疗期间的死亡率(主要为DIC 相关致死性出血)≤5%。除分子变异(11号和17号染色体之间易位[PLZF-RARa]或5号和17号染色体之间易位)外,耐药极为罕见。
诱导治疗的一般方法为ATRA 每日45 mg/m2 PO分2次给药和三氧化二砷每日0.15 mg/kg IV(见下文封顶剂量),可在高危 APL 患者(定义为就诊时或诱导治疗期间WBC>10 ×109/L)中加入GO(6–9 mg/m2)。一旦达到CR(通常3-4周)则接受巩固治疗,包括ATRA给药2周、停药2周,持续8个月,三氧化二砷每周5天、持续4周(20次给药),隔月一次,持续4个疗程(80次给药;加上诱导共约110次给药)。如果PCR检测在CR后3+个月显示MRD阳性(罕见;由于可能出现假阳性,需至少记录两次),则也可在巩固治疗中加入GO。
有几个重要的考虑因素有助于优化治疗和提高治愈率:(1)不使用粒细胞集落刺激因子,因为 APL是一种对其非常敏感和危险的白血病,其使用可导致原始细胞计数突然升高和致死性 DIC;(2)警惕ATRA和三氧化二砷相关的液体超负荷(通常与分化综合征混淆,并因分化综合征而恶化)(以及输血大量血液制品,如新鲜冷冻血浆,以防止消耗性凝血病的并发症),其可能导致诱导治疗期间显著的肺和多器官衰竭发生率,可通过积极利尿和暂停 ATRA-三氧化二砷治疗进行管理(治疗后10-14天不需要担心APL进展,因为耐药性APL很少见);(3) 警惕可能出现呼吸系统症状/肺部和多器官衰竭的分化综合征,最好通过在诱导期间使用预防性类固醇来预防(例如地塞米松10mg IV每日x 14;监测血培养,并进行抗菌、抗病毒和抗真菌预防)。(4)中枢神经系统白血病在APL中罕见,诱导过程中发生脑出血可能会增加其风险。在这类患者中,一旦骨髓CR,给予两次鞘内注射阿糖胞苷的CNS预防可能有助于预防这种罕见并发症。(5)部分研究中使用三氧化二砷0.15 mg/kg,无封顶日剂量。APL与肥胖相关(至少对于美国患者),每日剂量≥20mg的过度肥胖患者中肾衰竭的发生率罕见增加,因此建议将每日剂量限制在15mg。印度则以 10mg日剂量给药(出于经济原因)并取得巨大成功(Dr Vikram Matthews;个人交流)。(6)观察颅内压升高的体征(重度头痛、视乳头水肿),这是 ATRA治疗的罕见并发症。可通过降低 ATRA剂量、给予类固醇(地塞米松、泼尼松)和乙酰唑胺(125~ 250 mg PO,每日2~4次)或脑脊液-胸腔分流术(重度病例?)成功处理。如果必须停用ATRA,则进行 GO替代治疗(3 mg/m2每 6周x 6;总剂量18 mg/m2)有效。(7)罕见情况下,APL可表现为显著的DIC血栓形成,而非出血事件。使用伊达比星或 GO可立即消除血栓性DIC(而 ATRA可能使其恶化)。
一项来自英国的试验研究了不同的三氧化二砷剂量方案,包括在每个疗程的第1-5天给予0.3 mg/kg,然后在第1疗程的第2-8周和第2-5疗程的第2-4周给予0.25 mg/kg每周两次;日剂量较高但总剂量较低。审查肾衰竭发生情况的数据可能是有意义的。
三氧化二砷口服制剂似乎与静脉注射(IV)三氧化二砷一样有效,使 APL的治疗更方便,尤其是在巩固治疗期间。
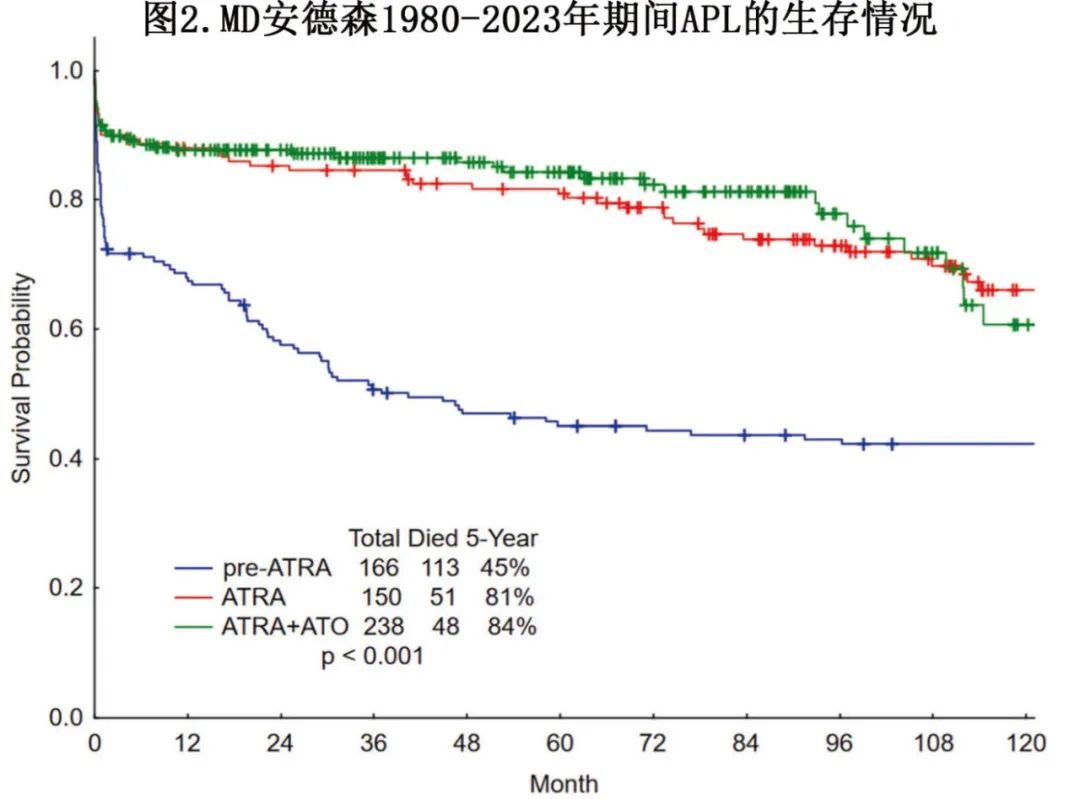
图2显示,自引入 ATRA-三氧化二砷治疗后 APL的生存期显著改善;包括接受或未接受方案治疗的患者,以提供 APL生存期的真实世界分析,因为部分患者可能会遇到早期 DIC相关问题和死亡率,且可能不会最终接受方案治疗。此外在长期随访中,部分患者可能死于 APL以外的原因(高龄、第二肿瘤、其他疾病)。
核心结合因子急性髓系白血病(CBF AML)
CBF AML约占成人 AML的10-15%,占儿童 AML的20-30%,包括倒位16/t(16;16)和t(8;21)。倒位 16 AML与嗜酸性粒细胞增多有关;t(8;21)AML常表达CD19。
在诱导巩固治疗期间使用大剂量阿糖胞苷的标准化疗方案并联合 GO可将 CBF AML的治愈率从<50%提高至75%以上,此外治愈率从一次大剂量阿糖胞苷巩固治疗的30-40%增加至3-4次巩固治疗的50%以上。诱导巩固联合使用大剂量阿糖胞苷、氟达拉滨和伊达柔比星,并在诱导巩固期间添加GO 3mg/m2 x1 (SWOG和MRC研究),5年生存率为75%以上。在 MD 安德森,在诱导和巩固治疗期间使用氟达拉滨、大剂量阿糖胞苷和GO(即FLAG-GO),最多治疗7个疗程(3个疗程使用 GO 3mg/m2),GO替代伊达比星时结果更佳,FLAG-GO方案的5年生存率为80%(图3)。使用氟达拉滨、大剂量阿糖胞苷和伊达比星的 MRC研究(FLAG-IDA) +/-GO报告了相似的长期生存率。一项META分析纳入将患者随机分配至标准化疗±GO组的5项研究,结果显示加用 GO 可将5年生存率从50%提高至75%。
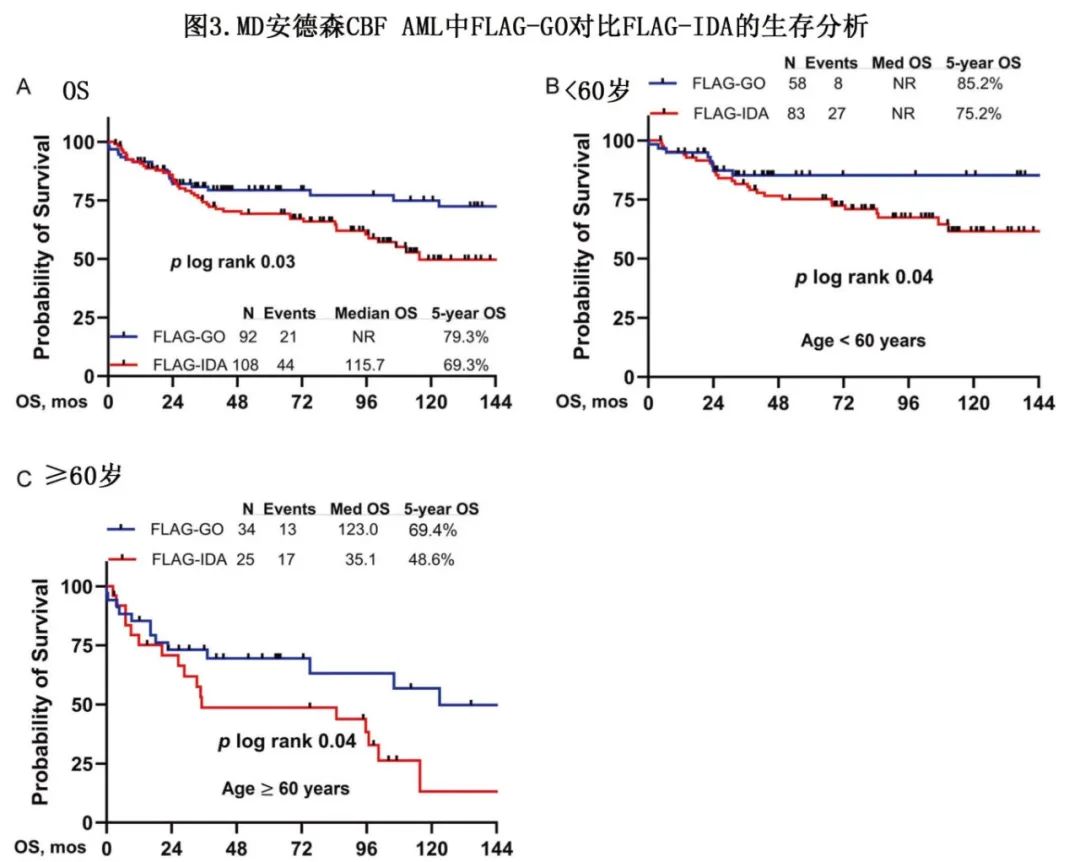
FLT3(15–20%)、c-KIT(29–30%)、NRAS(15–20%)、ASXL2(15%)、ASXL1(11%)、TET2(7%) 和其他突变在 AML 中很常见,但其预后意义取决于使用的治疗。部分使用7+3方案的研究报告C-KIT或多种突变的结局更差。近期来自欧洲的 Harmony 数据库纳入520例注释病例,其中t(8;21) 患者大多接受7+3治疗(仅13%接受 GO 治疗);CR 率为94%,5年生存率为63%;多因素分析发现高c-KIT VAF (25+%)、FLT3-ITD突变和 TET2 突变与生存期较差相关。但FLAG-GO治疗中并非如此。老年 CBF AML 患者接受调整剂量的 FLAG-GO 治疗,不能耐受 FLAG-GO 或分子学 MRD 持续阳性的患者可接受 HMA(地西他滨,阿扎胞苷)和维奈克拉/GO,治疗持续时间为12+个月(根据 MRD 结果调整)。尽管数据很少,但也可以考虑靶向治疗(avapritinib、新型 c-KIT 抑制剂或达沙替尼治疗 c-KIT 突变;FLT3抑制剂治疗 FLT3 突变)。
年轻/fit AML患者(以及老年/适合强化疗的患者)
AML 的中位年龄为68岁,而7+3和其他强化疗方案的研究大多在年轻患者(通常年龄上限为60-65岁)中开展,因此已发表的文献可能无法反映社区实践中的结果(稍后讨论)。
7+3蒽环类-阿糖胞苷方案;大剂量阿糖胞苷巩固治疗
自20世纪70年代发现阿糖胞苷和蒽环类药物治疗 AML 的疗效以来,一系列随机研究评价了不同剂量和给药方案的阿糖胞苷(5 vs 7 vs 10天;100 mg/m2 vs 200 mg/m2)联合蒽环类药物及加入其他药物(例如依托泊苷、lomustine)。这些研究确定了7+3方案(每日阿糖胞苷100–200 mg/m²连续输注7天;每日柔红霉素60 mg/m²静脉 [IV]×3,或每日伊达比星12mg/m² IV×3)为持续半个世纪的标准治疗。巩固治疗的随机研究则证实了大剂量阿糖胞苷(3g/m² IV输注2-3h,每日两次,持续3天,通常在第1、3和5天给药)的获益。后来研究表明,阿糖胞苷1.5g/m²/剂与 3g/m²/剂同样有效,研究了替代方案(即每日给药×5天)。并探索了4个与5个疗程(4个疗程显示同样有效)。研究还表明,异基因 HSCT 在首次缓解中的获益平均优于巩固治疗策略。异基因 HSCT 的获益似乎中高危 AML 亚组中最高,具体取决于 SCT 前的 MRD 状态。
强化治疗方案是否比7+3更有效?
与7+3相比,以下几种方案均旨在改善标准7+3(各方案均在下文详细讨论):(1) 诱导治疗期间大剂量阿糖胞苷联合给药;(2) 柔红霉素(60mg/m²每日给药×3 vs 45 mg/m²或 90 mg/m²每日给药×3,或伊达比星 12mg/m²每日给药×3;(3) 在阿糖胞苷-蒽环类药物基础上加用腺苷核苷类似物(氟达拉滨、氯法拉滨、克拉屈滨);(4) 加用GO;(5) 加用 BCL-2 抑制剂维奈克拉;(6) 存在相应突变时加用 FLT3 和 IDH 抑制剂;(7) 口服阿扎胞苷维持治疗。
大剂量阿糖胞苷诱导治疗
大剂量阿糖胞苷巩固治疗是标准治疗,后续多项研究在诱导期间评估了大剂量阿糖胞苷。一项在<65岁患者中进行的 SWOG 研究在诱导治疗期间比较标准剂量阿糖胞苷(每日200 mg/m²×7)与大剂量阿糖胞苷(每12h 2g/m²×12)(均联合柔红霉素),结果显示大剂量阿糖胞苷在<50岁患者(33% vs 21%)和50-64岁患者(21% vs 9%;p=0.049)中具有更高的4年无复发生存率 (RFS)。一项在澳大利亚≤60岁患者中比较大剂量阿糖胞苷(每12h 3g/m² ×8)与标准剂量阿糖胞苷(均联合柔红霉素和依托泊苷诱导)的研究报告,大剂量阿糖胞苷可显著改善 CR 持续时间(中位 45 vs 12 个月;p=0.0004)和5年 RFS 率 (49% vs 24%)。一项META分析纳入大剂量与标准剂量阿糖胞苷诱导治疗的3项研究,显示大剂量阿糖胞苷可改善4年RFS(p=0.03)、生存期 (p=0.0005) 和EFS(p<0.0001) 。
EORTC-GIMEMA工作组随机分配1942例年轻患者(≤60岁)接受柔红霉素+依托泊苷+大剂量阿糖胞苷(每12h 3g/m² ×8)或标准剂量(每日100mg/m²×10)。在15-45岁患者中,大剂量阿糖胞苷具有较高的 CR 率 (82% vs 76%;p=0.01)、6年 EFS 率(44% vs 35%;p=0.003)和6年生存率 (52% vs 43%;p=0.009);在45-60岁的患者中,大剂量阿糖胞苷也导致显著更好的 CR 和6年 EFS 率,且在 FLT3-ITD AML 或预后不良核型患者中也有更好的生存趋势。
一项意大利研究将574例患者(中位年龄52岁;范围16-73岁)随机分配至伊达比星-阿糖胞苷-依托泊苷 (ICE) 组或伊达比星序贯大剂量阿糖胞苷组;结果后者诱导治疗导致第1疗程后CR 率更高 (81% vs 69%;p=0.02),5年生存率(49% vs 39%;p=0.045)和 RFS 率 (48% vs 36%;p=0.028) 更高。
在 Lowenberg 等开展的一项研究中,比较了大剂量阿糖胞苷(每12h 1g/m² ×10)与标准剂量阿糖胞苷(均联合伊达比星)的诱导治疗,结果相似,可能是因为两组在诱导治疗第2疗程均接受了大剂量阿糖胞苷。
SWOG-1203 研究将患者随机分配至:(1)7+3诱导治疗后4疗程大剂量阿糖胞苷巩固治疗(第1、3和5天3g/m²每日两次,总巩固18g/m²/疗程x4 =72g/m²);(2) 伊达比星+连续大剂量阿糖胞苷(每日1.5 g/m²连续输注x4;总计6g/m²;IA方案),随后 IA 巩固治疗,给予每日阿糖胞苷0.75g/m²连续输注3天(2.25g/m²/疗程),共4个周期(整个治疗合计阿糖胞苷16g/m²);(3)IA+ vorinostat。后两组可测试大剂量阿糖胞苷诱导的获益,阿糖胞苷的总剂量低于7+3方案。因此,7+3方案在 CBF AML 中产生更好的结果并不奇怪。尽管 IA方案中阿糖胞苷总剂量较低,但具有中危或高危核型的 AML 在7+3组和 IA 组的结果相似。试验设计阻碍了评估诱导治疗期间大剂量阿糖胞苷获益的能力。
加入核苷类似物
Plunkett等在 MD 安德森进行的临床前研究开发了氟达拉滨、大剂量阿糖胞苷和伊达比星联合治疗方案(FLAG-IDA或FAI)。MRC AML 15研究将年轻患者随机分配至 FLAG-IDA 组或7+3组(联合或不联合依托泊苷);FLAG-IDA 方案使用阿糖胞苷每天 2g/m2共5天,氟达拉滨每天 30mg/m2共5天,伊达比星每天8–10mg/m2共3天。完成4个周期FLAG-IDA(2周期FLAG-IDA +2周期大剂量阿糖胞苷)治疗的患者8年生存率为66%,而7+3组为47%。FLAG-IDA/FAI是一种因骨髓抑制相关副作用而难以给药的强化治疗方案,但鉴于8年生存率有20%的优势,仍值得考虑。它可以在专门的白血病中心有效给药,包括使用三联抗生素预防(抗菌、抗真菌、抗病毒),并提供基础设施,提供全面的支持治疗(包括及时输血支持、管理毒性以及快速和积极治疗感染/败血症和其他并发症)。
即使经过30多年的研究,大剂量阿糖胞苷最佳给药方案仍存在争议。大剂量阿糖胞苷1.5-2 g/m2可能与初始拟定剂量 3g/m2同样有效且毒性更小。正在进行的 MD 安德森研究在诱导和巩固治疗期间使用每日1.5–2g/m2 ×5(每个疗程总计7.5-10g/m2)。
还探索了其他腺苷核苷类似物(氯法拉滨、克拉屈滨)联合标准疗法。在两项随机研究中,波兰研究者报告了在一线7+3诱导治疗中加用克拉屈滨的获益。
当前针对年轻/fit 患者的 MD 安德森研究中使用伊达比星和大剂量阿糖胞苷与腺苷核苷类似物联合治疗方案(FLAG-IDA方案中为氟达拉滨;CLIA方案中为克拉屈滨)。这些方案目前包括在无指导性突变(guiding mutation)的所有患者中使用维奈克拉(诱导治疗期间仅7天,巩固治疗期间仅5–7天),或在 FLT3 突变 AML 患者中使用 FLT3 抑制剂(吉瑞替尼、quizartinib)。在 FLT3 突变患者中同时加入维奈克拉和 FLT3 抑制剂与重度骨髓抑制相关并发症相关,并可能增加诱导死亡。还在一线治疗中探索 IDH1/2 抑制剂治疗 IDH1/2 突变 AML 以及 menin 抑制剂在 KMT2A-AML 和 NPM1 突变 AML 中的潜在价值。具有 FLT3 样特征的患者也可能从加用quizartinib(或其他 FLT3 抑制剂)中获益。具有 menin 样特征(或 HOXA9/MEIS1 特征)的患者可能从添加 menin 抑制剂中获益。
蒽环类药物的选择
历史上,在诱导治疗期间使用柔红霉素30–60 mg/m2/天×3。后续随机研究显示,90 mg/m2每日×3优于 45mg/m2每日×3(联合阿糖胞苷);而柔红霉素 30-45 mg/m2/天×3疗效不佳。但对照研究表明柔红霉素 60mg/m2/天×3与90mg/m2/天×3同样有效且毒性更小【JCO】新诊断AML 7+3诱导,柔红霉素60对比90mg/m2及单次对比双次诱导的随机研究。
多项随机研究和五项 AML 研究的荟萃分析表明,伊达比星(12 mg/m2/天×3)可能同样有效甚至更有效。在 MD 安德森,在 FLAG-IDA/CLIA 方案中使用伊达比星每天8–10 mg/m2 ×3。
Gemtuzumab ozogamicin(GO)
这种与刺孢霉素结合的CD33抗体药物偶联物经历了一段艰难旅程。基于142例复发性AML患者的3项II期研究(缓解率30%;CR率16%),最初于2000年5月获得美国食品药品监督管理局(FDA)的加速批准,用于老年AML的首次挽救治疗。随后在一线随机研究中探索了较低和分次给药方案(诱导和巩固治疗期间3mg/m2 ×1;诱导治疗期间第1、4和7天3 mg/m2)。美国SWOG关键研究将患者随机分配至7+3+/-GO组,其中GO组使用次优柔红霉素剂量(每天45mg/m2×3),可能导致总体结果为阴性,并导致GO在2010年从美国市场撤出。而随后另外4项成熟随机研究显示GO治疗在总体人群或亚组人群中的获益。对上述5项研究(3325例患者)进行的荟萃分析显示,添加GO降低复发风险(p=0.0001)并改善5年生存率(p=0.01)。GO在细胞遗传学低危AML患者中的获益最明显(5年生存率改善>20%,从50%增至75%,p=0.0006;中危患者改善约5%,p=0.005)。GO 3mg/m2比6mg/m 2更安全,且疗效相当。FDA于2017年以较低剂量方案重新批准了GO。一个重要的研究问题在于,如何将GO安全地整合到FLAG-IDA和CLIA等强度高于3+7且包含维奈克拉或FLT3/IDH抑制剂的治疗方案中。
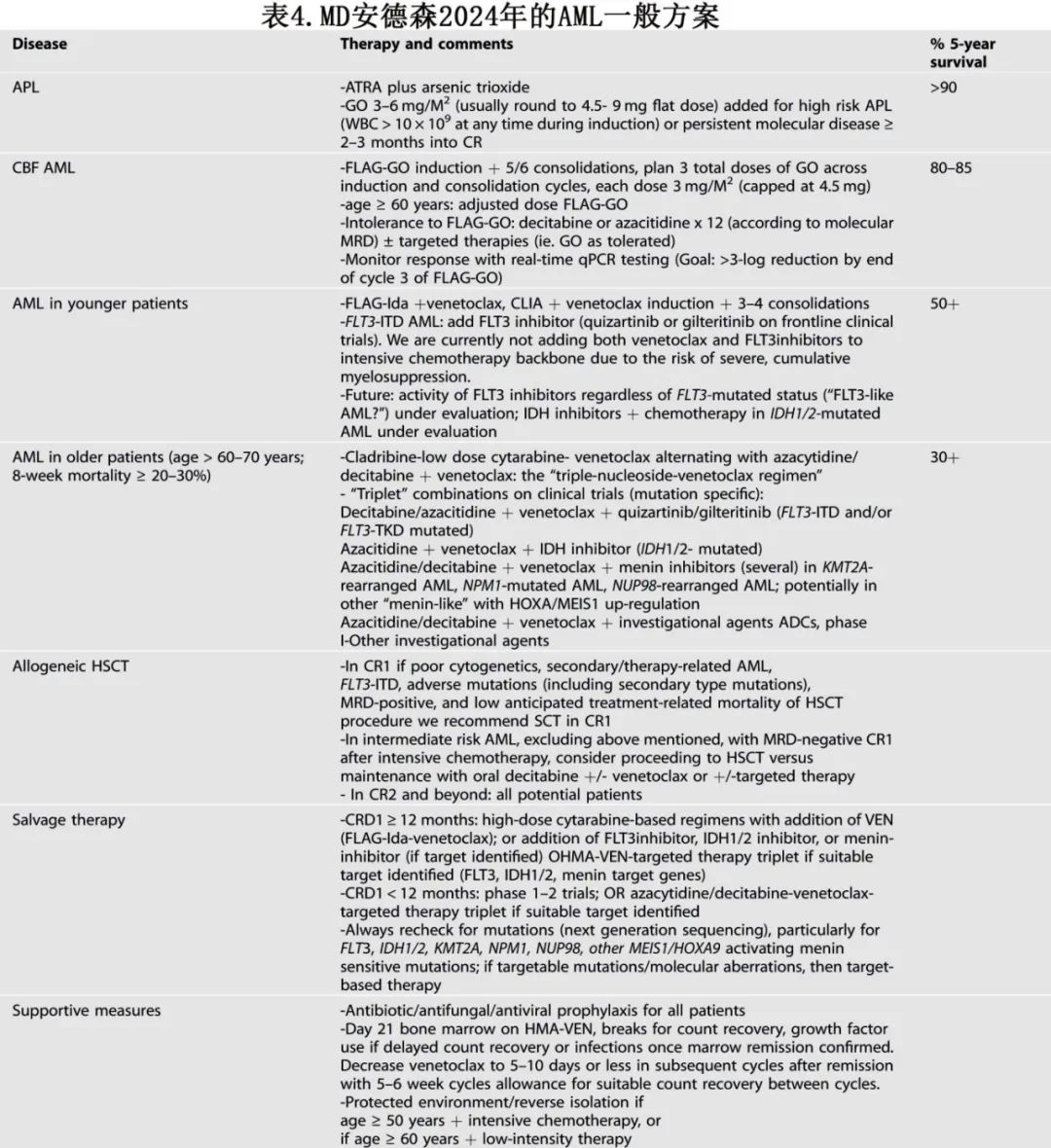
2024年MD安德森的方案
自2017年以来,有12种新型治疗药物获批治疗AML(其中包括口服地西他滨,其用于治疗MDS/CMML,也可作为 AML 患者HMA 的口服替代药物),年轻/fit AML 患者的最佳一线治疗正在迅速发展。7+3方案仍是常用的标准治疗,但其在年轻和老年/fit AML患者中的结果并不理想。如前所述,已出现更好的强化治疗方案作为一线和挽救治疗方案,包括在诱导和巩固治疗中加入大剂量阿糖胞苷,并添加核苷类似物和较低剂量GO(CBF和中危核型AML的诱导-巩固治疗)。这些方案及7+3方案目前还纳入靶向治疗,对其他生物学特征的研究可能导致在其他亚组中纳入靶向治疗(例如在 FLT3 样和 HOXA9/MEIS1 特征中)。
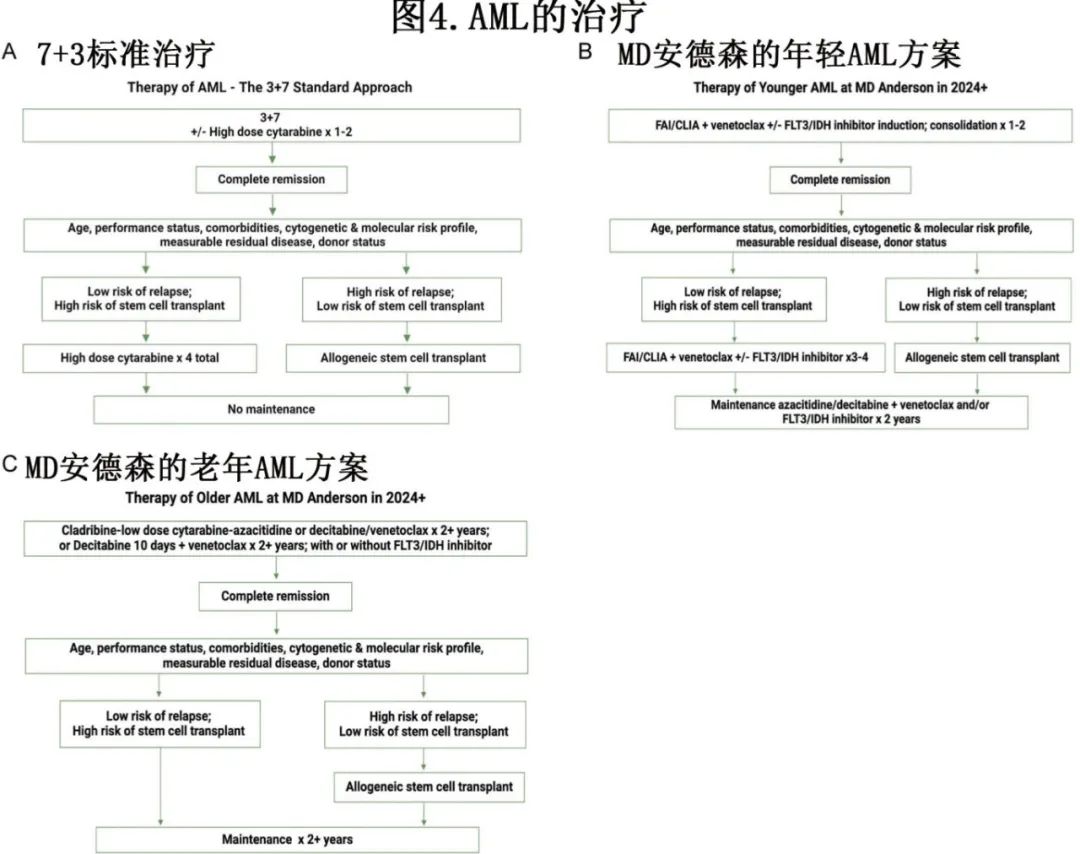
目前针对年轻/fit AML 患者的 MD 安德森方案为FLAG-IDA +维奈克拉和CLIA +维奈克拉(诱导治疗期间7天;巩固治疗期间5–7天)。对于FLT3 突变 AML,使用 FLT3 抑制剂(吉瑞替尼、quizartinib)而非维奈克拉。鉴于与骨髓抑制相关的重大并发症和潜在死亡率,这些治疗方案是否可以联用一种以上的靶向治疗(如维奈克拉联合 GO 或 FLT3 或 IDH 抑制剂)仍是一个重要的研究问题。由于使用唑类抗真菌药作为三联抗生素预防的一部分,因此需对靶向治疗进行特定的剂量调整:将维奈克拉的日剂量从 400 mg/天减至 50mg/天(联合泊沙康唑时)、100mg/天(伏立康唑)、200mg(艾沙康唑);联合艾伏尼布时将维奈克拉的剂量增加至 600mg/天。达到 CR 后,可根据以下考虑因素为患者提供异基因HSCT:供者可用性;患者年龄、体能状态和合并症;治疗前 AML 特征(核型、突变特征);以及 CR 时的 MRD 状态。一般而言,如果患者基于不良细胞遗传学为中危或高危AML、存在FLT3-ITD/其他不良突变或持续 MRD,则在首次 CR 时考虑异基因HSCT;否则就继续4个巩固疗程,并给予HMA-维奈克拉或适当的靶向治疗方案维持治疗(例如,如果 FLT3 突变,则使用 FLT3 抑制剂;如果 IDH1 突变,则使用 IDH1 抑制剂;如果 IDH2 突变AML,则使用 IDH2 抑制剂或维奈克拉)(图4)。≥50岁患者在医院保护环境(层流空气室、加强感染预防措施、无活植物/通风设备、有限的访视)下接受诱导治疗,以降低诱导死亡率(表4);在社区实践中也可以实施类似的隔离/保护策略。
采用该方案,非选择性年轻/fit AML 患者的 CR/骨髓 CR 率为80–90%,长期生存率为50%以上(不包括接受 HMA 治疗的 MDS 后AML,或“接受治疗的继发性AML”)(图1)。结合靶向治疗(维奈克拉、FLT3抑制剂、IDH抑制剂、GO、新型 CD33 单抗、menin抑制剂)将有望进一步改善结局。
一些 AML 亚群对当前基于化疗的策略仍真正耐药:治疗相关AML、TP53突变、MECOM重排。这些患者占相当大的比例 (5–25%),应将其转诊至提供研究方法的中心并单独分析,将其纳入当前 AML 的研究可能会掩盖新策略的潜在价值。
许多既往研究用药现已获得 FDA 批准,并用作获批适应症的标准治疗或联合策略,以优化其潜在获益和成本效益。下文总结了强化疗联合维奈克拉、FLT3抑制剂和 IDH 抑制剂的新型靶向治疗作为年轻/fit AML 的一线治疗。
强化疗联合维奈克拉
FLAG-IDA 和 CLIA 联合维奈克拉(诱导期7天;维持期5天)的 MD 安德森一线治疗研究显示,与不联合维奈克拉的相同强化方案的历史数据相比,结果为阳性:OS和 EFS 改善,但平均而言,首次 CR 时异基因HSCT 的结局更好,尤其是中-高危组。在 CLIA-维奈克拉 的最新更新中,95例接受治疗的患者(中位年龄48岁;范围18-64岁)CR率为84%,CR+CRi率为95%,MFC-MRD阴性率为90%;3年 OS 率为82%,诱导期死亡率为1%。66%的患者在首次 CR 时进行了异基因HSCT。三联抗生素预防、在保护环境中治疗、及时支持性治疗和根据指征使用生长因子是降低骨髓抑制相关并发症(感染、出血)相关致病率/死亡率的重要因素。其他研究者也使用7+3或5+2(在老年/fit 患者中)并报告令人鼓舞的初步结果。
强化疗联合FLT3抑制剂
III 期 RATIFY 研究 (CALGB 10603) 将717例新诊断 FLT3 突变AML(FLT3-ITD 73%;FLT3-TKD 23%) 年轻患者(<60岁;中位年龄48岁;范围18-59岁)随机分配至7+3 +/-midostaurin组。加用midostaurin可改善 CR 率 (59% vs 54%;p=0.045) 和生存期(中位 OS 分别为74.7和25.6个月;p=0.009;5年生存率分别为50%和42%)。
QuANTUM-First III 期研究筛选3468例患者,发现864例 (25%)携带FLT3-ITD 突变,并将539例患者(62%合格;占总数的16%)随机分配至7+3联合quizartinib组或7+3联合安慰剂组。两组CR率相似 (55%),且quizartinib组的诱导期死亡率略高(30天死亡率为6% vs 3%;p不显著)。中位 OS 为31.9个月和15.1个月 (p=0.032;HR=0.78)(3年 OS 率50% vs 42%)。3年累积复发率为34% vs 45%。
Pratz等使用7+3+吉瑞替尼治疗36例新诊断 FLT3 突变 AML 患者,CR 率为83%,3年 OS 率为50%(≤60岁患者中为60%)。欧洲和美国正在进行2项比较7+3+吉瑞替尼与7+3 +midostaurin的随机研究。
在真实世界中的几项历史比较也证实加入 FLT3 抑制剂在 FLT3 突变 AML 中的获益。
FLT3 突变 AML 患者进行异基因 HSCT 后索拉非尼或吉瑞替尼维持治疗可降低复发率并改善OS,尤其是对于 HSCT 期间 PCR-NGS MRD 阳性的患者。
最近的一项重要研究将284例FLT3野生型患者(年龄范围18–70岁)2:1随机分配至7+3联合quizartinib组 (n=180) 或7+3联合安慰剂组 (n=93),显示加用quizartinib改善OS:2年发生率为63% vs 47%(p=0.004)。该研究的研究者随后确定具有FLT3 样基因组标记物(50%的患者)可获益于加用quizartinib,显示OS、RFS和 EFS 改善。如果 FLT3 样标记物可以简化并重现,且报告的结果得到确认,那么不但占比25–30%的 FLT3-ITD AML 患者会从quizartinib(可能还包括其他 FLT3 抑制剂)中获益,还会导致高达60–65%的患者(包括具有 FLT3 样特征的患者)会获益。在该“FLT3样”人群中,强化疗+ quizartinib是否会带来优于强化疗+维奈克拉的结局获益则是一个重要问题。
虽然 FLT3 抑制剂已成为 FLT3 突变 AML 的标准治疗(通常为联合治疗),但一些非靶向策略也同样改善了该 AML 亚组的结局,包括含大剂量阿糖胞苷、克拉屈滨、大剂量柔红霉素和 GO 的化疗方案。
强化疗联合IDH抑制剂
Stein 等治疗151例de novo AML 和 IDH1/2 突变患者,使用7+3和艾伏尼布(IDH1突变AML;n=60)或enasidenib(IDH2突变AML;n=93)的患者(中位年龄62岁;范围24–73岁)。7+3+艾伏尼布组的 CR 率为70%,总缓解率为78%,3年 OS 率为67%;7+3+enasidenib组的CR率为57%,总缓解率为74%,3年 OS 率为61%。考虑到接受强化疗患者的中位年龄以及>1/3的患者为继发性AML,该结果令人印象深刻。HOVON和德国研究小组已经完成了一项3期随机安慰剂对照研究,比较7+3联合或不联合艾伏尼布/enasidenib治疗年轻/fit AML。
强化疗联合menin抑制剂
MLL/KMT2A重排和NPM1突变AML是由HOX基因表达升高所驱动,HOX基因依赖于menin-KMT2A相互作用,这种异常的基因表达可以通过破坏menin与KMT2A的结合来逆转。临床前研究证实了menin抑制剂对多个亚群的疗效:KMT2A重排、NPM1突变、NUP98融合,以及可能的HOXA9/MEIS1特征。正在开发的menin抑制剂包括revumenib、 ziftomenib、bleximenib和enzomenib。单药1-2期研究证明了多种menin抑制剂的疗效,总缓解率为40-50%。但也存在分化综合征引起的严重副作用(导致多器官衰竭和偶见死亡),需要中断/减少剂量,并使用减细胞治疗(羟基脲、阿糖胞苷)和类固醇。单药menin抑制剂的反应通常短暂,持续3-12个月,耐药通常与MEN1基因获得性体细胞突变有关(40%的病例检测到低水平;通常为M327和G331),它们阻碍menin抑制剂与W346残基(结合的关键)的相互作用。化疗联合使用menin抑制剂的研究正在迅速兴起,并取得令人兴奋的结果。menin抑制剂联合氟达拉滨/大剂量阿糖胞苷、7+3和低强度治疗的研究正在进行,menin抑制剂也在急性淋巴细胞白血病中评估(ALL型化疗)。期待这些研究的更成熟结果,以阐明其有效性和持久性、副作用、耐药机制以及新型menin抑制剂克服MEN1突变耐药的能力。
老年急性髓系白血病患者(或不适合强化疗的年轻患者)
强化疗
虽然AML患者的中位年龄为68-70岁,但大多数接受7+3和其他强化化疗方案的患者年龄≤60岁,虽然疗效不佳,但它们在社区实践中是可接受和重复的。例如,在Lowenberg等的研究中,在813例选择的≥60岁(中位年龄67岁)的患者中评估7+3(柔红霉素每日45 mg/m2对比90 mg/m2 x 3),中位生存期仅为7-8个月,3年OS率为20%,早期死亡率为11-12%。在MD安德森,既往在老年患者(60-65岁或以上)中使用的强化疗方案的CR率为40-50%,4-8周死亡率为26-36%,中位生存期为4-6个月(1年生存率<30%)。多因素显示分析显示,与强化疗早期死亡独立相关的因素为:年龄≥75岁;复杂核型(3+个染色体异常);既往血液病;体能状态差(ECOG 2~4分);血肌酐>1.3mg/dl;在受保护环境外进行治疗。当有0~1个不利因素时,预期8周死亡率为10~19%,有2~5个不利因素时为36~65%。SEER 2010-2017年的数据可反映社区实践,60-69岁患者的4周死亡率为24%,5年生存率为18%。在70岁以上(占所有AML患者的45%)的患者中,4周死亡率为44%,5年生存率仅为4%。虽然在2000年之前,7+3仍是标准治疗,但支持治疗/临终关怀是超过2/3患者的常见推荐,然而这两种方案都不佳。
如今老年AML可能是最难治疗的白血病:患者有多种合并症(心肺、肝肾功能障碍;高血压;糖尿病);体能状态差;无法耐受强化疗;疾病生物学(复杂核型、TP53突变和继发性/治疗相关AML的高发)对当前标准强化疗耐药。那么解决方案是什么?
表观遗传学和低强度治疗
在20世纪90年代,低强度策略成为老年/unfit AML的潜在治疗方法,包括小剂量阿糖胞苷、HMAs和靶向疗法(单抗,FLT3抑制剂和IDH1/2抑制剂)。那么问题来了:年轻/fit与老年/unfit AML怎么定义?
在临床实践中,肿瘤科医师经常使用“眼测量法”(根据直觉、经验和对患者病情的感知对患者进行评估和主观决策)。在MD 安德森,使用早期死亡风险模型(见于Sasaki K, Ravandi F, Kadia T, DiNardo C, Borthakur G, Short N, et al. Prediction of survival with intensive chemotherapy in acute myeloid leukemia. Am J Hematol.2022;97:865–76.和Sasaki K, Ravandi F, Kadia TM, Borthakur G, Short NJ, Jain N, et al. Prediction ofsurvival with lower intensity therapy among older patients with acute myeloid leukemia. Cancer 2023;129:1017–29)来选择不适合强化疗的老年患者,且认为10%以上的早期死亡率对于强化疗来说太高。在低强度治疗中加入维奈克拉相对于强化疗可能会产生相同或更好的疗效,不仅是在老年/unfit AML中,而且还是在老年AML中(不考虑fitness)。未来的一个重要问题在于,在特定的年轻患者中,这种低强度联合方案(低强度化疗+一种或多种靶向治疗)可否取代强化疗方案。
小部分无发热且胸片正常的患者可能在CT扫描中出现明显异常(例如感染、体液超负荷、出血、提示真菌性肺炎或其他病理的结节性病变)。合并肺炎或其他诊断时肺部病理的AML患者接受强化疗后诱导死亡的风险更高。治疗前常规胸部CT有助于更客观地决定治疗方案,此外治疗前测量心脏射血分数 (超声心动图、心脏扫描)可评估潜在的心脏合并症(低射血分数),从而偏向于减低强度治疗而非强化疗。
历史上,老年AML患者(年龄≥70岁)通常接受姑息或临终关怀。MRC AML14随机研究显示,与羟基脲/支持治疗相比,低剂量阿糖胞苷20mg每日两次皮下注射x 10天与更高的CR率 (18% vs 1%;P=0.00006)和较长的生存期(优势比0.60;P=0.0009) 相关。这项研究传递了一个重要的信息,即有效的抗AML治疗可以降低早期死亡率并延长生存期,即使在历史上认为只适合临终关怀/支持性护理的患者中也是如此。1992年,MD安德森开始开发白血病表观遗传学治疗的概念,在研究者发起的研究中重新使用地西他滨的概要计划。在21世纪,HMA的单臂和随机研究(地西他滨,阿扎胞苷)在较高危MDS和老年/unfit AML中均显示出获益。在老年AML(患者≥65岁)的3期随机研究中,地西他滨每日20mg/m2 IV x每月5次与支持治疗或低剂量阿糖胞苷相比,中位生存期为7.7个月和5个月(p=0.036),从而导致欧洲药品管理局(EMA)批准地西他滨用于治疗老年AML患者。阿扎胞苷(n=241)对比三种传统方案(n=247;小剂量阿糖胞苷、强化化疗、支持治疗)的III期研究也显示生存期较长(中位数分别为10.4个月和6.5个月;P=0.06;风险比0.85)。
延长地西他滨疗程(每日20mg/m2 x 10)也在探索,包括HMA联合靶向治疗(维奈克拉;FLT3、IDH和menin抑制剂;CD123抗体药物偶联物;其他)的两药方案和三药方案也有探索。一种高可吸收性的地西他滨口服制剂联合口服cedazuridine (胞嘧啶脱氨酶抑制剂,口服联合方案生物等效于静脉注射地西他滨)已获批作为MDS和CMML肠外HMA治疗的替代方案。口服地西他滨联合其他口服靶向治疗提供了未来全口服联合方案的可能性(例如口服地西他滨+维奈克拉+其他口服靶向药),包括一线和挽救治疗这些疗法可以在门诊提供,从而改善患者生活质量并降低与住院治疗和频繁就诊相关的费用。口服地西他滨(以及可能很快出现的高吸收性口服阿扎胞苷)必须与目前批准的口服阿扎胞苷(吸收率仅为10%~15%;批准剂量为300mg每日两次x 14天,每月)相区分,后者仅适用于无法接受异基因造血干细胞移植或无法完成全治愈性巩固治疗的首次CR期AML患者的维持治疗(稍后讨论)。
在发现HMA-维奈克拉方案对AML的疗效之前,MD安德森研究人员开发了“三核苷(triple-nucleoside)”低强度方案,在老年AML中显示出良好的疗效和安全性。该方案联合了腺苷核苷类似物(氯法拉滨或克拉立滨)和小剂量阿糖胞苷,并交替使用地西他滨。在接受治疗的248例患者中(中位年龄69岁;范围48-85岁),总有效率为66%,早期(4周)死亡率为2%,中位OS为12.5个月,2年OS为29%;在正常核型AML中,中位OS为19.9个月,2年OS率为45%。其他研究者也报道了该方案在AML一线和挽救治疗(后者使用维奈克拉)中的获益。如今维奈克拉也加入该联合方案,即所谓的“三核苷-维奈克拉”(triple nucleosides- 维奈克拉)低强度方案(稍后讨论)。
去甲基化药物+维奈克拉治疗老年/unfit AML
治疗白血病的一种靶向治疗策略涉及活化细胞凋亡的内在或线粒体通路,由BCL2蛋白家族调节,该通路涉及促凋亡蛋白(Bak、Bax)和抗凋亡蛋白(BCL2、BCL-XL、MCL-1)之间的动态平衡。在平衡状态下,抗凋亡蛋白结合并隔离促凋亡蛋白,从而阻止它们触发细胞凋亡。抗凋亡蛋白在许多癌症中过度表达,包括白血病。小分子“BH3模拟物”可以结合BH3结构域的抗凋亡蛋白并释放促凋亡蛋白。早期的BH3模拟物能有效结合多种抗凋亡蛋白,但具有不可接受的毒性,包括血小板减少症。
维奈克拉 (BCL2抑制剂)是一种选择性更高的BH3模拟物,保留对BCL2的亲和力,但对BCL-XL或MCL-1没有亲和力,彻底改变了慢性淋巴细胞白血病的治疗,目前正在其他肿瘤(ALL、MDS和CMML、淋巴瘤和骨髓瘤亚群)中进行研究。AML细胞和干细胞依赖BCL2存活,但正常造血干细胞依赖MCL-1存活,从而提出了研究维奈克拉在AML中的基本原理。临床前研究证实维奈克拉具有抗AML活性。维奈克拉单药治疗难治性复发AML的研究仅显示出适度疗效,但HMA-维奈克拉单臂一线联合治疗的研究显示出很高的疗效,因此开展了3期随机研究,最终监管部门批准该联合方案治疗老年/unfit AML。
VIALE-A关键研究以2∶1的比例随机分配431例老年/ unfit AML患者(≥75岁;或不适合接受强化疗的患者)分别接受阿扎胞苷联合维奈克拉(n=286)或阿扎胞苷(n=184)治疗。加用维奈克拉与显著较长的生存期相关(中位生存期14.7个月vs . 9.6个月;p<0.001),以及更高的复合缓解(CR/CRi)率(66.4% vs 28.3%;p<0.001)和CR率(29.7% vs 17.9%;P<0.001)。更长随访中,阿扎胞苷/维奈克拉组的3年生存率为25%,而阿扎胞苷组为10%。一项类似的随机研究(211例患者;2:1随机)对比低剂量阿糖胞苷联合维奈克拉与单独使用低剂量阿糖胞苷,中位生存期分别为8.4个月和4.1个月(p=0.04),总缓解率为48%和13% (p<0.001), CR率为27%和7% (p<0.001)。
MD安德森的一项单臂研究评估了10天的地西他滨和维奈克拉诱导(随后维持治疗,每月地西他滨5天联合维奈克拉14~21天)。在70例老年 (中位年龄72岁;范围70-78岁)新诊断de novo AML患者中,总缓解率(CR+CRi)为84%,CR率为67%,4周死亡率为0%,中位生存期为18.1个月。平均而言,地西他滨10天方案可能并不比5天方案提供更好的结局。
最初的HMA-维奈克拉研究使用连续28天的维奈克拉方案,但许多患者需要将维奈克拉持续时间减少到14-21天,并且通常需要5-6周的G-CSF支持。最近的研究提示较短的给药方案(7~14日)可能同样有效,且毒性较小,从而可以使三联方案的设计更加安全(稍后讨论)。
“三核苷类”联合维奈克拉的低强度治疗
目前在MD安德森中心进行的一项针对老年(和年轻unfit)AML的一线研究探讨了克拉屈滨-阿糖胞苷-维奈克拉交替阿扎胞苷(或地西他滨)-维奈克拉的三核苷联合方案。在接受治疗的141例患者中(中位年龄68岁;范围47-84岁),103例(73%)达到CR, 120例(85%)达到CR- CRi,93例(78%)患者达到MRD阴性。2例患者(1%)在诱导治疗后4周内死亡,4例患者(3%)在8周内死亡。4年生存率为52%,接受异基因HSCT的患者为79%,未接受异基因HSCT的患者为42%。
这里需要注意的是,将HMA确立为老年/unfit AML的合理治疗方案花了20多年的时间,从HMA单药治疗转向HMA-维奈克拉联合治疗,并讨论强化疗与低强度治疗的价值也花了10多年的时间;虽然后者是目前的标准治疗,但效果不佳(3年生存率为25%)。目前已经开始尝试探索克拉屈滨/低剂量阿糖胞苷+/-维奈克拉方案(不联合HMA-维奈克拉)。三核苷维奈克拉方案尚未在MD安德森以外进行研究,希望不要再花长达十年的时间来建立或拒绝将其作为AML的治疗方案。
二药方案与三药方案的比较
HMA与FLT3或IDH抑制剂的两药组合显示出良好效果,临床前研究也报告了FLT3抑制剂和维奈克拉联合使用的协同效应,从而导致了HMA、维奈克拉和FLT3抑制剂的三药方案。在30例新诊断FLT3突变老年AML患者(中位年龄71岁)中,联合阿扎胞苷(7天诱导,5天巩固)、维奈克拉(14天诱导,7天维持)和吉瑞替尼每天80mg(14天诱导;80 mg每天维持治疗),CR率为90%,应答者的MRD阴性率为93%,1.5年生存率为72%。该方案具有骨髓抑制作用,需要将维奈克拉-吉瑞替尼的诱导天数限制为14天,将维持治疗中维奈克拉减少至7天/周期,并将吉瑞替尼剂量调整为每天80mg。未来的挑战在于开发潜在的更有效的四药方案,这些方案可以安全给药,并将HMA-维奈克拉与FLT3和IDH抑制剂/menin抑制剂/CD123抗体/NK抗体或NK细胞治疗结合起来。如果研究继续提示,在这些联合用药中7天维奈克拉与长疗程维奈克拉同样有效,则上述挑战有可能实现。
HMA和IDH抑制剂联合治疗一线老年AML已显示出令人鼓舞的结果。虽然HMA-维奈克拉联合治疗IDH2突变AML特别有效,但在IDH1突变AML中艾伏尼布可能优于维奈克拉。在IDH2突变AML的VIALE-A亚组分析中(40例阿扎胞苷-维奈克拉组,18例阿扎胞苷组),阿扎胞苷-维奈克拉组中位OS为27.5个月,而单独阿扎胞苷组为13.0个月(p<0.05)。相比之下,阿扎胞苷-enasidenib对比阿扎胞苷的随机研究(2:1随机,非盲)显示中位OS没有差异,联合治疗的中位生存期为22个月,阿扎胞苷为20个月。在IDH1突变AML的VIALE-A研究亚组分析中(23例阿扎胞苷-维奈克拉, 11例阿扎胞苷),长期随访显示维奈克拉组的中位OS仅为10.2个月,而阿扎胞苷组为2.2个月。在AGILE研究中,146例老年/unfit IDH1突变AML患者(中位年龄76岁)随机(1:1)分配到阿扎胞苷-艾伏尼布(n=72)或阿扎胞苷(n=74)组,CR率分别为47%和15% (p<0.0001),中位生存期分别为29个月和7.9个月(p=0.001)。
HMA联合维奈克拉和IDH抑制剂的三药方案正在进行中,并产生令人兴奋的结果。在一项口服地西他滨、维奈克拉和相应DH1/2抑制剂的研究中,在接受治疗的新诊断IDH突变AML患者中(IDH1突变10例,IDH2突变14例),CR率为90-100%,MRD阴性率为80-93%,1.5年生存率为75%。在这些治疗方案中,由于艾伏尼布和维奈克拉的相互作用(艾伏塞尼布是CYP诱导药物,可降低维奈克拉的AUC),因此维奈克拉的剂量增加至每日600mg(在未使用唑类药物进行预防的情况下)。
对于老年患者(≥65岁)和不适合强化疗的患者(根据估计的高早期死亡率),应考虑采用低强度化疗策略,例如克拉屈滨联合小剂量阿糖胞苷并交替地西他滨 (为了方便,首选口服地西他滨)或阿扎胞苷,联合维奈克拉。其他以HMA+维奈克拉为基础的三联方案还包括FLT3抑制剂(如果FLT3突变)、IDH抑制剂(如果IDH突变)、menin抑制剂(如果KMT2A重排或NPM1突变)和其他靶向/免疫研究性药物(表4)。
Menin抑制剂——单药治疗之外
在KMT2A、NPM1突变和NUP98融合的老年AML中,一线研究正在探索menin抑制剂为基础的联合治疗的价值。一项研究评估了口服地西他滨、维奈克拉联合revumenib治疗KMT2A重排、NPM1突变或NUP98r融合的难治性复发AML(既往治疗中位数为3线),所有9例患者均获得缓解。该研究现在是治疗这些异常的老年AML的一线方案的一部分。另一项研究报告了26例新诊断KMT2A重排(35%)或NPM1突变AML(65%)患者(中位年龄70岁),患者接受每月7天阿扎胞苷、每天维奈克拉和每天113~163mg revumenib治疗。总体而言,18/26例(69%)患者达到CR, 23/26例(88%)患者达到复合CR, 22/26例(85%)患者为MRD阴性CR。1年OS为62%(复发3例;死亡6例)。第三项研究治疗了60例难治性复发AML患者(KMT2A重排50%,NPM1突变50%;既往中位2线治疗),患者接受阿扎胞苷(7天/月)、bleximenib (每天)和维奈克拉(每天)治疗。在接受bleximenib 50+mg每日2次治疗的34例患者中,27 /34(79%)患者总体缓解,14/34(41%)患者获得CR-CRh-I。
CPX-351在老年AML中的作用
CPX-351是一种双药脂质体胶囊,含有固定的阿糖胞苷和柔红霉素的摩尔比为5:1。基于继发性AML亚群的临床前和1-2期研究,一项针对新诊断继发性AML的关键3期研究将309例患者随机分配到CPX-351或7+3。CPX351治疗与显著较长的生存期相关(风险比0.69;p=0.005),且CR率 (38% vs 26%;p=0.035)和CR+CRi (48% vs 33%;P=0.016) 较高。在CPX-351后获得CR的患者更多接受异基因HSCT(20% vs 12%),移植后患者的生存期也较长。因此FDA批准CPX-351作为继发性AML的一线治疗药物。正在进行的研究正在研究CPX-351与维奈克拉、GO和其他靶向治疗的联合方案。
急性髓系白血病的维持治疗
虽然维持治疗是许多肿瘤(包括ALL)的既定方法,但直到口服阿扎胞苷(CC-486;吸收不佳;静脉阿扎胞苷AUC的 10~15%)才报道了AML中维持治疗的获益。QUAZAR AML-001研究纳入472例老年AML患者(≥55岁;中位年龄68岁)(处于首次CR期<4个月,不适合强化治疗策略[异基因HSCT,大剂量阿糖胞苷巩固治疗]),随机分配接受阿扎胞苷300mg每天口服x14个月(n=238)或安慰剂(n=234)治疗。口服阿扎胞苷组的中位生存期为24.7个月,而安慰剂组为14.8个月(风险比0.69;P=0.0009)。该研究导致其于2020年被FDA批准为该适应症的维持治疗。
HOVON97研究纳入116例强化疗后CR的老年患者(≥60岁),随机接受阿扎胞苷(每天50mg/m2皮下注射,x5天/月,共12个周期;N=56)或观察(N=60)。12个月的DFS率分别为64%和42% (p=0.04)。
在MD安德森,对于首次缓解期不适合异基因HSCT且预期预后不佳的患者,可接受HMA(通常为口服地西他滨)和维奈克拉的维持治疗。在一项正在进行的2期研究中,阿扎胞苷-维奈克拉治疗25例CR新诊断AML患者(不适合异基因HSCT),2年RFS率为65%。也可根据分子谱(目前为FLT3、IDH1/2和menin抑制剂)考虑其他靶向治疗。
FLT3突变AML异基因HSCT后使用FLT3抑制剂维持治疗 (特别是如果围HSCT期MRD阳性),或在其他患者中使用HMA+/-维奈克拉维持治疗,正在获得进展。HSCT后其他靶向药物维持治疗也正在研究中,如IDH和menin抑制剂或免疫治疗(如多次供者淋巴细胞输注或NK细胞治疗)。
将报道的结果转化为真实世界经验
SEER数据可反映美国社区实践的结果。一项对约29000例AML患者的SEER分析显示,患者结局比单中心和合作研究报告的结果更差,这可能归因于几个因素,如临床试验患者的精心选择(排除年龄较大的患者,接受过治疗的继发性AML患者,或体能不佳和器官功能障碍的患者),提供的方案类型(标准治疗对比试验性对照),支持性治疗基础设施和白血病专业知识。但SEER数据确实显示自2000年以来某些亚群患者预后有显著改善:APL(5年生存率约60%以上;在APL方案中加入ATRA和三氧化二砷);CBF AML(5年生存率50%以上;添加GO和大剂量阿糖胞苷以及PCR监测MRD);年轻患者(增加几种靶向治疗,改善支持性治疗措施)。然而,即使在较新的时代(2000-2017年),40-59岁de novo AML(不包括APL和CBF AML)患者的4周死亡率仍有27%,5年生存率为40%;此外≥70岁的患者4周死亡率为45-50%,5年生存率<5%。
与常见的实体瘤不同,AML是一种相对罕见的肿瘤,由于累及骨髓,可严重影响正常的造血功能,导致骨髓抑制以及危及生命的并发症,如感染和出血。AML的治疗较为复杂,特别是对年轻患者的强化治疗,需要长期的专业知识和对疾病和并发症的熟悉,以及及时提供支持性治疗措施。AML的特殊性要求使用三重抗生素预防;随时可获得输血;迅速提供熟练的应急设施;快速识别感染和败血症,以实施最佳广谱静脉注射抗生素;并在需要时及时使用重症监护病房。因此严重致病率、死亡率和放弃治疗的风险很高。
虽然长期以来人们一直认为,在肿瘤社区实践中,AML的治疗可以像在白血病专业中心一样得到最佳的治疗,但由于上述原因,实际情况可能并非如此。SEER数据和多项AML合作研究均报告了诱导治疗的早期死亡率(4周或8周),且在年轻和老年AML中都有显著差异。几项研究报告了在非学术中心与学术中心、非NCI指定与NCI指定的癌症中心治疗的患者早期死亡率有显著差异。在国家癌症数据库中,60738例AML患者的4周死亡率在学术中心为16%,在非学术中心为29% (p<0.001),5年生存率分别为25%和15% (p<0.001)。加利福尼亚的一项研究报告了7007例AML患者在NCI指定的癌症中心的早期死亡率为12%,而在非NCI指定的癌症中心的早期死亡率为24%。在MD安德森,年轻AML患者接受强化疗的早期死亡率低于5%,老年AML低强度方案的早期死亡率为1-2%。
由于上述情况(罕见性、骨髓损害、治疗强度、支持性治疗需求、累积的专业知识),以及快速发展的知识和治疗策略,AML可以在专门的白血病中心而非肿瘤社区实践中得到更好的治疗。
异基因和自体造血干细胞移植
早期的随机研究很难证明异基因造血干细胞移植在AML首次CR中的获益,原因包括:(1)每项研究的患者数量有限(可能没有检测到保守但显著的获益);(2)对异基因造血干细胞移植的前置时间偏见;(3)许多分配到HSCT的患者最终无法接受移植(由于感染、器官功能障碍、发病率、AML复发等原因);(4) 首次 CR 后分配至化疗组的患者可能从首次复发后接HSCT 中获益。一项针对多个随机试验的meta分析显示,平均而言,在首次缓解期进行异基因造血干细胞移植可显著提高患者生存期。MRC的一项研究报告称,当考虑到后续移植的获益时,化疗与异体造血干细胞移植在首次CR中的生存率相似。
异基因造血干细胞移植应视为首次CR(CR1)患者的最佳选择,具体包括:(1)患者并非低危AML(不包括CBF、没有其他高危突变的NPM1突变,以及随着时间的推移定义的其他低危亚群);(2)形态学CR但MRD持续的AML患者。此外随着维奈克拉, FLT3和IDH抑制剂的可用性,以及可能的其他靶向治疗(如menin抑制剂),异基因造血干细胞移植在首次缓解期的作用需要不断重新评估。移植可行性的其他考虑因素包括患者的年龄和合并症、供者的可用性、相合程度、移植中心的专业知识/HSCT结果以及患者意愿。
异基因造血干细胞移植并非一次性的独立操作,而是连续方案的一部分,在此过程中,医生需考虑化疗、靶向治疗、造血干细胞移植和造血干细胞移植后的维持治疗。异基因造血干细胞移植后正在评估多种策略以降低复发风险,包括HMA-维奈克拉、FLT3和IDH抑制剂、menin抑制剂、重复连续DLI和其他形式的免疫治疗。
在美国,由于在随机研究中缺乏显著获益,自体造血干细胞移植在很大程度上已被放弃用于AML(除了APL和第二次CR的CBF AML)。而在欧洲,其仍用作首次CR的多药化疗巩固的等效替代方案。最近更新的PETHEMA西班牙数据显示,1300例首次CR的AML患者接受自体SCT (n=658)或进一步化疗(n=652),自体SCT对年轻患者(<65岁)有获益,中位OS为153个月 vs 71个月(HR=0.72;P=0.02)。应认识到,基于最近更深入的MRD检测方法(NPM1和FLT3突变的PCR-NGS),发现许多先前输注的自体细胞被AML残留疾病所污染,可能导致复发,未来的研究可能会探索输注MRD阴性自体HSCT,作为多药化疗巩固-维持或异基因HSCT的替代方案。在MD安德森,自体造血干细胞移植仍偶尔考虑用于第二次CR的APL和CBF AML以及采集的干细胞为分子学MRD阴性。
挽救治疗
在难治性复发AML中有多种挽救疗法,其成功率/治愈率取决于具体情况,包括AML类型、既往治疗、既往HSCT、首次CR持续时间和难治性的定义。
APL的挽救治疗(使用较长时间的ATRA和三氧化二砷±化疗或自体造血干细胞移植)具有高治愈率。对于CBF-AML(使用氟达拉滨/大剂量阿糖胞苷、GO、自体或异基因造血干细胞移植)和首次CR持续时间较长(2-3年)后复发的AML,挽救治疗后的治愈率也可能较为显著。
非APL/CBF挽救治疗的结果在很大程度上取决于具体情况。例如,患者有时根据D14-21骨髓检测结果标记为难治性AML(7+3治疗后疾病持续存在),这些患者可能有残留疾病,对治疗有反应,并在后续骨髓分析中消退,或者可能对挽救治疗和后续异基因SCT有反应。首次CR后2年以上复发的患者通过有效的挽救治疗治愈率为30-50%。相比之下,对一线药物FLAG-IDA-维奈克拉或CLIA-维奈克拉耐药的患者,或7+3后复发且首次CR持续时间< 6-12个月的患者,治愈率为20%或更低。
部分患者复发时伴有可靶向克隆(FLT3-或IDH突变AML),这可能在先前的治疗方案中没有得到解决。联合靶向治疗加上标准化疗,再加上异基因造血干细胞移植,也可能产生合理的治愈率。因此有必要在复发时重复基因组分析,因为克隆选择在治疗耐药期间很常见,并且可能出现在初始诊断时不明显的耐药新克隆(例如新的FLT3、IDH1/2或BCR::ABL1克隆)。
有一个经常被遗忘的经验,那就是对于活动性疾病,当AML负荷最小(骨髓原细胞<20%)时,异基因造血干细胞移植是挽救AML的最佳治疗方法,该策略可能带来的治愈率为10-20%。但是移植专家不喜欢这样的几率,并且经常拒绝这些患者进行异基因造血干细胞移植,除非他们能达到CR/MRD阴性状态(通常几乎不可能),原因在于相关的治愈率低/死亡率高。接受这样的病人可能会玷污移植中心的声誉(并导致其被排除在保险网络之外)。
AML挽救治疗中更常见的情况是,患者在接受有效的一线治疗后成为真正耐药的AML,患有高危疾病(复杂核型、TP53或其他不良突变),无可靶向突变,首次CR持续时间短。这样的病人可能是试验性治疗的良好候选人,或者合理地提供支持性/临终关怀。
基于上述讨论,AML的挽救治疗的选择取决于多种因素:患者的年龄和意愿、合并症、挽救状态、既往治疗、既往缓解持续时间、既往暴露于异基因造血干细胞移植、白血病特征以及试验性治疗的可用性。由于AML专家和白血病专业中心在AML挽救治疗方面有不同的指导方针和路径,作者下文把讨论限制在MD安德森,并讨论了已批准的治疗方法。
复发患者应评估新出现的或持续性可靶向的突变或畸变,以给予新型治疗(FLT3、IDH1/2或menin抑制剂),如果发现这些突变/异常(FLT3突变、IDH1/2突变、易位11q32、NPM1突变、NUP98融合),则考虑患者采用包含相应靶向策略的试验性联合方案,例如HMA-维奈克拉-FLT3抑制剂、HMA-维奈克拉-IDH1/2抑制剂、HMA-维奈克拉-menin抑制剂。
对于7+3方案无效或复发的年轻/fit AML患者,挽救治疗取决于首次CR的持续时间。如果少于1年,可给予基于HMA-维奈克拉的方案,并结合额外的试验性药物(抗体等)。如果时间超过1年,可给予FLAG-IDA-维奈克拉或CLIA-维奈克拉的强化疗。包括MD安德森的一些研究在内的多项研究表明,这些方案可以产生高CR率,可以安全地桥接异基因造血干细胞移植,并提供合理的治愈机会。第二次或以上挽救治疗的患者则提供1-2期试验性方案,或支持性护理/临终关怀。
所有达到后续CR或甚至持续微小病变(骨髓原细胞<20%)的患者应立即接受异基因造血干细胞移植,但也应认识到该操作的潜在低治愈率和风险,包括高死亡率和复发风险。
来自德国的一项有趣的研究引起了很多人的兴趣。这项3期研究纳入281例AML患者(中位年龄61岁;范围18-75岁),这些患者对一个疗程的一线强化疗耐药(n=183;在7+3治疗后14-28天可能富集残留敏感性疾病患者)或首次复发(n=98),随机分为强化疗(米托蒽醌加大剂量阿糖胞苷)再诱导序贯缓解期(n=141)进行异基因造血干细胞移植,或“疾病控制”和立即进行异基因造血干细胞移植(n=140)。研究显示两组的结果相似:4年生存率分别为49%和46%。但应注意的是,立即异基因造血干细胞移植组在第-12天至第-9天接受了氟达拉滨、大剂量阿糖胞苷和amsacrine (FLAMSA)的额外治疗,随后接受了基于氟达拉滨-烷化剂的低强度预处理及后续造血干细胞移植(本质上是双重强化/消融方案)。沿着这些思路,MD安德森正在研究一种序贯强化疗方案,应用异基因造血干细胞移植(使用单倍体相合供者[更容易获得,延迟更少]),通常在骨髓再生障碍(aplasia)时(化疗第21-35天),而非在达到CR后(概率较低;大多数情况下<10-20%)。
扩展AML
使用抗体靶向AML表面分子
靶向表面分子CD33、CD123、CD70、CLL1(或CLEC12a)、TIM3、WT1等的抗体可能具有抗AML疗效。这些抗体可能是非偶联、偶联免疫毒素或将杀伤CD3 T细胞或NK细胞定向到不同的AML表面标志物的双特异性抗体。未偶联的单克隆抗体显示很少或没有获益,而偶联免疫毒素的单克隆抗体已显示出良好疗效;例如,靶向CD33的GO;靶向母细胞性浆细胞样树突状细胞肿瘤 (BPDCN) 中CD123的tagraxofusp (SL401)和pivekumab sunirine (IMGN632)。pivekumab sunirine或tagraxofusp联合标准化疗正在AML中评估。50例老年/unfit AML患者接受pivekumab sunirine和阿扎胞苷-维奈克拉治疗,54%达到CR,综合CR率为68%。
研究还在评估使用靶向AML表面抗原的抗体递送放射性同位素,其中最先进的是使用靶向CD45的抗体(如Iomab-B或90Y-BC8-DOTA)。由于CD45在造血系统中普遍表达,靶向CD45可能导致显著的骨髓消融,因此这些研究是在适合移植患者中作为HSCT预处理的一部分进行的。一项正在进行的随机3期研究正在评估在复发难治性AML HSCT之前给予Iomab-B与研究者选择的挽救治疗的疗效。
双特异性T细胞衔接器(BiTE)抗体构建招募CD3效应T细胞或NK细胞靶向AML细胞(CD33、CD123、CD70),包括AMG330、AMG673、AMG427、XmAb14045、AMV564、SAR443579 (CD123-NK衔接器)等。有几种显示出一定疗效(缓解率为20%至30%),但伴有严重的副作用(细胞因子释放综合征伴发热)。它们可能最终在CR伴MRD阳性疾病中显示出良好的AML获益。
CAR-T细胞治疗AML
免疫治疗的巨大成功(包括检查点抑制剂治疗实体瘤;CAR-T细胞疗法治疗ALL、淋巴瘤和骨髓瘤中)引起了人们对开发类似的AML免疫疗法的兴趣。检查点抑制剂的研究没有显示出改善的疗效,并且与严重的毒性(器官“炎”)相关。自体和异基因CAR-T细胞(靶向CD123、CD33和CLL1)以及NK细胞疗法的试验正在进行中,但到目前为止,其在AML中的多项研究均未产生明确的积极趋势。
总结
在2016年和2021年的前两次AML审查中,当时作为有希望的试验性疗法在2024年已经临床用于一线和后线AML的治疗,并作为标准治疗:GO、维奈克拉、FLT3抑制剂(midoschurin、吉瑞替尼、quizartinib)、IDH抑制剂(艾伏尼布、enasidenib、olutasidenib)、口服地西他滨和口服阿扎胞苷;但其他药物则被搁置,正如在癌症研究中预期的那样(APR246、magrolimab)。然而出乎意料的是,其他一些药物正在迅速涌现,例如有前途的新型menin抑制剂(目前仍处于研究阶段)。总体而研究,大量的阳性数据将继续改变年轻和老年AML患者的新治疗标准(诱导、巩固、造血干细胞移植、维持),正如开头所说的,很多研究一发表就已经过时;这句话很像之前一篇文章的描述“CAR T 细胞和 T 细胞重定向治疗研究中新数据的快速出现率,使得综述文章几乎在发表时就已经过时”。
参考文献
Kantarjian H, et al.Current status and research directions in acute myeloid leukemia.Blood Cancer J . 2024 Sep 19;14(1):163. doi: 10.1038/s41408-024-01143-2.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#CAR-T# #血液恶性肿瘤#
75