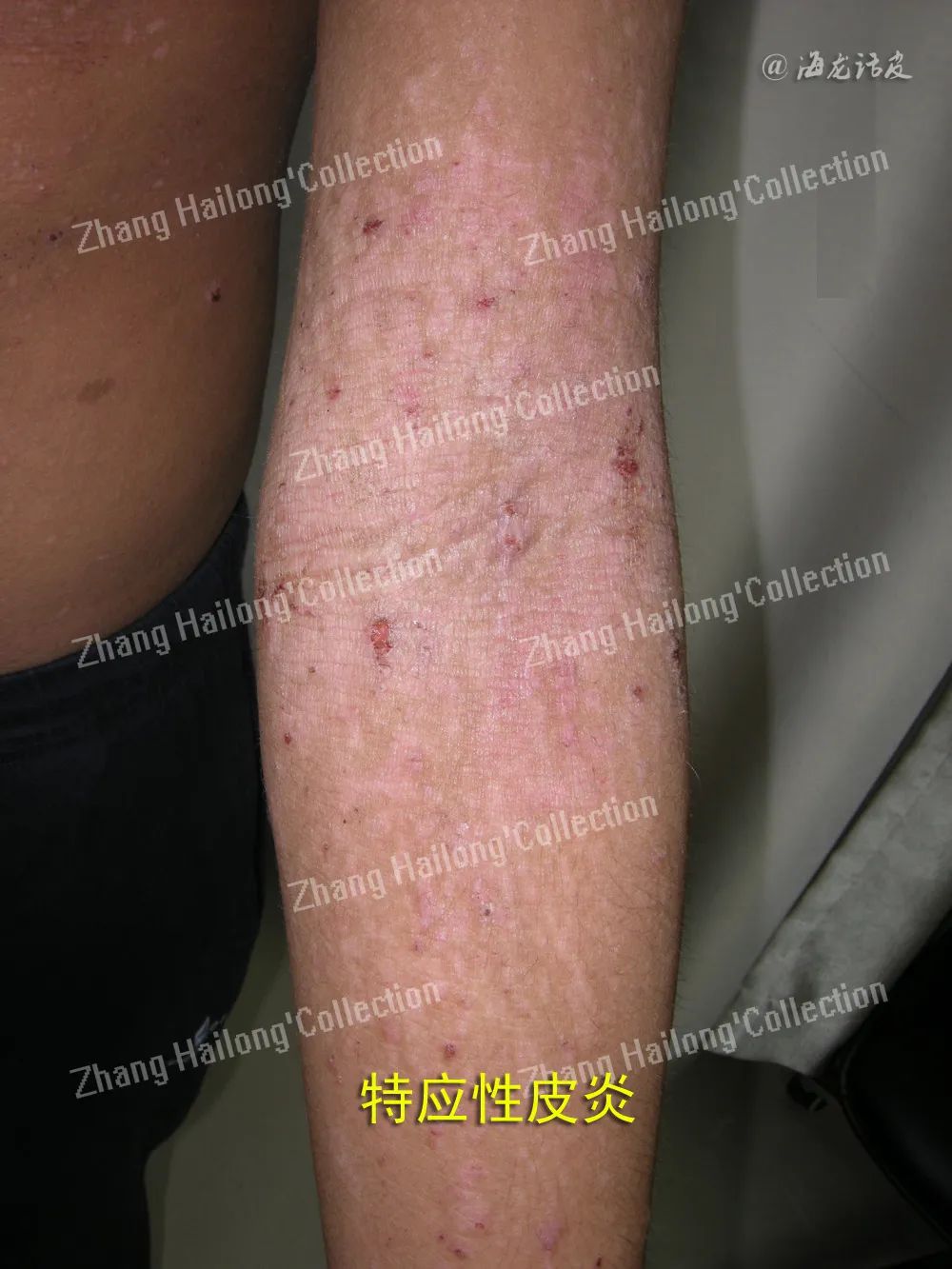
特应性皮炎(湿疹)最新治疗进展
2024-05-07 海龙话皮 海龙话皮 发表于上海
特应性皮炎(AD)是一种慢性、复发性、炎症性皮肤病,常伴有其他特应性表现,可同时对儿童及成人造成影响。多项研究表明,AD患者的疾病负担较重, 对公共卫生有重要影响。
特应性皮炎(AD)是一种慢性、复发性、炎症性皮肤病,常伴有其他特应性表现,可同时对儿童及成人造成影响。多项研究表明,AD患者的疾病负担较重, 对公共卫生有重要影响。目前国内外大量研究表明,AD的发病机制涉及皮肤免疫炎症、皮肤屏障和皮肤菌群,提出表皮通透屏障功能受损是AD发病机制中的重要环节。因此,修复和保护皮肤屏障功能,维持皮肤微生态平衡对AD的治疗尤为重要。
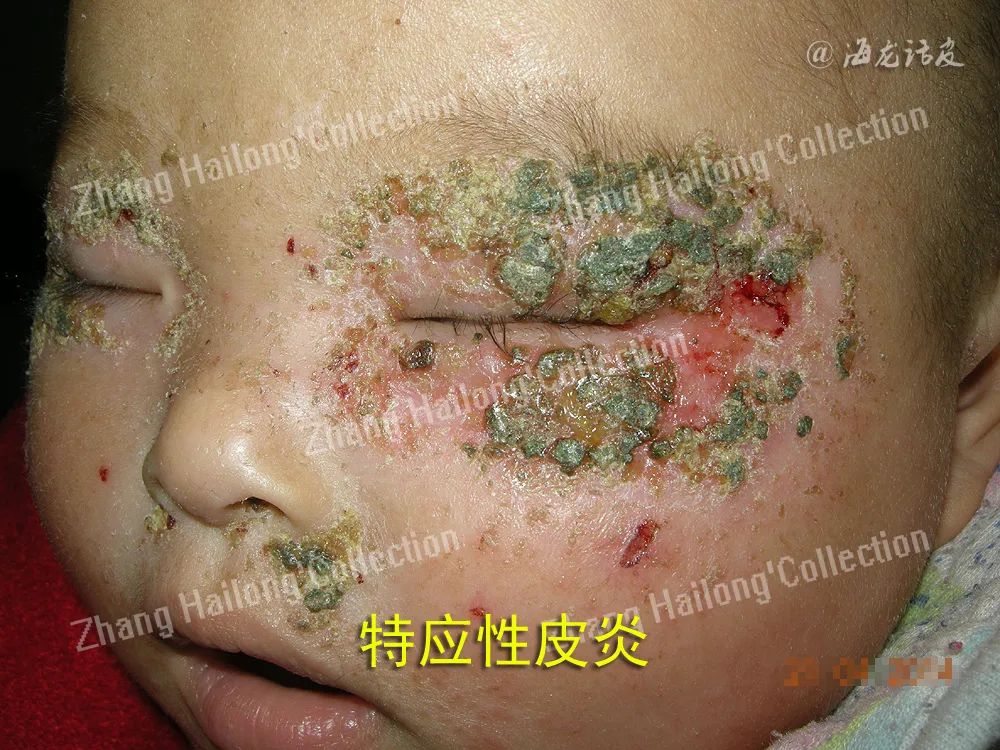
对于轻至中度患者而言,在基础治疗的基础上,可以采用外用药物和口服抗组胺药等进行治疗。而对于中重度患者,则可以选择系统治疗。其中,一些创新疗法以生物制剂为代表,取得了重要的进展,能够有效抑制2型炎症,有助于患者实现长期的病情控制。同时天然药物的挖掘和开发也越来越受到关注,将为AD患者的治疗提供更多选择。
一
AD的流行病学特征
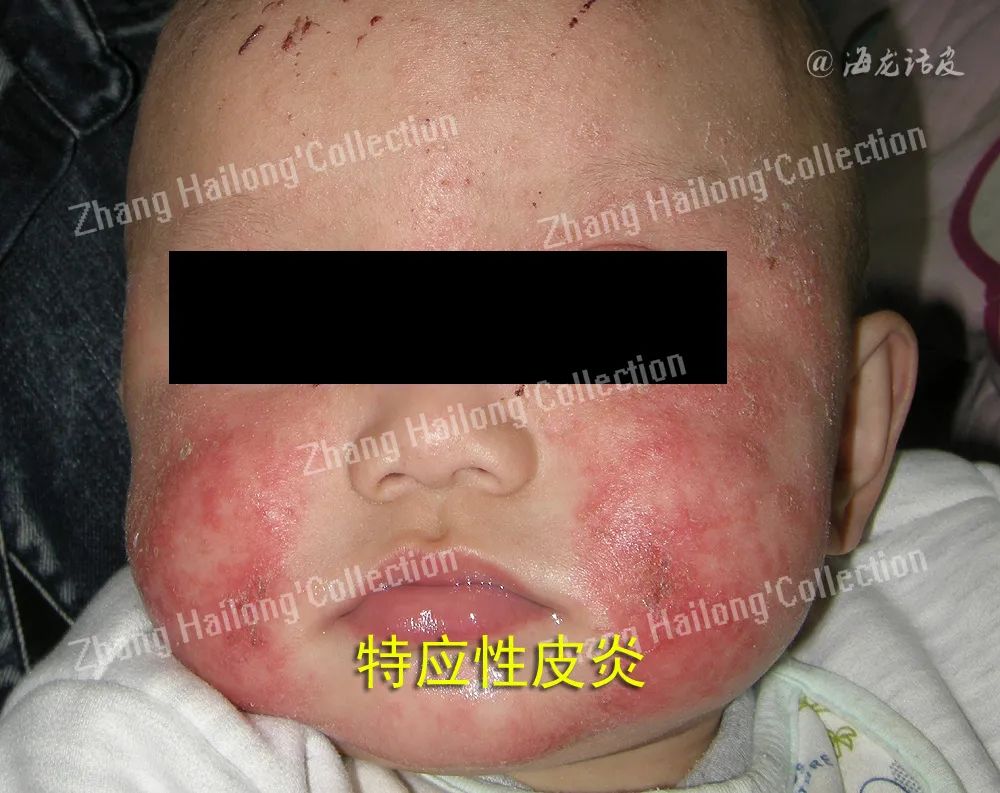
近30年来,AD的患病率和发病率一直呈上升趋势。根据全球疾病负担的研究显示,AD的儿童患病率为15%~20%,成人患病率最高为10%,根据失能调整生命年计算,AD是第15位最常见的非致死性疾病,也是皮肤病中疾病负担最高的一种。研究表明,约80%的病例通常在婴儿期或儿童期发病,其余的则在成年期发病。AD在自然病程中表现出高度的异质性,个体发病轨迹难以预测。此外,瘙痒是AD的标志性症状,瘙痒强度与疾病严重程度大致对应。
二
AD的发病机制
虽然AD的确切发病机制尚未完全阐明,但随着对皮肤病理生理的探索,学界普遍认为2型炎症是AD发病与进展的关键机制。免疫平衡异常、皮肤屏障功能障碍、皮肤菌群紊乱等因素是AD发病的重要环节。“瘙痒-皮肤保护伞损伤-免疫异常”三者相互影响,反复搔抓导致皮肤炎症加重,免疫反应失衡也会使炎症加剧,诱发搔抓行为,使保护伞进一步受到损害,从而引起皮肤炎症的发生。AD发病机制中的免疫异常是指辅助性T细胞(Th)1/Th2细胞因子分泌失衡。Th1/Th2可通过分泌各种细胞因子,相互制约,相互影响,维持免疫的动态平衡。当Th1/Th2 细胞因子分泌失衡,Th2会产生过多的细胞因子,影响皮肤修复,诱导疾病活跃(图1)。
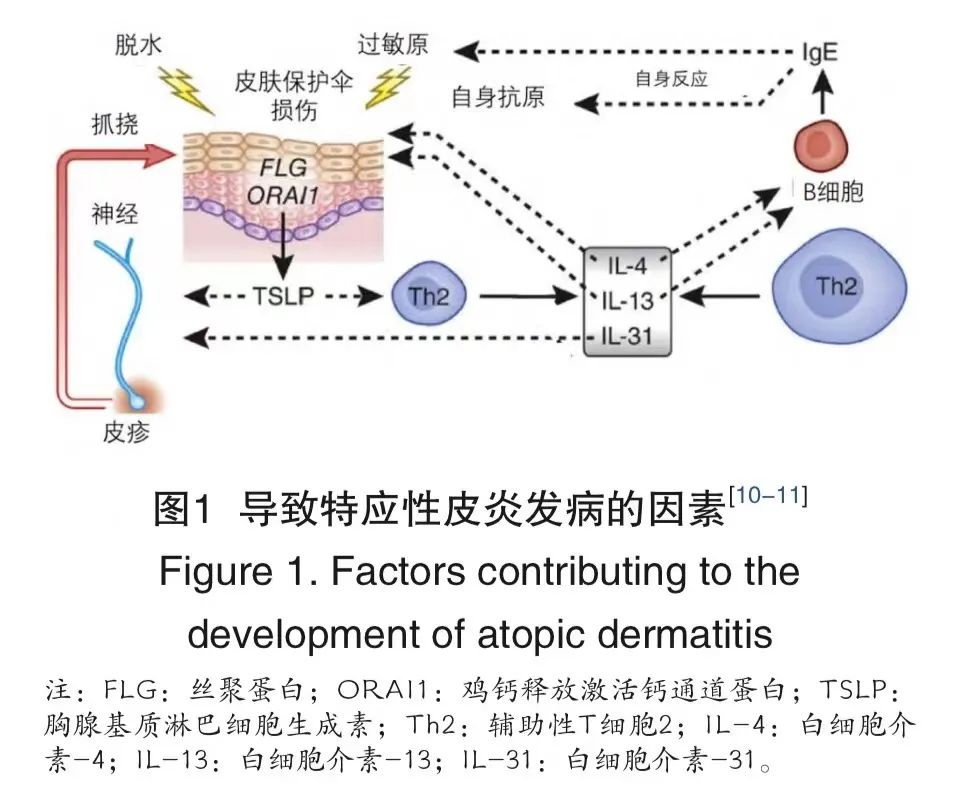
1、白细胞介素-4/13:
在AD的发病机制中,白细胞介素(interleukin,IL)-4和 IL-13可通过IL-4受体亚单位-α(IL-4Rα)刺激,诱导B细胞中免疫球蛋白类别转化为免疫球蛋白E(immunoglobulin E,IgE),并传入神经元,促使瘙痒发生。AD发病的根源在于皮肤保护伞损伤和免疫反应异常。丝聚蛋白(filaggrin,FLG)基因突变会引起皮肤保护伞损伤和皮肤脱水,使外界过敏原侵入皮肤内。皮肤损伤后释放大量胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP),造成Th2异常,IL-4和IL-13释放过多。此外,IL-4和IL-13促进IgE生成,导致疾病加剧,干扰FLG基因功能,影响皮肤修复能力。通过抑制IL-4/IL-13信号通路可影响AD的发生和发展。
2、IL-31:
IL-31是一种神经免疫细胞因子,能驱动结节性痒疹和 AD等多种疾病机制,同时也直接作用于皮肤结构细胞,具有直接刺激瘙痒相关感觉神经元并导促炎症和屏障功能障碍的独特作用。有证据显示,IL-31在AD病变中明显升高,IL-31Rα在皮肤感觉神经元胞体所在的背根神经节(dorsal root ganglion,DRG)上大量表达。IL-31能增强脑源性利钠肽(brain-derived natriuretic peptide,BNP)在皮肤细胞中DRGs的表达和释放,促进皮肤细胞的细胞因子和趋化因子释放,从而协调与瘙痒有关的信号通路。抑制外周BNP功能可能是治疗AD和瘙痒症的新策略。
3、IL-17:
IL-17是一种主要由CD4+Th17细胞和先天性淋巴样细胞亚群分泌的促炎细胞因子,家族包含IL-17A至IL-17F等6种结构相关的细胞因子,其中IL-17A和IL-17F主要由 Th17细胞产生,可促进炎症反应的发生,在自身免疫性疾病、炎症、肿瘤以及移植排斥反应中发挥重要作用。同时,IL-17又是角质形成细胞增殖的主要驱动因素。IL-17表达提升常在急性AD患者中被观察到。另外,IL-17A可通过降低FLG,导致皮肤屏障功能障碍,从而影响角质细胞黏附分子的表达。因此, 抑制IL-17是治疗AD的一种潜在方法。
4、IL-22:
IL-22由活化的T细胞,主要是Th22和Th17细胞表达, 其受体由IL-22R1和IL-10RB组成。最近的研究表明,在AD病变中IL-22表达上调。首先,IL-22上调促炎分子 S100A7、S100A8和S100A9的表达。其次,IL-22通过下调参与终末分化的基因,诱导角质形成细胞分化缺陷和棘层增厚。最后,IL-22促进胃泌素释放肽(gastrin-releasing peptide,GRP)的表达,GRP是一种神经肽瘙痒原,与AD的瘙痒特征相关。研究证明,表皮棘层增生的主要参与者是致敏小鼠皮肤中的IL-22。提示抗IL-22 是治疗AD有前景的方法之一。
5、IL-12/23:
IL-12是由p35和p40两条链组成的异二聚体细胞因子,由树突状细胞、巨噬细胞、活化的B细胞等抗原呈递细胞分泌。IL-23由对Th17细胞的活化和维持至关重要的p19和p40组成,由活化的树突状细胞、单核细胞和巨噬细胞产生, 参与AD的发病机制。研究发现,通过抑制IL-12/IL-23共有p40亚单位,可阻断Th17细胞产生的IL-17等促炎细胞因子,达到抑制炎症、缓解皮损的效果。因此,下调IL-12和IL-23可能是治疗AD的一种有效方法。
6、磷酸二酯酶4:
磷酸二酯酶(phosphodiesterase,PDE)是唯一降解细胞内环状腺苷单磷酸(cyclic adenosine monophosphate,cAMP)和环状鸟苷单磷酸(cyclic guanosine monophosphate,cGMP)等第二信使的酶,包含11个家族成员。其中,PDE4具有水解cAMP 专一性。因此,抑制PDE4能够下调AD相关炎症过程。PDE表达正常的情况下,cAMP和cGMP激活关键细胞效应物如蛋白激酶A(protein kinase A,PKA),随后磷酸化抑制多种转录因子的活性,包括活化核因子κB(nuclear factor kappa-B,NF-κB)和T淋巴细胞的核因子(nuclear factor of T lymphocytes,NFAT)等。这些因子控制IL-2、IL-4、IL-6、IL-31和肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)的表达,继而调控炎症反应。AD患者体内炎症细胞中PDE4水平明显增加。PDE4抑制剂选择性抑制PDE4,升高cAMP水平,从而激活PKA,抑制NF-κB和NFAT信号通路,减少下游细胞因子和趋化因子的释放,进而抑制炎症反应。
7、Janus激酶:
Janus激酶(Janus kinase,JAK)-信号转导和转录激活因子(signal transducer and activator of transcription,STAT)通路在调节参与AD免疫发病机制的多个免疫轴中起着核心作用。特别是Th2细胞因子,包括IL-4、IL-5、IL-13、IL-31和TSLP,可导致AD的慢性炎症和瘙痒症状,由JAK-STAT介导信号转导。此外,JAK-STAT参与表皮屏障的调节和与瘙痒转导相关的周围神经调节。靶向JAK-STAT通路可能会减弱这些信号,并通过抑制与AD相关的各种免疫通路来显示临床疗效。具有可变选择性的局部和口服JAK抑制剂已成为治疗AD的有前途的选择。
8、皮肤屏障:
皮肤屏障的两个主要部分是角质层(stratum corneum,SC)和紧密连接(tight junctions,TJs)。AD中的SC表达障碍会导致患者出现SC屏障缺陷,促使启动或加重2型炎症因子的释放。TJs则包含细胞内外蛋白质,控制水电解质在胶质细胞间的稳态,限制微生物及过敏原渗透,同时TJs也扮演着维持皮肤屏障结构的角色。皮肤屏障的改变,会造成皮肤水分散失。与健康人相比,AD患者体内的神经酰胺、丝裂蛋白等成分明显减少,甚至发生了性状改变。不仅如此,屏障功能障碍还会使2型炎症反应进一步加剧,相关促炎细胞因子会进一步抑制表皮蛋白(如FLG)表达,促进单链脂肪酸生成,额外募集具有先天免疫作用的细胞,改变皮肤酸碱平衡,从而加剧SC和TJs的破坏。
9、皮肤菌群:
AD患者一般缺乏表皮抗菌活性物质,往往难以抵御金黄色葡萄球菌等致病微生物的侵袭。皮肤菌群之间的相互作用对于维持其多样性以及某些微生物群的发展至关重要。因此,控制皮肤菌群失调,防止AD症状加重,恢复皮肤共生菌群是一种有效的方法。在AD发病过程中, 金黄色葡萄球菌会大量生长。研究表明,金黄色葡萄球菌能诱导人体角质形成细胞快速释放IL-33,而后者独立于Toll样受体途径。在对AD患者和健康人群皮肤培养马拉色菌的研究中发现,AD患者中马拉色菌阳性率较低。马拉色菌引发的AD通常发生在头部和颈部等脂溢性区域, 这可能是AD的分布模式在青春期和之后会发生变化的原因。
三
AD治疗药物
AD的治疗目的是缓解或消除临床症状,消除诱发和加重因素,减少和预防复发,减少或减轻合并症,提高患者的生活质量。正规和良好的治疗及疾病管理可使AD症状完全消退或显著改善,患者可享受正常生活。
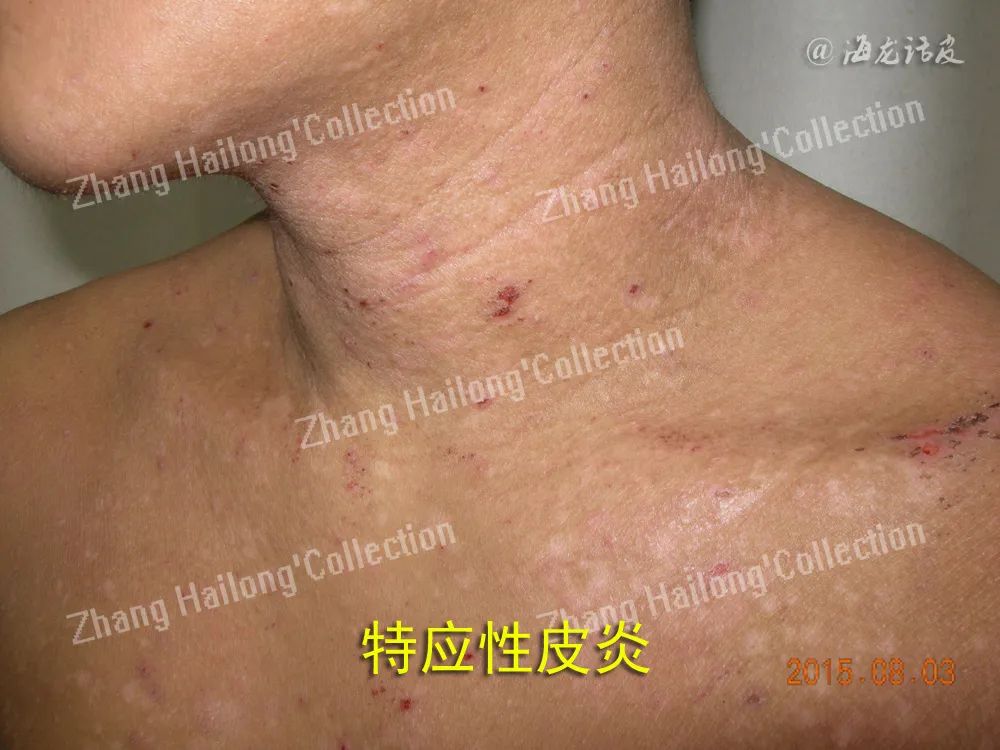
目前临床治疗AD的方法中,轻度患者可外用钙调神经磷酸酶抑制剂、糖皮质激素等药物;中度患者在外用药物控制皮损后,可通过联合用药主动维持治疗;重度患者则考虑使用系统性免疫抑制剂、生物制剂以及光疗。然而,上述治疗方法,尤其是针对中重度AD的治疗方法中,外用及系统治疗均存在适用人群较窄、治愈率较低、价格较高、临床数据不完善等局限性,以及一定的不良反应。随着对AD炎症反应及瘙痒形成机制的认识加深,越来越多针对免疫和神经通路的治疗药物开始用于临床。
1、生物制剂:
IgE靶向药物:奥马珠单抗(omalizumab)是IgE的单克隆抗体,能清除患者体内的IgE抗体,而IgE抗体是AD较为关键的致病抗体之一。奥马珠单抗注射液于2003年获美国食品药品管理局(FDA)批准上市,已在美国、欧盟、日本等多个国家和地区获批上市,2023年在中国被批准上市,主要用于治疗过敏性哮喘和慢性荨麻疹,但也可用于治疗中度至重度AD。研究发现,奥马珠单抗治疗低IgE水平AD患者的疗效显著优于血清IgE非常高至极高水平的AD患者(P<0.001)。
Th2抑制剂:度普利尤单抗(dupilumab)是唯一的特异性靶向IL-4Rα的生物制剂,可通过靶向双重阻断IL-4和IL-13,抑制Th2介导的炎症反应。度普利尤单抗注射液于 2017年获FDA批准上市,用于治疗成人(≥18岁)的中重度AD,随后AD适应证的适用人群拓展至12~17岁、6~11岁(并有望扩展至6岁以下儿童)人群。已在包括欧盟和中国在内的全球50多个国家和地区获批上市。临床试验表明,度普利尤单抗治疗16周后,AD患者的湿疹面积和严重程度指数、瘙痒视觉模拟评分均较基线时显著改善。
曲罗芦单抗(tralokinumab)是全球首个特异性靶向IL-13治疗AD的单克隆抗体。2021年在欧盟和美国被批准上市,用于治疗中重度AD。临床研究发现,曲罗芦单抗治疗后可使皮肤微生物多样性增加,金黄色葡萄球菌丰度降低,共生的凝固酶阴性葡萄球菌丰度增加。提示曲罗芦单抗可直接和(或)间接改善AD患者的皮肤微生物菌群失调,帮助修复皮肤屏障,清除皮损症状。
Lebrikizumab是一种特异性靶向IL-13的人源化单克隆抗体,能与IL-13高效结合,有效阻断IL-13Rα1/IL-4Rα异二聚体复合物的形成以及随后的信号传递过程,可以介导神经免疫轴和下游转录事件,这对慢性瘙痒至关重要。通过其靶向作用机制,lebrikizumab在短期和长期治疗中均展现出显著的疗效和良好的安全性。2019年lebrikizumab获得美国FDA授予的快速资格认定,批准治疗中重度AD的成人和青少年患者(12~<18岁,体重≥ 40kg),2023年在欧盟获得批准上市。
Nemolizumab是一种靶向IL-31的人源化单克隆抗体,目前在世界上的许多国家和地区仍处于临床开发中,用于治疗AD和结节性痒疹。2019年12月,美国FDA授予了 nemolizumab突破性疗法认定,用于治疗结节性痒疹相关的皮肤瘙痒,2022年日本批准用于治疗AD相关瘙痒。Ⅲ期临床试验表明,nemolizumab治疗成人结节性痒疹起效迅速,治疗组中有19.7%的患者使用1剂nemolizumab后在第4周瘙痒已消失。
抗IL-12/23药物:乌司奴单抗(ustekinumab)是一种人源化免疫蛋白G1k单克隆抗体,可与IL-12和IL-23的p40蛋白亚单位以高亲和力特异性结合,通过与p40二聚体结合而阻断人类IL-12/23信号通路,从而有效抑制T细胞亚群Th1和Th17的功能,达到抑制炎症的目的。这是一种全新的治疗方法,采用人体免疫系统的一种机制,通过阻断细胞因子参与的炎症反应达到治疗目的。乌司奴单抗目前尚未在任何国家和地区获批,但前期研究表明,该药可用于治疗中重度AD患者。
IL-22抑制剂:Fezakinumab是一种人源性单克隆IgG1-λ 型抗体,可直接与IL-22结合,阻止IL-22/IL-22受体复合物的形成。目前相关的临床试验只进行到II期。结果显示,治疗20周时,fezakinumab组患者的AD评分相比基线的平均降幅(18.8分)大于安慰剂组(11.7分)。
IL-33抑制剂:研究发现,AD患者血清中IL-33水平升高, 这是一种参与皮肤炎症和Th2炎症性疾病的趋化因子。Etokima是一种人源性单克隆IgG1抗体,可以中和 IL-33,对治疗AD有一定的效果, 但仍需后续临床试验进行验证。
TSLP抑制剂:TSLP作为一种警报素,在AD的免疫病理 过程中扮演着关键角色。其可能通过引起“瘙痒-搔抓循环”和皮肤屏障功能降低而更早地参与AD的发展。此外,AD可能与过敏性鼻炎、哮喘和食物过敏等其他特应性疾病同时存在。因此,如果在特应性皮炎适应证上取得成功,AD患者将成为TSLP抑制剂的另一大潜力市场。Tezepelumab是一种人源化TSLP的单克隆抗体,可阻断TSLP与其受体复合物的结合,从而抑制炎症反应。于2021年12月获得美国FDA批准上市,用于12岁及以上儿童和成人重症哮喘附加治疗。
PDE4抑制剂:克立硼罗(crisaborole)作为一种外用非激素PDE4抑制剂,通过抑制细胞内PDE4活性,升高cAMP水平,参与调控促炎性细胞信号通路,减少促炎症细胞因子的产生,从而达到控制皮肤炎症反应的效果。于2016年12月获美国FDA批准上市,成为美国 FDA在过去15年来批准治疗AD的首个新分子实体,也是首个抑制皮肤PDE4的非甾体外用药物。随后该药适用人群得到进一步扩大,已经批准其补充申请,将治疗轻度至中度AD儿童患者的最低年龄限制从2岁扩展至3个月,是唯一一个美国FDA批准适用于年龄低至3个月轻中度AD患儿的非甾体局部处方药。2020年7月该药在中国上市,现已被纳入《第二批临床急需境外新药》名单和 2021版国家医保谈判目录(乙类)。此外,该药已在加拿大、澳大利亚、以色列和欧盟地区获批用于治疗 AD。在婴幼儿AD中具有良好的耐受性及疗效,这是目前 国内唯一获批用于治疗3月龄及以上轻度至中度AD患儿的外用PDE4抑制剂。
阿普斯特(apremilast)是一种新型口服小分子PDE4抑制剂,通过抑制PDE4活性,提高细胞内cAMP水平,进一步调控TNF-α和其他炎性细胞因子表达,最终抑制炎症反应,达到治疗AD的目的。2014年获美国FDA批准上市,2021年在我国上市。该药也是过去20年中获批用于银屑病治疗的首个口服药物,以及过去15年中获批用于银屑病关节炎的首个口服药物。目前主要用于治疗成人AD和牛皮癣的中度至重度成人患者。
JAK抑制剂:阿布西替尼(abrocitinib)是一种高选择性口服JAK1抑制剂,优先抑制依赖JAK1的细胞因子诱导的STAT磷酸化,保留由JAK2/JAK3或JAK2/TYK2对诱导的信号传导。2021年首次在日本获批上市,次年在中国和美国获批上市。目前国内用于治疗难治性、中重度AD成人患者。
巴瑞替尼(baricitinib)是一种小分子口服JAK抑制剂,对JAK1和JAK2均具有选择性,对JAK1和JAK2的亲和力基本相同,半抑制浓度(half maximal inhibitory concentration,IC50)分别为5.9和5.7nmol·L-1。一项临床研究显示巴瑞替尼可改善中重度AD患者的症状体征。2017年2月在欧盟被批准上市,2018年6月获美国FDA批准上市,2019年6月在我国上市,用于治疗中重度活动性类风湿关节炎。2020年11月,巴瑞替尼在欧盟被批准用于治疗AD,也是首个被批准可用于治疗AD的JAK抑制剂。
鲁索替尼(ruxolitinib)是美国FDA目前批准的唯一一个局部外用JAK抑制剂,能够与ATP在酶催化位点竞争性结合,下调被异常激活的信号通路,从而达到治疗目的。2011年11月获美国FDA 批准上市,2017年3月我国上市。临床主要用于短期和非连续性长期治疗非免疫功能低下的12岁及以上轻中度AD患者。
托法替尼(tofacitinib)是一种口服JAK抑制剂,可有效抑制JAK1和JAK3的活性,阻断多种炎性细胞因子的信号转导。2012年11月获美国FDA批准上市,2017年3月在我国上市。托法替尼可降低瘙痒相关细胞因子IL-22、IL-23和IL-31,同时可能通过增加肽能表皮神经纤维密度来改善抑制性瘙痒机制。这使得托法替尼成为治疗慢性和难治性瘙痒的一个很好的选择。
乌帕替尼(upadacitinib)是一种可逆的ATP竞争抑制剂,对JAK1的选择性远高于JAK2、JAK3或TYK2。2019年8月获美国FDA批准上市, 2022年2月在我国上市。乌帕替尼是国内目前唯一获批用于治疗成人及12岁以上青少年AD的口服选择性JAK1抑制剂,临床试验证实,其能够在140周的治疗期内持续发挥作用,且长期应用安全性良好,可避免AD对患儿青春期生长发育造成的不利影响。
2、天然药物:
得益于丰富的中药研究基础,天然产物在我国具有天然开发利用优势,是新药研发的重要来源。多项研究表明,天然产物具有较高的安全性和有效性,可显著改善AD的过敏性炎症和氧化应激状态,通过抑制NF-κ相关信号通路。
黄酮类:黄芩苷(baicalin)是一种从黄芩中提取的活性化合物。动物实验显示,黄芩苷可以通过调节Th1/Th2平衡,提高FLG、内披蛋白、兜甲蛋白等屏障蛋白表达来改善皮肤屏障功能,恢复AD小鼠肠道益生菌丰度来调节肠道生态失调,并通过抑制活化NF-κB和JAK/STAT途径来抑制AD小鼠模型炎症。
黄芩黄酮II(scutellaria flavone II,SFII)是另一种从黄芩中分离出来的类黄酮。体外实验研究发现,SFII可通过调节STAT1、NF-κB和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MAPK)信号通路来抑制胸腺活化调节趋化因子和巨噬细胞来源的趋化因子等和炎症介质的表达。
白杨素(chrysin)是一种来源于蜂胶的天然类黄酮,对肥大细胞介导的过敏反应具有抑制作用。动物实验研究显示,白杨素可减轻2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)/粉尘螨提取物(mite dust extract,DFE)诱导的AD小鼠模型症状以及血清IgE、IgG2ɑ和组胺水平,还可抑制小鼠淋巴结和耳组织中Th1/Th2/Th17/Th22的相关炎症反应。体外实验表明,白杨素通过下调p38MAPK、NF-κB和STAT1的活化,降低TNF-α、IL-1β、IL-6等促炎细胞因子及CCL17、CCL22等Th2趋化因子,还可下调TNF-α/IFN-γ刺激的HaCaT细胞和小鼠原代角质形成细胞中IL-33表达,抑制先天免疫系统。
槲皮素(quercetin)是类黄酮化合物的糖基化形式,存在于大多数可食用的水果和蔬菜中,具有抗氧化和抗炎特性。动物实验研究发现,口服槲皮素不仅可减轻粉尘螨提取物诱导的NC/Nga小鼠AD样皮损的发展和组织病理学改变,还可下调细胞质高迁移率族蛋白B1(high mobility group protein B1,HMGB1)、 糖基化终产物受体(receptor for advanced glycation endproducts,RAGE)以及细胞核中p-NF-κB、p-ERK1/2、COX-2、TNF-α、IL-1β、IL-2Rα、IFN-γ和IL-4等炎症因子水平,同时上调细胞核核因子红细胞生成素-2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)水平。表明槲皮素可通过调节 HMGB1/RAGE/NF-κB信号传导和Nrf2蛋白的诱导来发挥治疗AD的作用。
生物碱类:白鲜碱(dictamnine)是从芸香科白鲜属植物中分离出来的主要喹啉生物碱成分之一。动物实验研究 发现,白鲜碱对二硝基氟苯诱发的炎症症状和慢性瘙痒症具有抑制作用,可减轻肥大细胞浸润和表皮增厚和病变皮肤中MrgprA3+纤维的密度。此外,白鲜碱还能抑制MrgprA3+和TRPA1+神经元的兴奋性,从而抑制慢性和急性瘙痒。
伪麻黄碱(pseudo ephedrine,PSE)是一种来自麻黄属麻黄草和中麻黄的生物碱。动物实验研究发现,口服PSE可改善DNCB/DFE诱导的AD样皮炎、皮肤水合作用及抓挠行为,抑制血清TNF-α和IgE水平,降低皮肤组织中众多细胞因子和趋化因子如CCL2、基质金属蛋白酶-9的表达,抑制了TNF-α/IFN-γ诱导的HaCaT细胞中TNF-α、IL-1β和IL-23的释放。此外,PSE在体内和体外均可抑制MAPK和NF-κB信号通路的激活。
甲基莲心碱(neferine)是从莲花成熟种子的绿色胚胎中分离出来的小分子化合物。动物实验研究发现,甲基莲心碱可抑制细胞因子、趋化因子的表达以及NF-κB和MAPK的磷酸化。此外,还可显著减轻小鼠模型的皮肤屏障损伤、经表皮失水、抓挠反应和表皮增生,并增加表面皮肤水合作用。
酚类:
姜黄素(curcumin)和双去甲氧基姜黄素 (bisdemethoxycurcumin,BDMC)是来自中药姜黄根茎的成分。动物实验研究证实,姜黄素对皮肤炎症、增殖和感染性疾病有调节作用。BDMC比姜黄素更稳定且具有更好的水溶性和渗透性,能够抑制趋化因子和炎性细胞因子的mRNA表达以及MAPK和NF-κB信号通路的激活,缓解AD炎症反应。
白藜芦醇(resveratrol)是一种大量存在于红葡萄皮中的多酚,可有效抗炎和对抗衰老。动物实验研究发现,白藜芦醇对HMGB1-RAGE、PI3K、ERK1/2和NF-κB通路具有抑制作用,可能是抗炎治疗的有效靶点。另有研究显示,白藜芦醇能有效改善组织学变化和炎症上皮细胞因 子和上皮细胞凋亡,从而有效改善组织变化和炎症反应。
萜类:
熊果酸(ursolic acid)是一种三萜类化合物,以游离形式或与糖结合成苷的形式分布于约7个科46个属62种植物中。动物实验研究显示,熊果酸通过调节TLR4/NF-κB和Nrf2/HO-1信号通路,改善DNCB诱导的小鼠特应性皮炎样症状。
刺囊酸(echinocystic acid,ECA)是一种五环三萜类化合物,可从皂角的果实中提取。动物实验研究发现,ECA 可通过恢复丝聚蛋白表达和皮肤水合作用来改善皮肤屏障功能,还可抑制尘螨诱导AD小鼠皮肤和肺T辅助细胞来源细胞因子的表达、ERK和STAT1的磷酸化、角质形成细胞中NF-κB的易位,具有作为抗特应性和抗过敏的治疗潜力,阻止特应性进程的发展。
积雪草酸(asiatic acid)是一种五环三萜类化合物,在积雪草、猕猴桃、番石榴等多种植物中发现。体外实验研究发现,积雪草酸可下调Th1/Th2相关细胞因子以及COX-2、CXCL9、CXCL8的表达。同时,NF-κB、p-AKT、MAPK信号通路的活性也受到抑制。
齐墩果酸(oleanolic acid,OA)是一种五环三萜类化合物,大量存在于油橄榄科植物中。体外实验研究显示,OA对肥大细胞介导的过敏性炎症有抑制作用,可通过阻断AKT、NF-κB以及STAT1抑制Th2型细胞因子和趋化因子的表达。
香紫苏醇(sclareol)是一种天然二萜烯类化合物,可从紫苏的叶子和花中提取。动物实验研究发现,腹腔注射香紫苏醇除了显著减轻AD小鼠模型症状、血清IgE水平、局部皮损促炎细胞因子浓度,还可抑制T细胞活化。
香豆素类:秦皮乙素(esculetin)是一种香豆素类化合物,可从水曲柳的树皮中提取。动物实验研究表明,口服秦皮乙素可改善DNCB诱导的AD样症状和组织学改变,降低血清中的IgE、IgG2a和组胺水平,抑制组织中Th1/Th2/Th17相关细胞因子的产生。体外实验也证实其能够抑制TNF-α/IFN-γ刺激的NF-κB和STAT1活化。
伞形花内酯(umbelliferone,UMB)是一种香豆素衍生物,存在于紫花前胡、茵陈蒿等植物的根和树皮中。研究显示,口服UMB可显著降低DNCB/DFE诱导的AD小鼠IgE、IgG1、IgG2a、TNF-α和IL-4的血清水平。此外,UMB可通过调节MAPK、NF-κB和STAT1信号通路,减少TNF-α/IFN-γ刺激产生的促炎细胞因子和趋化因子的分泌,从而改善AD小鼠模型相关症状和炎症 。
四
小结
目前,尽管天然小分子药物在临床应用较少,尚处在临床前研究阶段,但中药作为获取潜在活性成分的主要来源,在治疗AD方面正受到越来越多的重视,天然小分子靶向药物有望在未来被开发并进入临床应用。AD是全球范围内的一个重要公共卫生问题,尽管近年来AD治疗已取得很大进步,但也存在很多问题尚未解决。相信在医务工作者、科研人员的努力下,AD治疗药物研究一定会更加充满希望。
参考文献:
1.邹瑞,李娟,李劲松.特应性皮炎治疗药物的研究进展[J].药物流行病学杂志,2024,33(4):450-460.
2.中华医学会皮肤性病学分会免疫学组,特应性皮炎协作研究中心.中国特应性皮炎诊疗指南 (2020 版 )[J].中华皮肤科杂志,2020,53(2):81-88.
3.王飞燕,马善波,陈雨菡,等.固有免疫在特应性皮炎发病机制中调控作用的研究进展[J].中国药师,2022,25(9):1616-1624.
4.王钰,李巍.特应性皮炎外周血单个核细胞转录组特征及其在度普利尤单抗疗效预测中的应用[J].中华临床免疫和变态反应杂志,2023,17(5): 505-511.
5.其他文献略。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#AD# #特应性皮炎#
10