脑淀粉样血管病(CAA):临床与影像诊断
2小时前 神经科学论坛 神经科学论坛 发表于陕西省
本文介绍脑淀粉样血管病(CAA),阐述其发病机制、临床症状、影像学表现、诊断标准及病程预后等,强调这一常见神经系统变性病无特效治疗,处置重点在预防出血等。
论坛导读:脑淀粉样血管病(Cerebral amyloid angiopathy, CAA)在老年人的大脑中是一种常见的以β淀粉样蛋白(Amyloid β,Aβ)沉积于颅内微血管(软脑膜动脉、皮质小动脉、毛细血管)为特点的神经系统变性疾病。CAA是一组异质性较高的疾病,目前其发病机制尚不十分明确,可能因为随着年龄的增长,大脑对Aβ的清除能力下降,同时很多患者的发病与遗传也息息相关。临床可以表现为脑叶出血、认知功能障碍、快速进展性痴呆、脑淀粉样发作等不同亚型;中老年以痴呆、精神症状、反复或多发性脑叶出血起病者要考虑;目前CAA尚无特异性治疗。
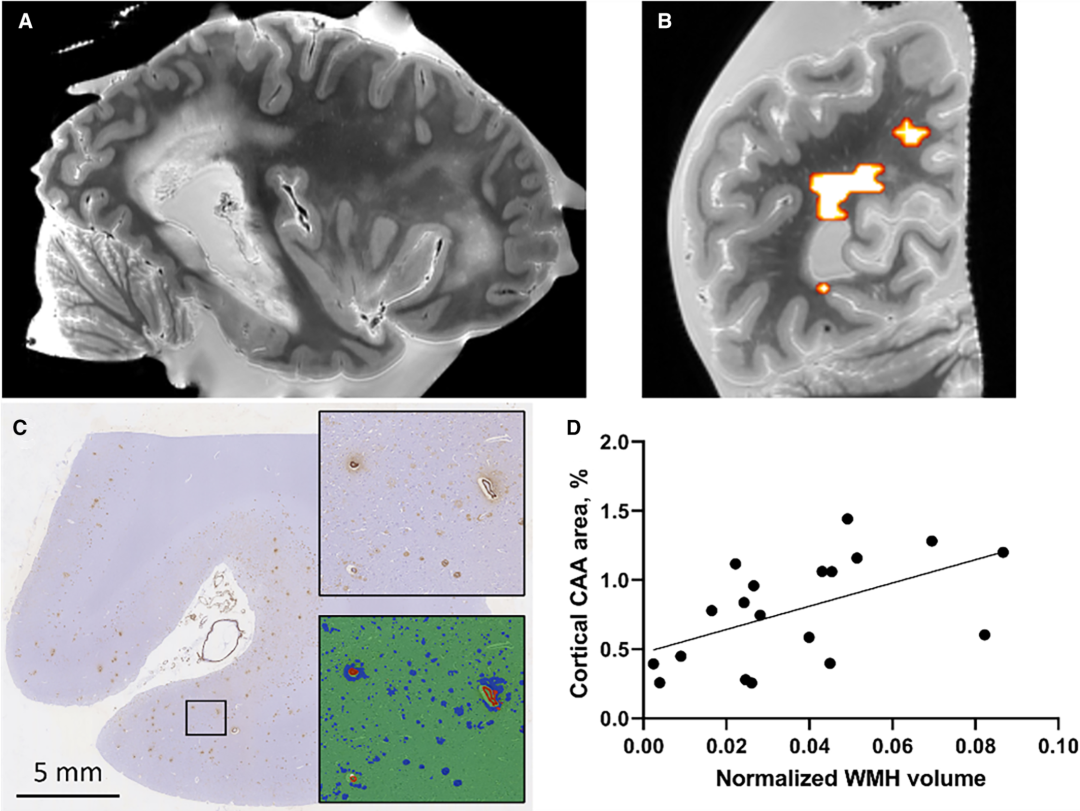
在确诊为CAA的患者中,ex vivo MRI的WMH容积与CAA的严重程度相关。 J Am Heart Assoc. 2024 Nov 11:e035744.
脑淀粉样血管病(Cerebral amyloid angiopathy, CAA)是淀粉样蛋白沉积在脑皮质、皮质下、软脑膜中小血管的中膜和外膜,使得血管壁弹性减弱并易断裂从而导致脑血管功能障碍的一种疾病。老年和AD是CAA的危险因素,同时CAA还有其他遗传性。中枢神经系统淀粉样物质沉积包括有老年斑的淀粉样核心;小动脉和微小动脉壁类淀粉物质;毛细血管、微小动脉壁及其周围脑实质的淀粉样物质三种病理类型,而后两者类型统称为CAA。
CAA由于淀粉样物质在脑膜、皮质和皮质下小动脉壁内沉积,导致小动脉中层和外膜被淀粉样物质所取代,因而管壁增厚、管腔狭窄或闭塞、弹力膜破碎破坏,血管壁失去正常功能,血管壁坏死,有时形成微小动脉瘤,破裂后可致脑内出血,这是自发性非高血压病脑内出血的原因。过去对CAA的认识主要集中在出血性表现,包括脑叶出血、脑微出血、凸面SAH、cSS和TFNE。近来越来越多的证据提示包括脑白质高信号、微梗死、血管周围间隙扩大、认知障碍和CAA-ri的非出血性表现在CAA的病理生理过程中同样重要。
CAA可以分为散发型和遗传型两种形式。散发型CAA主要见于血压正常的老年人, 在70~90岁之间, 发病率稳步上升。20%~40%的老年人和50%~60%的痴呆老人有CAA证据。遗传型CAA是一种罕见的常染色体显性遗传疾病, 发病年龄早于自发性CAA。不同于散发型CAA, 发病年龄通常为30~70岁, 其中报道最多的是遗传性脑出血伴淀粉样变性荷兰型, 在中年发病, 以痴呆、复发性脑叶出血和白质脑病为特征。
CAA作为脑血管病理现象可致多种临床表现,也可无症状。散发性CAA主要表现为认知功能损伤和痴呆、快速进展性认知功能损害等。脑出血是CAA最常见的临床表现,出血部位通常是皮质及皮质下等区域,可表现为大面积症状性或点状无症状性,具有多发性和反复性的特点。CAA病人也可以出现短暂性局灶性脑功能障碍的症状,该症状可能与出血相关。CAA的其他临床症状还表现为痴呆症,25%~40%的CAA痴呆可能比症状性脑出血出现的更早,有学者甚至认为CAA与Alzheimer病引起的痴呆“one peptide, two pathways:殊途同归”。CAA多发生于60岁以上的老年人,平均发病年龄为69.5岁,发病率常随年龄的增高而增高。并常伴有AD,文献报道CAA病人中89%有AD。临床表现主要有三个类型:
1. 急性脑叶出血
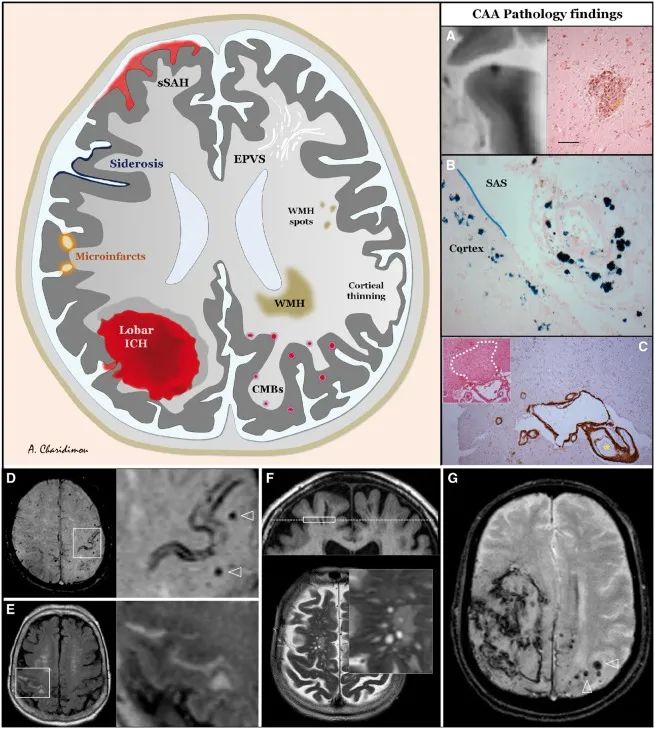
Brain. 2017 Jul 1;140(7):1829-1850.
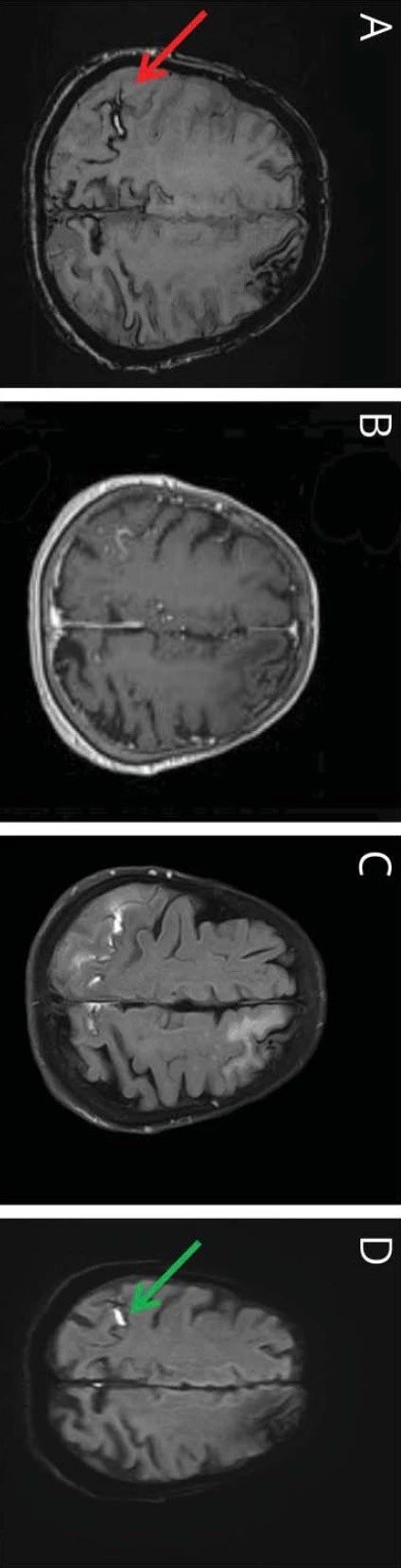
脑叶出血(血肿或微出血)是CAA最常见的临床表现,且容易复发。CAA可导致所有脑梗死亚型的高复发风险。近期一项研究表明,36%的散发型CAA患者在第一次出血后随访5年内发生了脑出血的复发。CAA的另一个重要的症状即是认知障碍。CAA相关的认知障碍表现在多个方面,主要影响执行功能和处理速度。目前研究表明,脑表面铁沉积、皮质萎缩、脑微出血和年龄都是认知障碍的独立危险因素。
CAA相关出血的临床表现因病变大小和受累脑区而异。脑叶出血可累及锥体运动神经元和锥体束而引起轻偏瘫。脑叶大量出血可直接累及网状激活系统网络或继发对其占位效应,而引起意识水平下降。而脑叶或小脑小量出血可导致受累脑结构相关的更局限性的局灶性神经功能缺损。皮质少量出血偶可刺激脑膜伤害感受器而引起单纯头痛;偶尔也可能无症状,在因其他指征行影像检查时发现。
CAA最常见的临床表现是急性脑叶出血。术语“脑叶”指位于大脑半球皮质和皮质下白质的位置;这不同于高血压性出血的特征性深部位置,例如壳核、丘脑和脑桥。脑叶出血的位置反映了血管淀粉样蛋白沉积的潜在分布,即倾向分布于皮质血管,而基本不累及白质、深部灰质和脑干。小脑和软脑膜的血管受累也可引起较少见的小脑或蛛网膜下腔/硬膜下出血的临床表现。
2. 短暂性局灶性神经系统发作(Transient focal neurological episodes,TFNE)
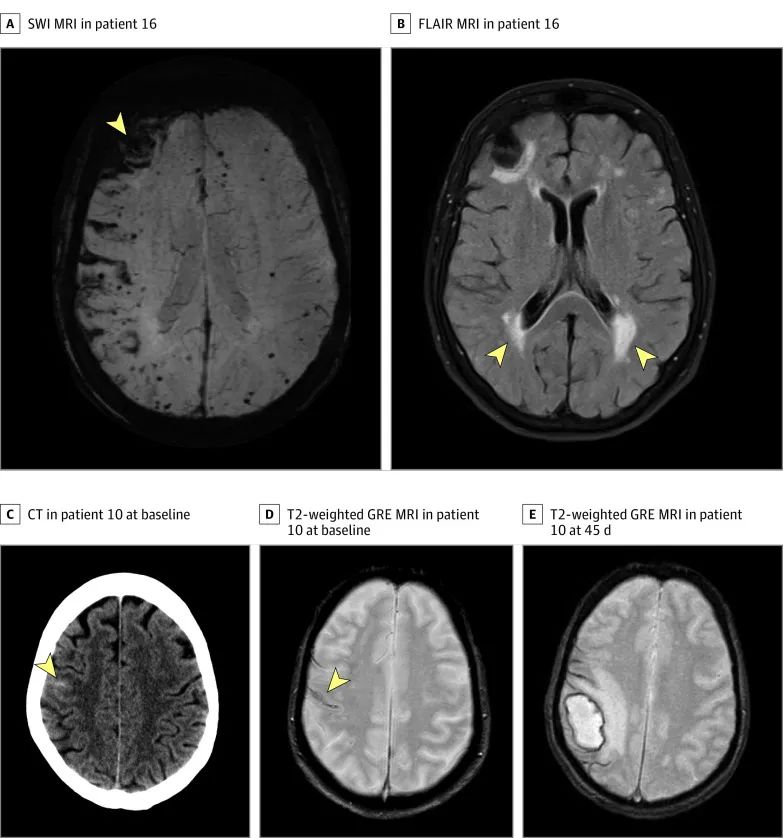
JAMA Neurol. 2022 Jan 1;79(1):38-47.
短暂性局灶性神经系统发作(Transient focal neurological episodes,TFNE)也称为淀粉样发作(amyloid spells),是CAA的另一临床表现,曾经被认为是TIA。TFNE特征性的表现为短暂性(通常<30min)、反复发作的、刻板的神经系统症状,包括麻木、无力、语言障碍等,其中最为特征性的表现为播散性的感觉异常,通常从手指向上肢近端蔓延,符合感觉皮质分布的特征。上述症状可短时间内完全缓解。目前研究表明TFNE可能与脑表面铁沉积或皮层凸面蛛网膜下腔出血有关。
3. 脑淀粉样血管病相关炎症(CAA-ri)
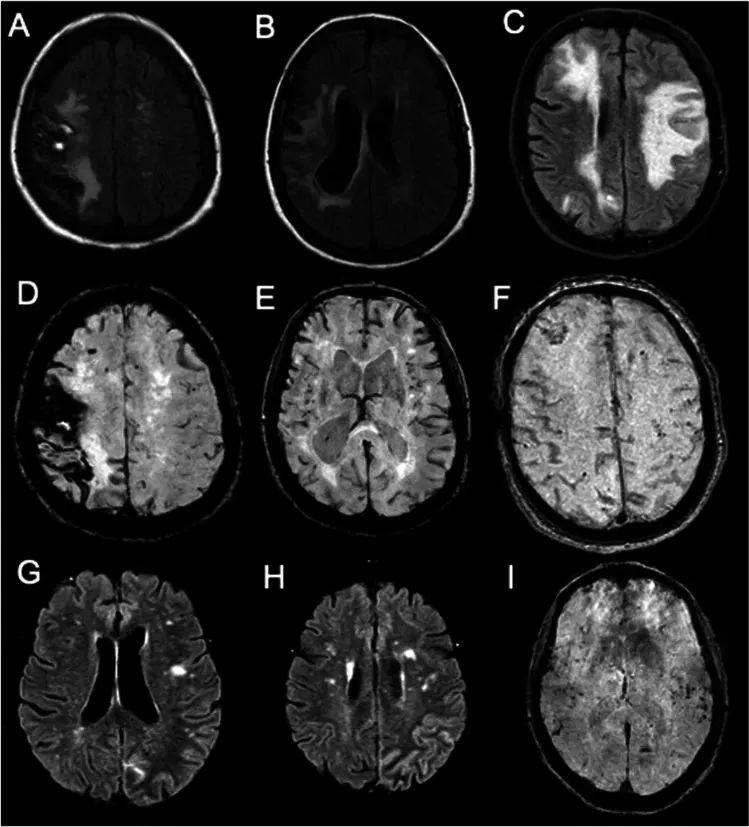
Neurol Sci. 2021 Dec;42(12):5353-5358.
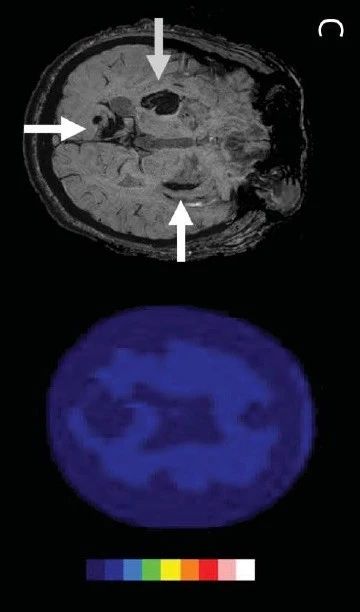
脑淀粉样血管病相关炎症(CAA-ri)是散发性CAA中的少见临床表现,是软脑膜及脑血管Aβ沉积引起的炎症反应。主要表现为快速进展的认知功能减退、头痛、行为改变、发作和局限性神经功能障碍等。
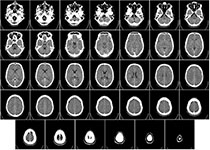
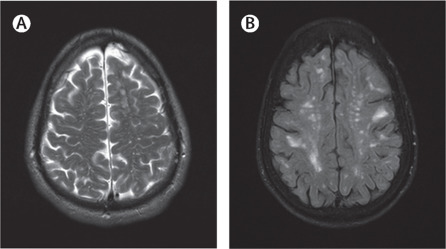
CAA的影像学表现主要为皮质-皮质下大的或微小的出血灶、脑白质病变和脑萎缩,可单独或同时出现。目前,除常规颅脑CT、颅脑MRI等检查外,SWI序列因能够发现更多的微小出血灶被更多地用于临床,对于诊断CAA有更高的敏感性。脑出血性表现包括白质高信号(WMHs)、皮质微梗死(CMIs)、半卵圆中心的血管周围间隙扩大(CSO-DPVS)。CAA-riMRI表现为T2或 FLAIR单发或多发片状或融合的白质高信号。
临床患者有高龄、有痴呆症状、多灶性、再发性或皮质下脑出血、无明显或仅有轻度高血压和脑动脉硬化征象,在排除其他原因后要高度考虑CAA。确诊靠病理,CAA的诊断必须依靠临床、影像学及组织学证据。2022年8月Lancet Neurol期刊发布国际淀粉样血管病协会关于CAA诊断的Boston criteria version 2.0最新版本诊断标准:
-
全脑尸检证实的CAA:尸检结果显示脑叶、皮质或皮质-皮质下出血和伴有严重血管淀粉样物质沉积的CAA,排除其他原因引起的病变。
-
病理学支持很可能的CAA:临床症状和组织(清除的血肿或皮质活检标本)病理学观察显示脑叶、皮质或皮质-皮质下出血,或仅有某种程度的血管淀粉样物质沉积的CAA,排除其他原因引起的病变。
-
很可能的CAA:年龄≥50岁,临床症状和影像学表现均显示局限于脑叶多灶性(至少2个,但小脑病灶不计入)出血或微出血、短暂局灶性神经症状发作、凸面蛛网膜下腔出血或认知障碍、痴呆。排除其他原因引起的出血。
-
可能的CAA:年龄≥50岁,临床症状和影像学表现为无其他原因可以解释的单个自发性脑叶(小脑病灶不计入)局限于脑叶出血或微出血、短暂局灶性神经症状发作、凸面蛛网膜下腔出血或认知障碍、痴呆。排除其他引起脑出血的原因。
在临床上,对于伴有认知功能障碍的老年人,常规影像学检查发现血管性脱髓鞘、脑萎缩,即使没有发现症状性脑出血,也要考虑CAA的可能,建议常规行颅脑SWI检查。CAA的确诊只能基于脑血管中淀粉样蛋白沉积的活检证据。根据修改后的波士顿诊断标准, 临床和影像学检查结果可以诊断出“可能”CAA。MRI的发展提高了我们检测“出血迹象”的能力。当脑叶出现大量出血或微出血, 其他原因被排除时, 即使在没有组织病理学证实的情况下, 也应归类为“可能CAA”。小血管中红细胞的外渗, 形成含铁血黄素的巨噬细胞, 积聚在血管周围形成微出血。在MRI上, 微出血表现为直径2~5mm的小圆形病灶, 在梯度回波序列中(T2*-加权) 表现为低信号。
CAA其中一个特征在于微血管出血(脑微出血,CMBs)和缺血性(脑微梗死,CMIs)病变的广泛共存。这些损伤现在被广泛认为是疾病严重程度的标志。最近的进展证实,大多数CMBs对应于新的或旧的微出血,伴有载有含铁血黄素的巨噬细胞的病灶簇的进行性出现,而旧的CMIs则表现为伴有空化的组织损失。
脑淀粉样血管病相关炎症(CAA-ri)是散发性脑淀粉样血管病的少见临床表现,是软脑膜及脑血管Aβ沉积引起的炎症反应。主要表现为快速进展的认知功能减退、头痛、行为改变、发作和局限性神经功能障碍等。MRI表现为T2或 FLAIR单发或多发片状或融合的白质高信号。
CAA相关炎症似乎是CAA的一种独特表现,其特征是脑淀粉样蛋白沉积的炎症反应,伴有亚急性、常为进展性的神经系统症状。CAA相关炎症可能是Aβ相关血管炎的一种较轻类型。CAA相关炎症以血管周围炎症为特征,而Aβ相关血管炎是一种炎症累及整个血管壁的真正血管炎。这两种炎症综合征的临床表现、影像学特征和治疗反应相似,但Aβ相关血管炎通常需要更积极的免疫抑制治疗。
CAA多呈进行性发展,病程5~19年,平均13.3年,死亡年龄为59~72岁,平均65.8岁。目前没有确切的治疗方法能延缓CAA的进展,预后通常较差。临床对CAA的处置主要在于预防及处置偶发和复发出血事件预防,特别是降低ICH危险性、避免可诱发出血的各种因素。治疗包括预防脑出血复发,控制血压,处理颅内高压,控制癫痫发作及对症支持治疗等。禁用或慎用抗凝和抗血小板药物,综合考虑CAA病人抗凝、抗血小板治疗的危险-效益比。
参考文献
Bravo GÁ, Cirera LS, Torrentà LR. Clinical and radiological features of cerebral amyloid angiopathy-related inflammation. Neurol Sci. 2021 Dec;42(12):5353-5358.
Makkinejad N, et al. Neuropathological Correlates of White Matter Hyperintensities in Cerebral Amyloid Angiopathy. J Am Heart Assoc. 2024 Nov 11:e035744. doi: 10.1161/JAHA.124.035744.
Charidimou A, et al. Emerging concepts in sporadic cerebral amyloid angiopathy. Brain. 2017 Jul 1;140(7):1829-1850.
Sanchez-Caro JM, et al. Transient Focal Neurological Events in Cerebral Amyloid Angiopathy and the Long-term Risk of Intracerebral Hemorrhage and Death: A Systematic Review and Meta-analysis. JAMA Neurol. 2022 Jan 1;79(1):38-47.
Graff-Radford J, Rabinstein AA. Cerebral amyloid angiopathy criteria: the next generation. Lancet Neurol. 2022 Aug;21(8):674-676.
Puy L, et al. Distinct neuroinflammatory patterns between cerebral microbleeds and microinfarcts in cerebral amyloid angiopathy. Ann Clin Transl Neurol. 2024 Nov 4. doi: 10.1002/acn3.52226.
Greenberg SM, et al. Cerebral amyloid angiopathy and Alzheimer disease - one peptide, two pathways. Nat Rev Neurol. 2020 Jan;16(1):30-42.
Charidimou A, et al.The Boston criteria version 2.0 for cerebral amyloid angiopathy: a multicentre, retrospective, MRI-neuropathology diagnostic accuracy study. Lancet Neurol. 2022 Aug;21(8):714-725.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












前往app查看评论内容
1 0