【协和医学杂志】自适应平台试验在临床研究中的应用
2024-11-09 协和医学杂志 协和医学杂志 发表于上海
本文旨在阐述适应性设计和平台试验,探讨适应性设计在平台试验中的应用,为临床研究和新药研发提供科学依据。
传统随机对照试验(RCT)受限于严格的伦理要求,患者仅能按照既定方案被随机分配至治疗组和对照组,试验效率、研究成本、临床转化周期均受到影响[1]。随着新的临床理论方法和应用经验的不断推出,适应性设计(adaptive design)以其前瞻性调整试验设计、提高试验效率和保障患者权益的特性,逐渐在医药评估上市方面受到广泛关注[2],其中,基于主方案设计(master protocol)的平台试验结合适应性设计,成为临床研究的新模式。本文旨在阐述适应性设计和平台试验,探讨适应性设计在平台试验中的应用,为临床研究和新药研发提供科学依据。
1 适应性设计
1.1 概念的提出
适应性设计思想始于1952年美国数理统计学家Herbert Robbins提出的成组序贯设计[3],自诸多学者在临床试验中实施后,逐渐在统计学界和临床科研中引发热议。
2006年,美国食品药品监督管理局(FDA)将其作为Critical Path initiative计划的一部分,认为“适应性”试验可替代标准双盲、安慰剂对照临床试验[4]。随后,欧洲药物管理局(EMA)相继发布了关于使用灵活设计和分析方法处理验证性临床试验问题的报告,并组织了适应性设计在验证性临床试验中的研讨会[5-6]。
2010年,美国FDA起草了关于药物和生物制品的适应性设计监管文件。2016年底,美国国会通过了《21世纪治愈法案》,FDA根据该法案就关于药物和生物制品的适应性设计指导手册进行了更新[7-9]。2021年,我国国家药品监督管理局药品评审中心也正式发布了《药物临床试验适应性设计指导原则(试行)》文件[10]。
1.2 内容及特点
适应性设计,又称自适应设计、可变性设计或动态设计。根据试验过程中积累的数据,动态调整样本量、治疗分配比例、治疗组别、整体试验设计、统计检验方法、结局变量及试验目标等内容,充分保留了试验的有效性、科学性和完整性[11]。
与传统RCT相比,适应性设计具有三个显著优势:
|
1 |
提升试验统计效能; |
|
2 |
降低评估治疗所需的时间和参与人数,从而节约资金和资源; |
|
3 |
通过早期停止试验招募,减少患者对无效或有害治疗的暴露[12]。 |
由于适应性设计的高度灵活性,其试验操作和统计分析较为复杂,需更专业的研究团队进行严谨的试验设计、实施、期中分析和报告决策,并对试验的时间、人员、资源进行合理安排[13]。此外,试验开始时的样本量和研究周期通常是未知的,可能加大试验操作难度;若试验期间资源配置不当,也可能增加试验的偏倚风险[14]。
1.3 常用设计类型
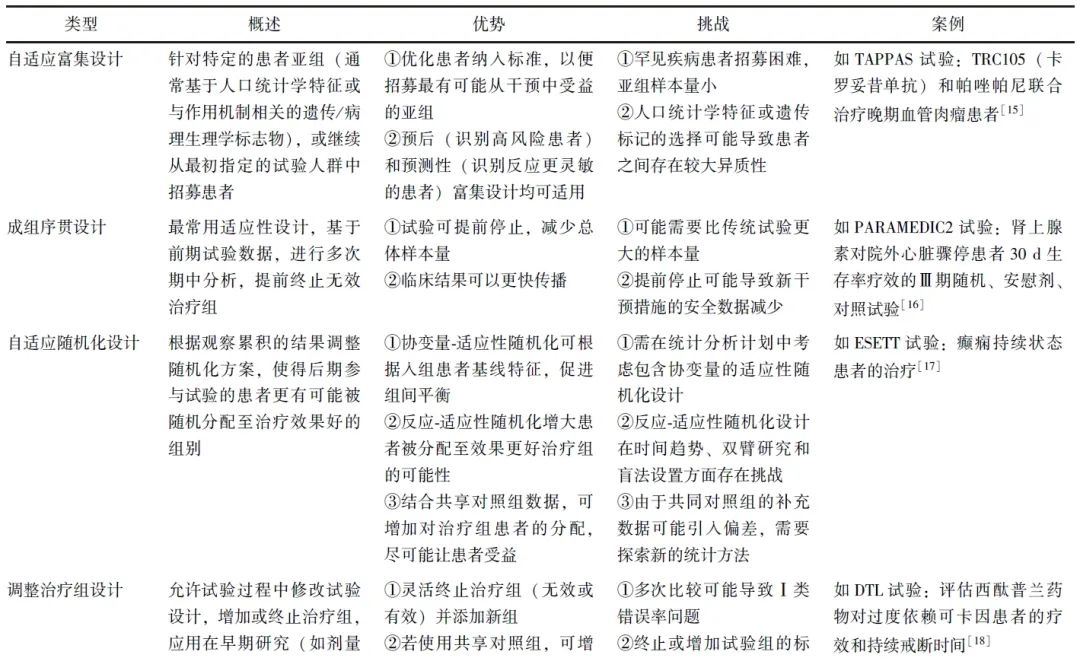
适应性设计广泛应用于临床研究,涉及药物研发的各个阶段和诸多领域,如成组序贯设计、样本量重估设计、多个终点和多重检验等更为复杂的设计等。表1简要概述了常用适应性设计的类型、定义、优劣势及案例,展示了适应性设计在临床研究中的实际应用。
表1 常用适应性设计类型

1.4 统计分析方法
传统RCT的统计分析是报告效应值、95%置信区间和P值,以此证明试验的有效性,而适应性设计试验的统计分析需结合不同阶段的数据,单一或联合应用贝叶斯方法(Bayesian statistical method)和序贯分析(sequential analysis),采用逆正态方法、P值结合测试或条件函数等方法进行分析[3]。
贝叶斯方法是将已有的累积数据(又称“先验”信息)与新的试验数据相结合,确定并计算试验结果的“后验”概率,即一种治疗措施的疗效大于其他治疗措施的概率,以此指导后期试验的随机分配机制[23]。序贯分析,又称“累积分析”,允许多次期中分析,预设“停止边界”,若试验结果表明一种治疗措施显著有效或显著无效,则提前终止试验,在提高试验效率的同时最大程度保护患者权益[24]。
如今,已开发出相应的工具支持适应性设计试验开展统计分析。如专用软件EAST和应用程序ADDPLAN,通用R软件和程序包gsDesign、GroupSeq、adaptTest、asd可实现统计分析功能,SAS软件的成组序贯设计PROC SEQDESIGN和PROC SEQTEST分析过程也常被应用[25]。
1.5 案例解读
BAN2401-G000-201是一项Ⅱb期双盲临床试验[26],其设置了1个安慰剂对照组和5个不同剂量的lecanemab(仑卡奈单抗)治疗组,研究lecanemab对早期阿尔茨海默病(AD)患者的疗效,并确定治疗效果≥90%的剂量组(ED90)。
采用反应-适应性随机化设计和贝叶斯分析方法,对12个月的主要结局指标AD综合评分(ADCOMS),以及18个月的AD认知评估量表(ADAS-Cog)评分、临床痴呆评定量表(CDR-SB)评分、脑脊液生物标志物变化和总海马体积等次要结局指标进行分析。
试验计划:按照固定随机化分配前196例患者后,新入组患者进行反应-适应性随机化,即每增加50例患者即进行盲态期中分析,更新剂量组分配概率,使更多患者分配至疗效好的治疗组(图1)。

图1 lecanemab治疗阿尔茨海默病的试验设计
根据最小临床重要差异(MID),对前3次期中分析结果进行判断,若ED90优于对照组的“后验”概率小于5%,试验因无效提前停止,之后的期中分析至试验随访完成,无效标准提高至7.5%;反之,若ED90优于对照组的“后验”概率为95%,代表试验早期成功,此时停止患者招募,之前符合标准的患者继续完成随访18个月的研究。若随访期间未因治疗无效或有效提前终止试验,主要终点分析和随访时间均已完成,且主要结局指标的概率阈值达到80%,则试验被视为成功。
试验结果表明,最终856例患者被随机分配,854例接受了治疗(图2)。
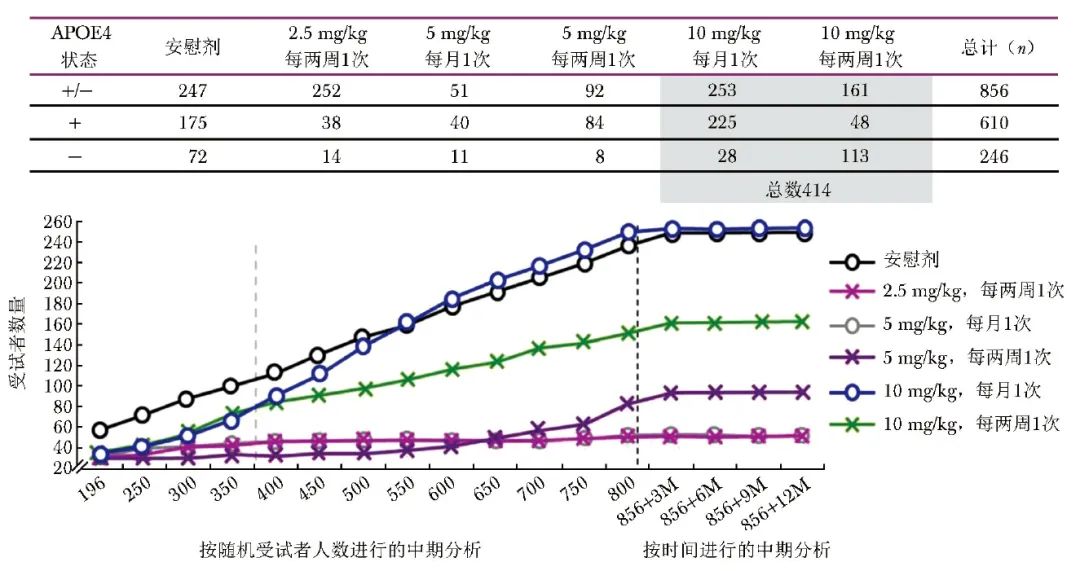
图2 不同剂量组适应性随机分配患者数量[26]
随访1年时,相较于安慰剂组,服用lecanemab剂量组(10 mg/kg,每两周1次)未达到主要结局指标的80%概率阈值。然而,随访至18个月,ADCOMS评分、ADAS-Cog评分、CDR-SB评分结果显示,服用lecanemab剂量组(10 mg/kg,每两周1次)的AD治疗效果均优于对照组,患者脑淀粉蛋白水肿或积液发生率仅为9.9%,药物耐受性表现良好。
因此,试验最终确定lecanemab的90%有效剂量为“10 mg/kg,每两周1次”。
2 自适应平台试验
2.1 概 念
主方案设计的目标是同时评估分析多个并行的子试验,涵盖了各种治疗方法、疾病种类和亚群[27]。基于主方案设计的平台试验,秉持“以患者为中心”的治疗理念[28],在多种治疗方案中确定患者最优治疗,使研究人员更专注于疾病的治疗,而非单一试验。自适应平台试验(APT)是在平台试验中应用一种或多种适应性设计,通过增添新的子试验、提前终止无效子试验、重新估计样本量等动态调整的试验[29],以期提高试验的灵活性和操作性。主方案设计、适应性设计及APT三者之间的关系如图3所示。
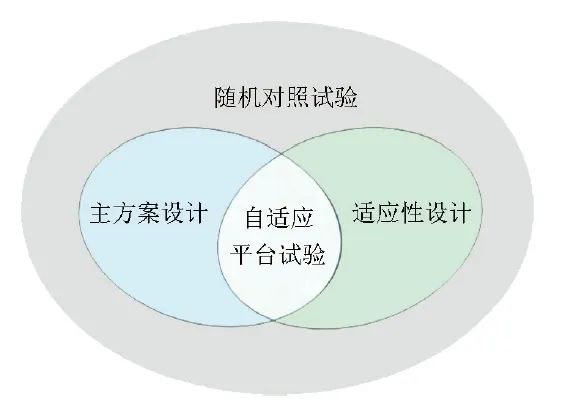
图3 主方案设计、适应性设计及自适应平台试验三者关系示意图
2.2 反应-适应性随机化设计
反应-适应性随机化(RAR)设计是指能够根据干预效果偏好的累积数据调整患者随机分组的比例,新入组的患者有很大机会被分配至疗效较好的治疗组,从而收集到更多丰富而有效的数据[30]。平台试验的设置环境复杂,可采用RAR设计以减小操作风险。
首先,通过计算机仿真模拟,RAR设计能够帮助研究人员优化试验设计并减轻频繁计算样本量的负担[31];其次,RAR设计考虑了患者的预测或预后因素[32],优先将患者分配至治疗效果更好的组别,前瞻性评估试验疗效。
2.3 多臂多阶段设计
多臂多阶段(MAMS)设计是一种被广泛使用的适应性设计,允许同时比较多个治疗组,并共享标准对照组,有效替代了传统单臂和双臂试验[33]。在平台试验过程中进行多次期中分析,评估治疗的有效性和安全性,并引入新的干预措施进行再次评估。MAMS一方面可显著减少无效治疗导致的资源浪费,另一方面通过将患者调整至有效治疗组,提高治疗效果并优化资源使用[34]。
3 临床应用
3.1 非传染病临床环境
在多发性硬化症[35]、AD[36]、脊髓损伤[37]等领域,APT取得了重要成果,加快了新疗法的临床评估进度。典型示例包括I-SPY 2试验和STAMPEDE试验。I-SPY 2试验属于Ⅱ期APT[38],旨在根据局部转移性乳腺癌患者的生物标志物改进患者亚群的治疗方案。
该试验包括2个对照组和5个治疗组,每种治疗至少对20例患者进行测试,最多对120例患者进行测试,根据生物标志物特征将患者随机分配至治疗组,采用RAR设计和贝叶斯分析方法以实现更高的统计效能。
STAMPEDE试验是首个大型多中心临床试验[39],采用MAMS设计,评估前列腺癌患者除标准护理外的5种新治疗策略,该试验包括5个治疗组和4次期中分析,各期中分析阶段的选择标准为:保留有效试验组,剔除无效试验组,最大程度提高试验效率和统计功效。该试验自2005年开始研究,预计20年内将进行至少10次随机治疗比较。
3.2 传染病大流行环境
近年来,由新型冠状病毒[40]、埃博拉病毒和寨卡病毒[41]等传染病病毒引发的突发公共卫生事件持续被关注。针对上述高发病率和死亡率的疾病,短时间内急需研发疫苗,评估抗病毒治疗的潜在疗效,MAMS平台试验成为抗击疫情的曙光[42]。
在2016年西非埃博拉疫情中,PALM试验研究了4种具有潜在抗埃博拉效力的治疗方案[43],2种治疗方案在期中分析后被舍弃,另外2种更有效的治疗方案被推进至下一阶段试验。该试验验证了MAMS平台试验在疫情暴发期间的高效运行,更重要的是能够及时提供有效的临床治疗方案。
为应对2019年底暴发的新型冠状病毒感染(COVID-19)疫情,英国大学开展的RECOVERY试验[44],先后评估了地塞米松、羟氯喹、洛匹那韦-利托那韦和阿奇霉素等抗病毒方法,展示了MAMS平台试验快速治疗COVID-19患者的优势。该试验最初以4个治疗组展开研究,并在试验设计确定后的9 d 内招募了1 2000余例患者,短时间内提供了临床转化成果,对临床实践和群体防治病毒感染产生了重要影响。
同期探索COVID-19新型疗法的APT也逐渐增加,如美国国家过敏和传染病研究所(NIAID)统筹协调的ACTT-3试验[45],在ACTT-1和ACTT-2试验成功的基础上,证明瑞德西韦减少了COVID-19住院患者的康复时间;此外,如TACTIC-R和TACTIC-E试验[46],主要研究目前已有的免疫调节药物和新型治疗药物或已批准药物的新型组合,是否可帮助COVID-19住院患者预防因病毒感染引发的肺部及其他器官严重损伤。
4 小结与展望
APT在不同疾病领域的探索研究,逐渐被用于工业药物早期的探索性试验,通过临床路径有效保障了群体健康[47]。然而,复杂高效的试验设计,很可能导致验证性试验进程变得缓慢[48],需应用合理的试验设计和统计分析方法以协调试验进度;在不同应用环境中,APT提供的新数据可能无法适用,可采用证据整合方法,如系统评价和Meta分析,将证据转化为临床应用,既可快速找到复杂疾病的有效治疗手段,又可研发新疫苗预防传染病危害。
适应性设计进一步推动了以患者为中心的研究。通过前期累积的试验数据,提前终止无效治疗或增加样本量,评估临床干预措施的效果差异,避免资源浪费,并使得研究结果能够更快传递给最需要的群体。但临床试验常常需要控制操作偏倚,如RAR设计的优势在于动态调整患者的随机化分组比例,降低无效暴露组的数量,从而减少研究成本和时间[49]。
在实际环境条件下,可能没有充足的时间和资金实施随机化,且晚入组的患者更有可能被分配至效果较好的治疗组,此时患者则会选择较晚参与试验,进而引入研究结果偏差[50]。在统计分析方面,目前广泛使用贝叶斯方法修正第Ⅰ类错误和控制统计偏差[51],由于试验环境的复杂多变,当前的贝叶斯方法可能无法准确评估和控制统计偏差,亟待统计学家和研究人员共同探索更多创新性的统计方法和分析工具。
同样,大规模的APT涉及国际多中心研究人员的合作、多项人力和财务资源的配置,需要领导者长期统筹,确保试验环节稳步推进[52]。因此,每项自适应平台试验的开展,均需政府、制药行业、临床研究机构等相关部门间的有效沟通和互相协调,严格把控试验环节,保证其高效、高质量运行。
参考文献
[1]杜艾桦. 药物临床试验适应性设计的科学性与伦理性问题[J]. 药物流行病学杂志, 2017, 26(12): 837-840.
[2]王雨宁, 徐畅, 邓可, 等. 适应性设计在临床试验中的应用[J]. 中国循证医学杂志, 2020, 20(4): 487-491.
[3]杨凯璇, 周齐, 姜英玉, 等. 适应性设计随机对照临床试验[J]. 中国卒中杂志, 2022, 17(10): 1152-1158.
[4]Randy W. Deputy commissioner for medical and scientific affairs[EB/OL]. (2006-07-10)[2023-11-26]. https://forums.lungevity.org/topic/21815-deputy-commissioner-for-medical-and-scientific-affairs/.
[5] European Medicines Agency. Reflection paper on methodological issues in confirmatory clinical trials planned with an adaptive design[EB/OL]. (2007-10-01)[2023-09-01]. https://www.ema.europa.eu/en/methodological-issues-confirmatory-clinical-trials-planned-adaptive-design-scientific-guideline.
[6]Collignon O, Koenig F, Koch A, et al. Adaptive designs in clinical trials: from scientific advice to marketing authorisa-tion to the European Medicine Agency[J]. Trials, 2018, 19(1): 642.
[7] Food and Drug Administration. Guidance for industry:adaptive design clinical trials for drugs and biologics[EB/OL]. (2010-02)[2023-09-01]. https://people.duke.edu/~ghturner/N492-Regulations%20and%20Guidelines/FDAdraft Guidance-AdaptiveStudiesUCM201790.pdf.
[8]Committee on Rules. Rules committee print 114-67: text of house amendment to the senate amendment to H.R.34, tsunami warning, education, and research act of 2015[EB/OL]. (2016-11-25)[2023-11-26]. https://docs.house.gov/billsthisweek/20161128/CPRT-114-HPRT-RU00-SAHR34.pdf.
[9]U.S. Food and Drug Administration. Adaptive design clinical trials for drugs and biologics guidance for industry[EB/OL]. (2019-11-29)[2023-11-26]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/adaptive-design-clinical-trials-drugs-and-biologics-guidance-industry.
[10]国家药品监督管理局药品审评中心. 药物临床试验适应性设计指导原则(试行)[EB/OL]. (2021-01-29)[2023-11-26]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=4409e51a403a911757af6caf3ecef129.
[11]衡明莉, 王北琪, 王骏. 对美国FDA适应性设计指导原则的介绍[J]. 中国临床药理学杂志, 2019, 35(12): 1316-1320.
[12]Wasson J M S, Dimairo M, Biggs K, et al. Practical guidance for planning resources required to support publicly-funded adaptive clinical trials[J]. BMC Med, 2022, 20(1): 254.
[13]Burnett T, Mozgunov P, Pallmann P, et al. Adding flexibility to clinical trial designs: an example-based guide to the practical use of adaptive designs[J]. BMC Med, 2020, 18(1): 352.
[14]Pallmann P, Bedding A W, Choodari-Oskooei B, et al. Adaptive designs in clinical trials: why use them, and how to run and report them[J]. BMC Med, 2018, 16(1): 29.
[15]Jones R L, Ravi V, Brohl A S, et al. Efficacy and safety of TRC105 plus pazopanib vs pazopanib alone for treatment of patients with advanced angiosarcoma: a randomized clinical trial[J]. JAMA Oncol, 2022, 8(5): 740-747.
[16]Perkins G D, Quinn T, Deakin C D, et al. Pre-hospital assessment of the role of adrenaline: measuring the effective-ness of drug administration in cardiac arrest (PARAMEDIC-2): Trial protocol[J]. Resuscitation, 2016, 108: 75-81.
[17]Perkins G D, Ji C, Deakin C D, et al. A randomized trial of epinephrine in out-of-hospital cardiac arrest[J]. N Engl J Med, 2018, 379(8): 711-721.
[18]Kapur J, Elm J, Chamberlain J M, et al. Randomized trial of three anticonvulsant medications for status epilepticus[J]. N Engl J Med, 2019, 381(22): 2103-2113.
[19]Suchting R, Green C E, De Dios C, et al. Citalopram for treatment of cocaine use disorder: a Bayesian drop-the-loser randomized clinical trial[J]. Drug Alcohol Depend, 2021, 228: 109054.
[20]Filozof C, Chow S C, Dimick-Santos L, et al. Clinical endpoints and adaptive clinical trials in precirrhotic nonalcoholic steatohepatitis: facilitating development approaches for an emerging epidemic[J]. Hepatol Commun, 2017, 1(7): 577-585.
[21]Dawson S N, Chiu Y D, Klein A A, et al. Effect of high-flow nasal therapy on patient-centred outcomes in patients at high risk of postoperative pulmonary complications after cardiac surgery: a statistical analysis plan for NOTACS, a multicentre adaptive randomised controlled trial[J]. Trials, 2022, 23(1): 699.
[22]Sevransky J E, Rothman R E, Hager D N, et al. Effect of vitamin C, thiamine, and hydrocortisone on ventilator- and vasopressor-free days in patients with sepsis: the VICTAS randomized clinical trial[J]. JAMA, 2021, 325(8): 742-750.
[23]Giovagnoli A. The Bayesian design of adaptive clinical trials[J]. Int J Environ Res Public Health, 2021, 18(2): 530.
[24]Lai T L, Lavori P W, Shih M C. Adaptive trial designs[J]. Annu Rev Pharmacol Toxicol, 2012, 52: 101-110.
[25]Grayling M J, Wheeler G M. A review of available software for adaptive clinical trial design[J]. Clin Trials, 2020, 17(3): 323-331.
[26]Swanson C J, Zhang Y, Dhadda S, et al. Correction to: A randomized, double-blind, phase 2b proof-of-concept clinical trial in early Alzheimer's disease with lecanemab, an anti-Aβ protofibril antibody[J]. Alzheimers Res Ther, 2022, 14(1): 70.
[27]Hager D N, Hooper M H, Bernard G R, et al. The vitamin C, thiamine and steroids in sepsis (VICTAS) protocol: a prospective, multi-center, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial[J]. Trials, 2019, 20(1): 197.
[28]Sudhop T, Brun N C, Riedel C, et al. Master protocols in clinical trials: a universal Swiss Army knife?[J]. Lancet Oncol, 2019, 20(6): e336-e342.
[29]Hirakawa A, Asano J, Sato H, et al. Master protocol trials in oncology: review and new trial designs[J]. Contemp Clin Trials Commun, 2018, 12: 1-8.
[30]The Adaptive Platform Trials Coalition. Adaptive platform trials: definition, design, conduct and reporting considerations[J]. Nat Rev Drug Discov, 2019, 18(10): 797-807.
[31]金秋百, 张颖, 姜枫, 等. 反应适应性随机的实施要点及其在中医药临床研究中的应用前景[J]. 中医杂志, 2021, 62(17): 1478-1483.
[32]Berry S M, Connor J T, Lewis R J. The platform trial: an efficient strategy for evaluating multiple treatments[J]. JAMA, 2015, 313(16): 1619-1620.
[33]Hey S P, Kimmelman J. Are outcome-adaptive allocation trials ethical?[J]. Clin Trials, 2015, 12(2): 102-106.
[34]Parmar M K, Sydes M R, Cafferty F H, et al. Testing many treatments within a single protocol over 10 years at MRC Clinical Trials Unit at UCL: multi-arm, multi-stage platform, umbrella and basket protocols[J]. Clin Trials, 2017, 14(5): 451-461.
[35]Riddell C A, Zhao Y S, Petkau J. An adaptive clinical trials procedure for a sensitive subgroup examined in the multiple sclerosis context[J]. Stat Methods Med Res, 2016, 25(4): 1330-1345.
[36]Wang G Q, Kennedy R E, Cutter G R, et al. Effect of sample size re-estimation in adaptive clinical trials for Alzheimer's disease and mild cognitive impairment[J]. Alzheimers Dement (N Y), 2015, 1(1): 63-71.
[37]Meurer W J, Barsan W G. Spinal cord injury neuroprotection and the promise of flexible adaptive clinical trials[J]. World Neurosurg, 2014, 82(3/4): e541-e546.
[38]Rugo H S, Olopade O I, DeMichele A, et al. Adaptive randomization of veliparib-carboplatin treatment in breast cancer[J]. N Engl J Med, 2016, 375(1): 23-34.
[39]James N D, Sydes M R, Clarke N W, et al. Systemic therapy for advancing or metastatic prostate cancer (STAMPEDE): a multi-arm, multistage randomized controlled trial[J]. BJU Int, 2009, 103(4): 464-469.
[40]Petersen E, Koopmans M, Go U, et al. Comparing SARS-CoV-2 with SARS-CoV and influenza pandemics[J]. Lancet Infect Dis, 2020, 20(9): e238-e244.
[41]Khubchandani J, Jordan T R, Yang Y T. Ebola, Zika, Corona…What is next for our world?[J]. Int J Environ Res Public Health, 2020, 17(9): 3171.
[42]Ellenberg S S. Clinical trials in the time of a pandemic[J]. Clin Trials, 2020, 17(5): 467-471.
[43]Mulangu S, Dodd L E, Davey R T, Jr, et al. A randomized, controlled trial of Ebola virus disease therapeutics[J]. N Engl J Med, 2019, 381(24): 2293-2303.
[44]The RECOVERY Collaborative Group. Dexamethasone in hospitalized patients with COVID-19[J]. N Engl J Med, 2021, 384(8): 693-704.
[45]Beigel J H, Tomashek K M, Dodd L E, et al. Remdesivir for the treatment of COVID-19-final report[J]. N Engl J Med, 2020, 383(19): 1813-1826.
[46]Noor N M, Pett S L, Esmail H, et al. Adaptive platform trials using multi-arm, multi-stage protocols: getting fast answers in pandemic settings[J]. F1000Res, 2020, 9: 1109.
[47]Morgan CC, Huyck S, Jenkins M, et al. Adaptive design: results of 2012 survey on perception and use[J]. Ther Innov Regul Sci, 2014, 48(4): 473-481.
[48]Bothwell L E, Avorn J, Khan N F, et al. Adaptive design clinical trials: a review of the literature and ClinicalTrials.gov[J]. BMJ Open, 2018, 8(2): e018320.
[49]赵超. 临床适应性设计与药物评价的考虑[J]. 中国临床药理学与治疗学, 2008, 13(1): 1-5.
[50]钱真真, 周莎, 于亚南, 等. 适应性随机化及其在临床试验中的应用操作要点[J]. 中国循证医学杂志, 2022, 22(8): 971-977.
[51]范扬. 贝叶斯响应适应性随机化及其交互式Web应用实现[D]. 南京: 东南大学, 2020.
[52] Wright K, Ali J, Davies A, et al. Ethical priorities for international collaborative adaptive platform trials for public health emergencies[J]. BMJ Glob Health, 2023,8(7): e012930.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#临床研究# #自适应平台试验#
10